REKLAMA
Akty ujednolicone - rok 2007 nr 43 poz. 13
DYREKTYWA KOMISJI 2007/6/WE
z dnia 14 lutego 2007 r.
zmieniająca dyrektywę Rady 91/414/EWG w celu włączenia metrafenonu, bakterii Bacillus subtilis, spinosadu i tiametoksamu jako substancji czynnych
(Tekst mający znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
uwzględniając Traktat ustanawiający Wspólnotę Europejską,
uwzględniając dyrektywę Rady 91/414/EWG z dnia 15 lipca 1991 r. dotyczącą wprowadzania do obrotu środków ochrony roślin (1), w szczególności jej art. 6 ust. 1,
a także mając na uwadze, co następuje:
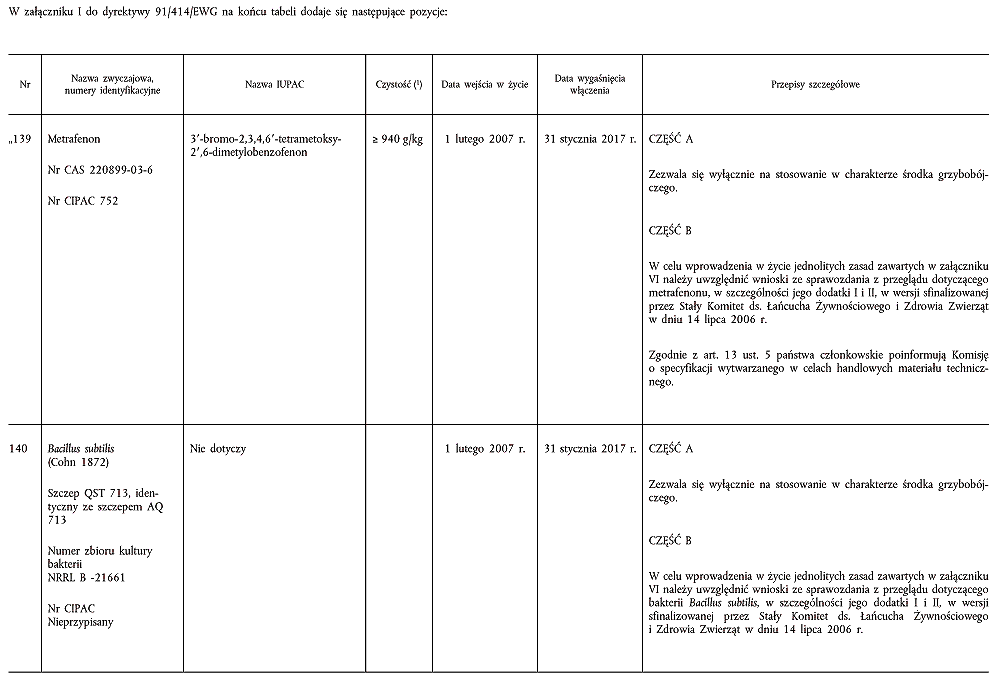
(1) Zgodnie z art. 6 ust. 2 dyrektywy 91/414/EWG, w dniu 4 czerwca 2002 r. Zjednoczone Królestwo otrzymało od firmy BASF AG z siedzibą w Belgii wniosek o włączenie substancji czynnej o nazwie metrafenon do załącznika I do dyrektywy 91/414/EWG. W decyzji Komisji 2003/105/WE (2) potwierdzono, że przedłożona dokumentacja jest „kompletna”, tzn. uznano, iż zasadniczo spełnia ona wymogi dotyczące danych i informacji przewidziane w załącznikach II i III do dyrektywy 91/414/EWG.
(2) Zgodnie z art. 6 ust. 2 dyrektywy 91/414/EWG, w dniu 19 kwietnia 2000 r. Niemcy otrzymały od firmy AgraQuest wniosek o włączenie substancji czynnej o nazwie Bacillus subtilis, szczep QST 713 (zwanej dalej „bakterią Bacillus subtilis”) do załącznika I do dyrektywy 91/414/EWG. W decyzji Komisji 2001/6/WE (3) potwierdzono, że przedłożona dokumentacja jest „kompletna”, tzn. uznano, iż zasadniczo spełnia ona wymogi dotyczące danych i informacji przewidziane w załącznikach II i III do dyrektywy 91/414/EWG.
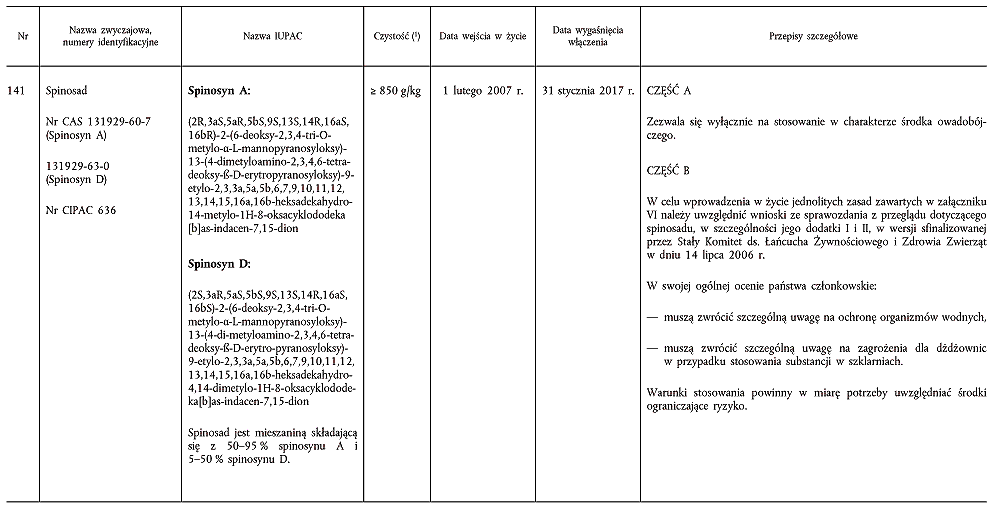
(3) Zgodnie z art. 6 ust. 2 dyrektywy 91/414/EWG, w dniu 19 lipca 1999 r. Niderlandy otrzymały od firmy Dow AgroSciences wniosek o włączenie substancji o nazwie spinosad do załącznika I do dyrektywy 91/414/EWG. W decyzji Komisji 2000/210/WE (4) potwierdzono, że przedłożona dokumentacja jest „kompletna”, tzn. uznano, iż zasadniczo spełnia ona wymogi dotyczące danych i informacji przewidziane w załącznikach II i III do dyrektywy 91/414/EWG.
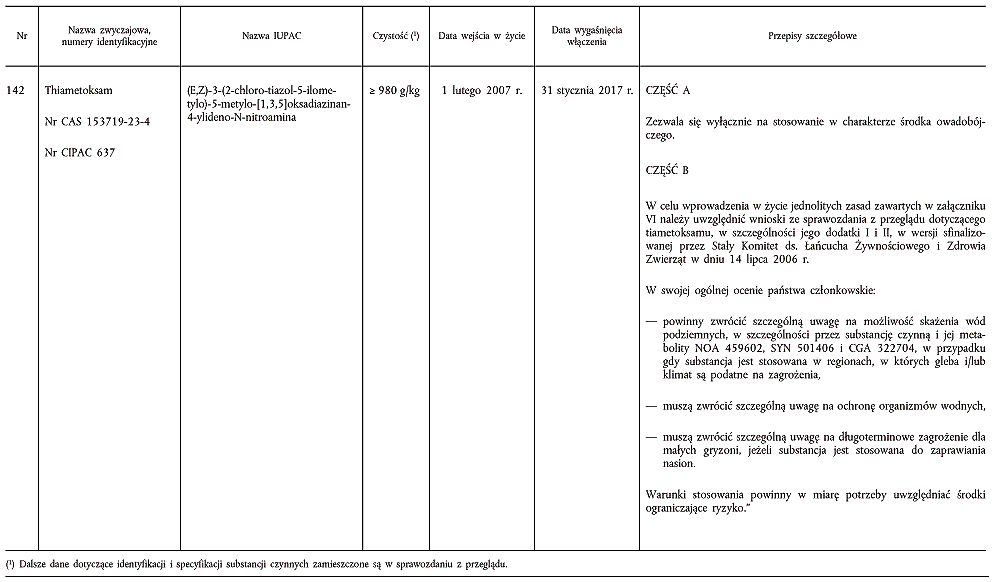
(4) Zgodnie z art. 6 ust. 2 dyrektywy 91/414/EWG, w dniu 17 marca 1999 r. Hiszpania otrzymała od firmy Novartis Crop Protection AG (obecnie Syngenta) wniosek o włączenie substancji czynnej o nazwie tiametoksam do załącznika I do dyrektywy 91/414/EWG. W decyzji Komisji 2000/181/WE (5) potwierdzono, że przedłożona dokumentacja jest „kompletna”, tzn. uznano, iż zasadniczo spełnia ona wymogi dotyczące danych i informacji przewidziane w załącznikach II i III do dyrektywy 91/414/EWG.
(5) Wpływ tych substancji czynnych na zdrowie ludzi oraz środowisko został poddany ocenie w odniesieniu do zastosowań proponowanych przez wnioskodawców, zgodnie z art. 6 ust. 2 i ust. 4 dyrektywy 91/414/EWG. Wyznaczone państwa członkowskie pełniące rolę sprawozdawców przedłożyły projekty sprawozdania z oceny substancji Europejskiemu Urzędowi ds. Bezpieczeństwa Żywności (EFSA) w dniu 31 października 2003 r. (metrafenon) i Komisji w dniu 15 maja 2001 r. (bakteria Bacillus subtilis), 5 marca 2001 r. (spinosad) i 21 stycznia 2002 r. (tiametoksam).
(6) Sprawozdanie z oceny metrafenonu zostało poddane przeglądowi przez państwa członkowskie oraz przez EFSA w ramach jego Grupy Roboczej ds. Oceny i przedstawione Komisji w dniu 18 stycznia 2005 r. w formie sprawozdania naukowego EFSA dotyczącego metrafenonu (6). Sprawozdanie to zostało poddane przeglądowi przez państwa członkowskie oraz Komisję w ramach Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt. Projekty sprawozdań z oceny dotyczące bakterii Bacillus subtilis, spinosadu i tiametoksamu zostały poddane przeglądowi przez państwa członkowskie oraz Komisję w ramach Stałego Komitetu ds. Łańcucha Pokarmowego i Zdrowia Zwierząt. Przegląd ten został sfinalizowany w dniu 14 lipca 2006 r. w formie sprawozdań Komisji z przeglądu dotyczących metrafenonu, bakterii Bacillus subtilis, spinosadu i tiametoksamu.
(7) Jak wykazały różnorodne badania, można oczekiwać, że środki ochrony roślin zawierające wspomniane substancje czynne zasadniczo spełniają wymogi określone w art. 5 ust. 1 lit. a) i b) oraz w art. 5 ust. 3 dyrektywy 91/414/EWG, w szczególności w przypadku zastosowań zbadanych i wyszczególnionych w sprawozdaniu Komisji z przeglądu. Należy zatem włączyć metrafenon, bakterię Bacillus subtilis, spinosad i tiametoksam do załącznika I do tej dyrektywy w celu umożliwienia wszystkim państwom członkowskim wydawania zezwoleń na środki ochrony roślin zawierające te substancje czynne zgodnie z przepisami wspomnianej dyrektywy.
(8) Nie naruszając określonych w dyrektywie 91/414/EWG obowiązków wynikających z włączenia substancji czynnej do załącznika I, państwom członkowskim należy przyznać okres sześciu miesięcy od daty włączenia na dokonanie przeglądu istniejących tymczasowych zezwoleń dotyczących środków ochrony roślin zawierających metrafenon, bakterię Bacillus subtilis, spinosad i tiametoksam w celu zagwarantowania, że spełnione zostaną wymogi ustanowione dyrektywą 91/414/EWG, w szczególności jej art. 13, oraz stosowne warunki określone w załączniku I. Państwa członkowskie powinny zastąpić istniejące tymczasowe zezwolenia zezwoleniami pełnymi, wprowadzić do nich zmiany lub wycofać je zgodnie z przepisami dyrektywy 91/414/EWG. W drodze odstępstwa od powyższego terminu należy przyznać dłuższy okres na przedłożenie i ocenę pełnej dokumentacji wyszczególnionej w załączniku III dla każdego środka ochrony roślin przeznaczonego do każdego zamierzonego zastosowania, zgodnie z jednolitymi zasadami ustanowionymi w dyrektywie 91/414/EWG.
(9) Należy zatem odpowiednio zmienić dyrektywę 91/414/EWG.
(10) Środki przewidziane w niniejszej dyrektywie są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt,
PRZYJMUJE NINIEJSZĄ DYREKTYWĘ:
Artykuł 1
W załączniku I do dyrektywy 91/414/EWG wprowadza się zmiany zgodnie z Załącznikiem do niniejszej dyrektywy.
Artykuł 2
1. Państwa członkowskie przyjmują i publikują przepisy ustawowe, wykonawcze i administracyjne niezbędne do wykonania niniejszej dyrektywy najpóźniej do dnia 31 lipca 2007 r.
Państwa członkowskie niezwłocznie przekazują Komisji tekst tych przepisów oraz tabelę korelacji między tymi przepisami a niniejszą dyrektywą.
Państwa członkowskie stosują wymienione przepisy od dnia 1 sierpnia 2007 r.
Przepisy przyjęte przez państwa członkowskie zawierają odesłanie do niniejszej dyrektywy lub odesłanie takie towarzyszy ich urzędowej publikacji. Metody dokonania takiego odesłania określane są przez państwa członkowskie.
2. Państwa członkowskie przedstawiają Komisji teksty głównych przepisów prawa krajowego przyjętych w obszarze objętym niniejszą dyrektywą.
Artykuł 3
1. Zgodnie z dyrektywą 91/414/EWG, państwa członkowskie do dnia 31 lipca 2007 r. w razie konieczności odpowiednio zmieniają lub wycofują istniejące zezwolenia dla środków ochrony roślin zawierających metrafenon, bakterię Bacillus subtilis, spinosad lub tiametoksam jako substancje czynne. W tym terminie państwa członkowskie sprawdzą w szczególności, czy spełnione są warunki określone w załączniku I do wymienionej dyrektywy, odnoszące się odpowiednio do metrafenonu, bakterii Bacillus subtilis, spinosadu i tiametoksamu, z wyjątkiem warunków określonych w części B zapisu dotyczącego tych substancji czynnych, oraz czy posiadacz zezwolenia dysponuje dokumentacją spełniającą wymagania określone w załączniku II do wymienionej dyrektywy lub ma dostęp do takiej dokumentacji, zgodnie z warunkami art.13 ust. 2.
2. W drodze odstępstwa od ust. 1, państwa członkowskie dokonują ponownej oceny każdego dopuszczonego do obrotu środka ochrony roślin zawierającego metrafenon, bakterię Bacillus subtilis, spinosad lub tiametoksam jako jedyną substancję czynną lub jako jedną z kilku substancji czynnych, wyszczególnionych w załączniku I do dyrektywy 91/414/EWG najpóźniej do dnia 31 stycznia 2007 r., zgodnie z jednolitymi zasadami określonymi w załączniku VI do dyrektywy 91/414/EWG, na podstawie dokumentacji zgodnej z wymogami określonymi w załączniku III do wymienionej dyrektywy i z uwzględnieniem części B zapisu w załączniku I do wymienionej dyrektywy dotyczącego metrafenonu, bakterii Bacillus subtilis, spinosadu lub tiametoksamu. Na podstawie powyższej oceny państwa członkowskie określają, czy środek spełnia warunki ustanowione w art. 4 ust. 1 lit. b), c), d) i e) dyrektywy 91/414/EWG.
Po dokonaniu takich ustaleń państwa członkowskie:
a) w przypadku środka zawierającego metrafenon, bakterię Bacillus subtilis, spinosad lub tiametoksam jako jedyną substancję czynną, w razie konieczności zmieniają lub wycofują zezwolenie na każdy taki środek najpóźniej do dnia 31 lipca 2008 r.; lubb) w przypadku środka zawierającego metrafenon lub bakterię Bacillus subtilis lub spinosad lub tiametoksam jako jedną z kilku substancji czynnych, w razie konieczności zmieniają lub wycofują zezwolenie do dnia 31 lipca 2008 r. lub w terminie ustalonym dla takiej zmiany lub wycofania we właściwej dyrektywie lub dyrektywach włączających taką substancję lub substancje do załącznika I do dyrektywy 91/414/EWG, biorąc pod uwagę tę datę, która jest późniejsza.
Artykuł 4
Niniejsza dyrektywa wchodzi w życie z dniem 1 lutego 2007 r.
Artykuł 5
Niniejsza dyrektywa skierowana jest do państw członkowskich.
Sporządzono w Brukseli, dnia 14 lutego 2007 r.
| W imieniu Komisji |
| Markos KYPRIANOU |
| Członek Komisji |
|
|
(1) Dz.U. L 230 z 19.8.1991, str. 1. Dyrektywa ostatnio zmieniona dyrektywą Komisji 2006/136/WE (Dz.U. L 349 z 12.12.2006, str. 42).
(2) Dz.U. L 43 z 18.2.2003, str. 45.
(3) Dz.U. L 2 z 5.1.2001, str. 25.
(4) Dz.U. L 64 z 11.3.2000, str. 24.
(5) Dz.U. L 57 z 2.3.2000, str. 35.
(6) EFSA Scientific Report (2006) 58, 1-72, Conclusion regarding the Peer review of the pesticide risk assessment of the active substance metrafenone (Sprawozdanie naukowe EFSA (2006) 58, 1-72, Wnioski z przeglądu w ramach oceny zagrożeń stwarzanych przez pestycydy, dotyczącego substancji czynnej metrafenon) (sfinalizowano w dniu 13 stycznia 2006 r.).
ZAŁĄCZNIK
- Data ogłoszenia: 2007-02-15
- Data wejścia w życie: 2007-02-01
- Data obowiązywania: 2007-02-01
REKLAMA
Akty ujednolicone
REKLAMA
REKLAMA

