REKLAMA
Dziennik Ustaw - rok 2020 poz. 2095
ROZPORZĄDZENIE
MINISTRA ZDROWIA1)
z dnia 3 listopada 2020 r.
zmieniające rozporządzenie w sprawie sposobu dokonywania zgłoszeń i powiadomień dotyczących wyrobów
Na podstawie art. 65 ust. 2 ustawy z dnia 20 maja 2010 r. o wyrobach medycznych (Dz. U. z 2020 r. poz. 186 i 1493) zarządza się, co następuje:
§ 1. [Rozporządzenie w sprawie sposobu dokonywania zgłoszeń i powiadomień dotyczących wyrobów]
1) odnośnik nr 2 otrzymuje brzmienie:
„2) Niniejsze rozporządzenie służy wykonaniu decyzji Komisji (UE) nr 2010/227/UE z dnia 19 kwietnia 2010 r. w sprawie europejskiej bazy danych o wyrobach medycznych (Eudamed) (Dz. Urz. UE L 102 z 23.04.2010, str. 45), rozporządzenia Parlamentu Europejskiego i Rady (UE) 2017/745 z dnia 5 kwietnia 2017 r. w sprawie wyrobów medycznych, zmiany dyrektywy 2001/83/WE, rozporządzenia (WE) nr 178/2002 i rozporządzenia (WE) nr 1223/2009 oraz uchylenia dyrektyw Rady 90/385/EWG i 93/42/EWG (Dz. Urz. UE L 117 z 05.05.2017, str. 1), rozporządzenia Parlamentu Europejskiego i Rady (UE) 2017/746 z dnia 5 kwietnia 2017 r. w sprawie wyrobów medycznych do diagnostyki in vitro oraz uchylenia dyrektywy 98/79/WE i decyzji Komisji 2010/227/UE (Dz. Urz. UE L 117 z 05.05.2017, str. 176) oraz rozporządzenia Parlamentu Europejskiego i Rady (UE) 2020/561 z dnia 23 kwietnia 2020 r. zmieniającego rozporządzenie (UE) 2017/745 w sprawie wyrobów medycznych w odniesieniu do dat rozpoczęcia stosowania niektórych jego przepisów (Dz. Urz. UE L 130 z 24.04.2020, str. 18).”;
2) użyty w § 3 ust. 1, w § 4 ust. 1 pkt 2, ust. 2 pkt 2, ust. 3 we wprowadzeniu do wyliczenia, ust. 4 pkt 1 i 2, w § 5 ust. 2, w § 6 ust. 1 pkt 2 i ust. 2 pkt 3, w różnej liczbie i w różnych przypadkach, wyraz „wytwórca” zastępuje się użytymi w odpowiedniej liczbie i odpowiednim przypadku wyrazami „wytwórca (producent)”;
3) użyte w § 3 ust. 1 i w § 4 ust. 3 wyrazy „oznakowanych znakiem CE” zastępuje się wyrazami „oznakowanych znakiem CE (noszących oznakowanie CE)”;
4) w § 3 ust. 2 otrzymuje brzmienie:
„2. Wzór formularza zgłoszenia danych dotyczących wyrobów medycznych do diagnostyki in vitro, w tym wyrobów do oceny działania, wyrobów do badania działania i wyrobów medycznych do diagnostyki in vitro wytworzonych na własny użytek przez medyczne laboratorium diagnostyczne lub inny podmiot, lub powiadomienia o rozpoczęciu na terytorium Rzeczypospolitej Polskiej oceny działania (badania działania) wyrobów do oceny działania i wyrobów do badania działania jest określony w załączniku nr 3 do rozporządzenia.”;
5) w § 4:
a) w ust. 2 we wprowadzeniu do wyliczenia wyrazy „wyrobu do oceny działania” zastępuje się wyrazami „wyrobu do oceny działania, wyrobu do badania działania”,
b) ust. 5 otrzymuje brzmienie:
„5. W celu dokonania powiadomienia o rozpoczęciu wykonywania na terytorium Rzeczypospolitej Polskiej oceny działania (badania działania) wyrobu do oceny działania albo wyrobu do badania działania świadczeniodawca dokonujący powiadomienia wypełnia:
1) formularz, o którym mowa w § 2;
2) odpowiednią liczbę formularzy, o których mowa w § 3 ust. 2; dla każdego wyrobu do oceny działania i wyrobu do badania działania wypełnia się jeden formularz.”;
6) w § 5 ust. 3–5 otrzymują brzmienie:
„3. W celu zmiany danych objętych powiadomieniem dotyczących nazwy lub adresu podmiotu dokonującego powiadomienia podmiot wypełnia formularz, o którym mowa w § 2, jeden dla wszystkich wytwórców (producentów), dla których dokonał powiadomienia o wyrobach, oraz dołącza dokumenty, których treść uległa zmianie.
4. W celu zmiany danych objętych powiadomieniem dotyczących nazwy lub adresu autoryzowanego przedstawiciela (upoważnionego przedstawiciela) podmiot wypełnia formularz, o którym mowa w § 2, oraz odpowiednią liczbę formularzy, o których mowa w § 3 ust. 3, oraz dołącza dokumenty, których treść uległa zmianie.
5. W celu zmiany danych wynikającej z przekazania obowiązków na inny podmiot, w szczególności ze względu na przekształcenie, ogłoszenie upadłości albo przejęcie praw i obowiązków wynikających z przepisów ustawy przez następcę prawnego, podmiot przejmujący wypełnia formularz, o którym mowa w § 2, a w przypadku gdy zmiana dotyczy wytwórcy (producenta) lub autoryzowanego przedstawiciela (upoważnionego przedstawiciela), podmiot przejmujący dodatkowo wypełnia odpowiednią liczbę formularzy, o których mowa w § 3 ust. 1 i 2, oraz dołącza dokumenty, których treść uległa zmianie; dla każdego wyrobu danego wytwórcy wypełnia się jeden formularz.”;
7) użyte w § 6 w ust. 2 we wprowadzeniu do wyliczenia oraz w pkt 2 i 3, w różnych przypadkach, wyrazy „autoryzowany przedstawiciel” zastępuje się użytymi w odpowiednim przypadku wyrazami „autoryzowany przedstawiciel (upoważniony przedstawiciel)”;
8) § 7 otrzymuje brzmienie:
„§ 7. 1. Zgłoszeń, o których mowa w § 4 ust. 1–3, i powiadomień, o których mowa w § 4 ust. 4 i 5, oraz zgłoszenia zmiany danych, o których mowa w § 5 ust. 1–5, dokonuje się na formularzach, które:
1) przesyła się listownie w postaci papierowej i w postaci dokumentu elektronicznego albo
2) wnosi się w postaci elektronicznej, na elektroniczną skrzynkę podawczą Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, po ich uprzednim opatrzeniu podpisem zaufanym, podpisem osobistym lub kwalifikowanym podpisem elektronicznym, albo
3) składa się w siedzibie Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych w postaci papierowej i w postaci dokumentu elektronicznego.
2. W przypadku, o którym mowa w:
1) ust. 1 pkt 1 i 3, papierową postać zgłoszenia, powiadomienia lub zgłoszenia zmiany danych sporządza się, wypełniając interaktywne formularze pobrane ze strony internetowej Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych i dokonując ich wydruku. Dokument elektroniczny sporządza się, zapisując dane z wypełnionych formularzy bezpośrednio po ich wydrukowaniu;
2) ust. 1 pkt 2, postać elektroniczną sporządza się, wypełniając interaktywne formularze pobrane ze strony internetowej Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Dokument elektroniczny sporządza się, zapisując dane z wypełnionych formularzy.
3. Dokumentację towarzyszącą zgłoszeniu lub powiadomieniu składa się w postaci papierowej lub w postaci dokumentu elektronicznego, która może obejmować wzory:
1) oznakowania wyrobu;
2) instrukcji używania;
3) materiałów promocyjnych.
4. Do zgłoszenia, powiadomienia lub zgłoszenia zmiany danych dołącza się dokument elektroniczny zgłoszenia, powiadomienia lub zgłoszenia zmiany danych oraz dokumentację towarzyszącą w postaci, odpowiednio, odrębnych plików zapisanych na nośniku optycznym (CD lub DVD) do jednorazowego zapisu, innym nośniku lub w postaci elektronicznej, o której mowa w ust. 1 pkt 2.”;
9) załączniki nr 1–4 do rozporządzenia otrzymują brzmienie określone odpowiednio w załącznikach nr 1–4 do niniejszego rozporządzenia.
§ 2. [Wejście w życie]
Minister Zdrowia: A. Niedzielski
1) Minister Zdrowia kieruje działem administracji rządowej - zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 27 sierpnia 2020 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. poz. 1470 i 1541).
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 3 listopada 2020 r. (poz. 2095)
Załącznik nr 1
WZÓR - FORMULARZ DLA PODMIOTÓW

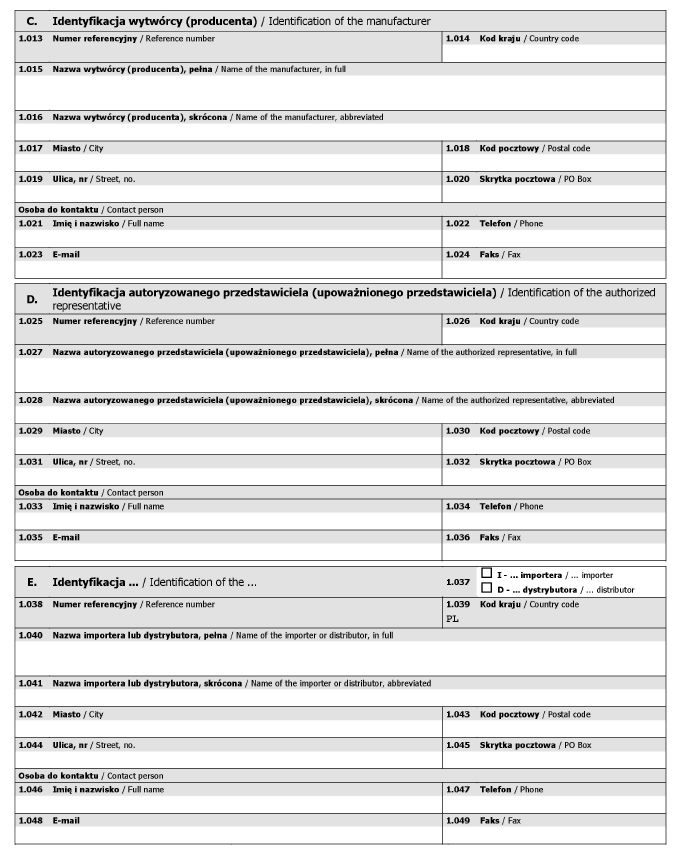
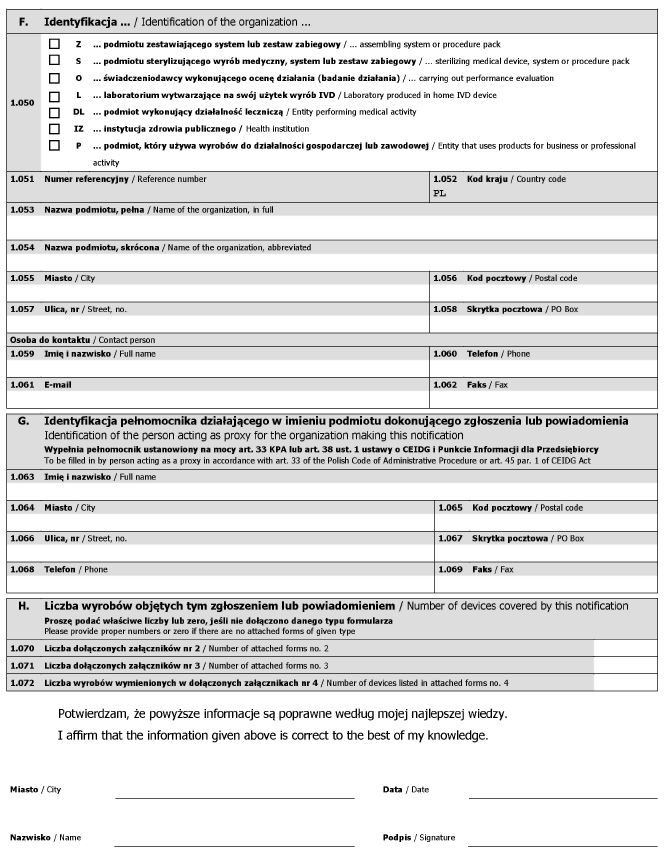
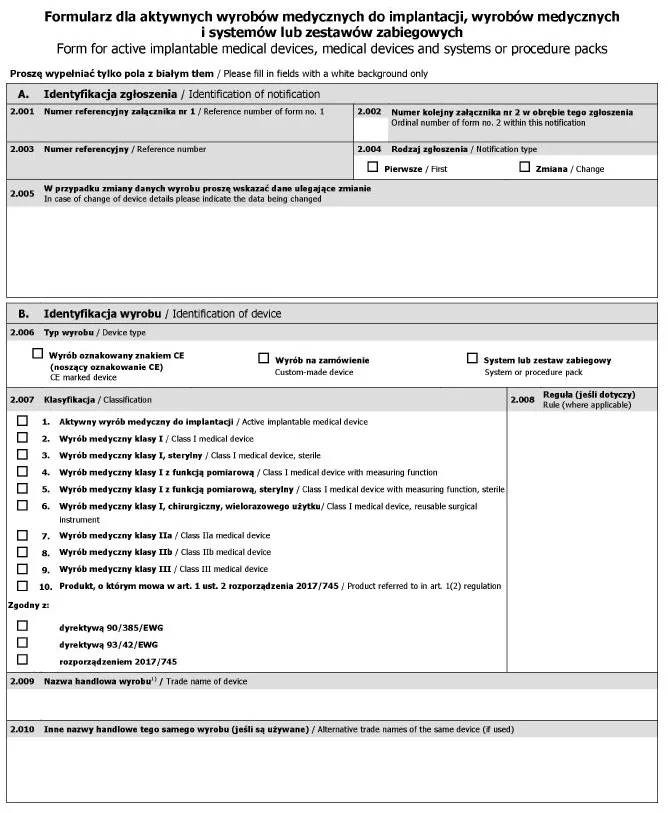
Załącznik nr 2
WZÓR - FORMULARZ DLA AKTYWNYCH WYROBÓW MEDYCZNYCH DO IMPLANTACJI, WYROBÓW MEDYCZNYCH I SYSTEMÓW LUB ZESTAWÓW ZABIEGOWYCH


Załącznik nr 3
WZÓR - FORMULARZ DLA WYROBÓW MEDYCZNYCH DO DIAGNOSTYKI IN VITRO



Załącznik nr 4
WZÓR - WYKAZ WYROBÓW OBJĘTYCH POWIADOMIENIEM
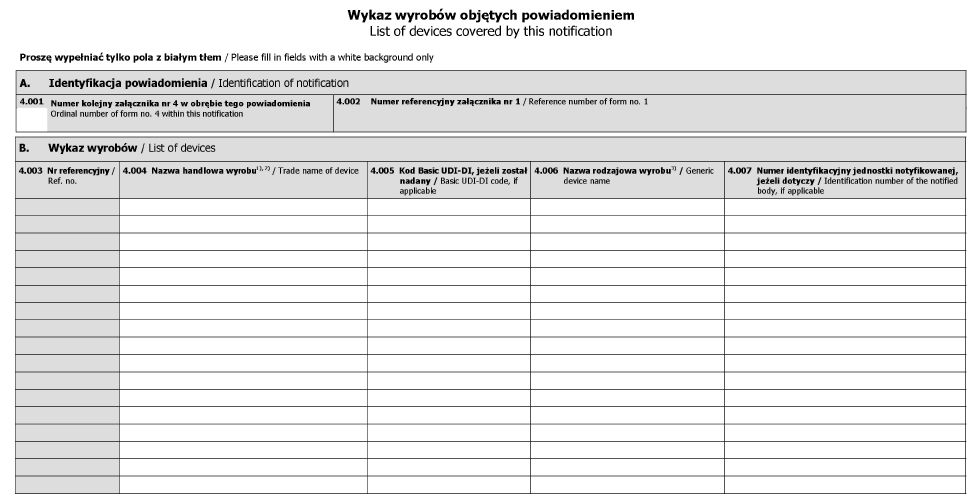

- Data ogłoszenia: 2020-11-27
- Data wejścia w życie: 2020-12-12
- Data obowiązywania: 2020-12-12
- Dokument traci ważność: 2022-05-26
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
