REKLAMA
Dziennik Ustaw - rok 2016 poz. 210
ROZPORZĄDZENIE
MINISTRA ZDROWIA1)
z dnia 17 lutego 2016 r.
w sprawie sposobu dokonywania zgłoszeń i powiadomień dotyczących wyrobów2)
Na podstawie art. 65 ust. 2 ustawy z dnia 20 maja 2010 r. o wyrobach medycznych (Dz. U. z 2015 r. poz. 876 i 1918) zarządza się, co następuje:
§ 1. [Zakres regulacji]
1) wzory formularzy zgłoszeń i powiadomień, o których mowa w art. 58 i art. 61 ustawy z dnia 20 maja 2010 r. o wyrobach medycznych, zwanej dalej „ustawą”;
2) sposób zgłaszania zmiany danych objętych zgłoszeniem i powiadomieniem;
3) sposób zgłaszania zaprzestania wprowadzania wyrobu do obrotu, zaprzestania pełnienia funkcji autoryzowanego przedstawiciela oraz zaprzestania prowadzenia działalności, która na podstawie ustawy podlega zgłoszeniu lub powiadomieniu;
4) sposób przekazywania Prezesowi Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych formularzy oraz dokumentów dołączanych do zgłoszenia lub powiadomienia.
§ 2. [Formularz wypełniany przez podmiot dokonujący zgłoszenia lub powiadomienia]
§ 3. [Wzór formularza]
2. Wzór formularza zgłoszenia danych dotyczących wyrobów medycznych do diagnostyki in vitro, w tym wyrobów do oceny działania i wyrobów medycznych do diagnostyki in vitro wytworzonych na własny użytek przez medyczne laboratorium diagnostyczne lub inny podmiot, lub powiadomienia o rozpoczęciu na terytorium Rzeczypospolitej Polskiej oceny działania wyrobów do oceny działania jest określony w załączniku nr 3 do rozporządzenia.
3. Wzór formularza powiadomienia przez dystrybutora albo importera o wprowadzeniu na terytorium Rzeczypospolitej Polskiej aktywnych wyrobów medycznych do implantacji, wyrobów medycznych, systemów lub zestawów zabiegowych lub wyrobów medycznych do diagnostyki in vitro jest określony w załączniku nr 4 do rozporządzenia.
§ 4. [Formularz wypełniany w celu dokonania pierwszego zgłoszenia]
1) formularz, o którym mowa w § 2;
2) odpowiednią liczbę formularzy, o których mowa w § 3 ust. 1; dla każdego wyrobu danego wytwórcy wypełnia się jeden formularz.
2. W celu dokonania zgłoszenia pierwszego wyrobu medycznego do diagnostyki in vitro, w tym wyrobu do oceny działania i wyrobu medycznego do diagnostyki in vitro wytworzonego na własny użytek przez medyczne laboratorium diagnostyczne lub inny podmiot, podmiot dokonujący zgłoszenia wypełnia:
1) formularz, o którym mowa w § 2;
2) odpowiednią liczbę formularzy, o których mowa w § 3 ust. 2; dla każdego wyrobu danego wytwórcy wypełnia się jeden formularz.
3. W celu dokonania zgłoszenia pierwszego systemu lub zestawu zabiegowego albo działalności polegającej na sterylizacji systemów, zestawów zabiegowych lub wyrobów medycznych oznakowanych znakiem CE przeznaczonych przez ich wytwórców do sterylizacji przed użyciem podmiot dokonujący zgłoszenia wypełnia:
1) formularz, o którym mowa w § 2;
2) odpowiednią liczbę formularzy, o których mowa w § 3 ust. 1; dla każdego systemu lub zestawu zabiegowego – zestawianego lub sterylizowanego, a także dla sterylizowanego wyrobu medycznego wypełnia się jeden formularz.
4. W celu dokonania powiadomienia o wprowadzeniu na terytorium Rzeczypospolitej Polskiej pierwszego: aktywnego wyrobu medycznego do implantacji, wyrobu medycznego, systemu lub zestawu zabiegowego lub wyrobu medycznego do diagnostyki in vitro podmiot dokonujący powiadomienia wypełnia:
1) formularz, o którym mowa w § 2; dla każdego wytwórcy, o którego wyrobach podmiot będzie powiadamiał, wypełnia się jeden formularz;
2) odpowiednią liczbę formularzy, o których mowa w § 3 ust. 3; dla każdego kolejnego wytwórcy wypełnia się osobne formularze zawierające informacje o maksymalnie 20 wyrobach.
5. W celu dokonania powiadomienia o rozpoczęciu wykonywania na terytorium Rzeczypospolitej Polskiej oceny działania wyrobu do oceny działania świadczeniodawca dokonujący powiadomienia wypełnia:
1) formularz, o którym mowa w § 2;
2) odpowiednią liczbę formularzy, o których mowa w § 3 ust. 2; dla każdego wyrobu do oceny działania wypełnia się jeden formularz.
§ 5. [Formularz wypełniany w celu zmiany danych]
2. W celu zmiany danych, o których mowa w art. 61 ust. 1a pkt 3 i 4 ustawy, podmiot wypełnia formularz, o którym mowa w § 2, oraz odpowiednią liczbę formularzy, o których mowa w § 3 ust. 1 lub 2; dla każdego wyrobu danego wytwórcy wypełnia się jeden formularz.
3. W celu zmiany danych objętych powiadomieniem dotyczących nazwy lub adresu podmiotu dokonującego powiadomienia podmiot wypełnia formularz, o którym mowa w § 2, jeden dla wszystkich wytwórców, dla których dokonał powiadomienia o wyrobach.
4. W celu zmiany danych objętych powiadomieniem dotyczących nazwy lub adresu autoryzowanego przedstawiciela podmiot wypełnia formularz, o którym mowa w § 2, oraz odpowiednią liczbę formularzy, o których mowa w § 3 ust. 3.
5. W celu zmiany danych wynikającej z przekazania obowiązków na inny podmiot, w szczególności ze względu na przekształcenie, ogłoszenie upadłości albo przejęcie praw i obowiązków wynikających z przepisów ustawy przez następcę prawnego, podmiot przejmujący wypełnia formularz, o którym mowa w § 2, a w przypadku gdy zmiana dotyczy wytwórcy lub autoryzowanego przedstawiciela, podmiot przejmujący dodatkowo wypełnia odpowiednią liczbę formularzy, o których mowa w § 3 ust. 1 i 2; dla każdego wyrobu danego wytwórcy wypełnia się jeden formularz.
6. Do zgłoszenia zmiany danych, o których mowa w art. 61 ust. 1a ustawy, podmiot dołącza te dokumenty dotyczące wyrobu, o których mowa w art. 59 ust. 2 i 4 ustawy, których treść uległa zmianie.
§ 6. [Zgłoszenie w formie pisemnej faktu zaprzestania prowadzenia działalności]
1) datę zaprzestania;
2) nazwę i adres wytwórcy wyrobu;
3) nazwę handlową wyrobu;
4) datę sporządzenia dokumentu i podpis osoby odpowiedzialnej.
2. Podmiot zgłasza w formie pisemnej fakt zaprzestania pełnienia funkcji autoryzowanego przedstawiciela, podając:
1) datę zaprzestania;
2) nazwę i adres autoryzowanego przedstawiciela;
3) nazwę i adres wytwórcy wyrobu, którego reprezentował jako autoryzowany przedstawiciel;
4) nazwę handlową wyrobu;
5) datę sporządzenia dokumentu i podpis osoby odpowiedzialnej.
3. Podmioty, o których mowa w art. 58 ustawy, zgłaszają w formie pisemnej fakt zaprzestania prowadzenia działalności, która na podstawie ustawy podlega zgłoszeniu lub powiadomieniu, podając:
1) datę zaprzestania;
2) nazwę i adres podmiotu;
3) datę sporządzenia dokumentu i podpis osoby odpowiedzialnej.
§ 7. [Forma zgłoszeń i powiadomień]
2. Papierową wersję zgłoszenia, powiadomienia lub zgłoszenia zmiany danych sporządza się, wypełniając interaktywne formularze pobrane ze strony internetowej Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych i dokonując ich wydruku. Dokument elektroniczny sporządza się, zapisując dane z wypełnionych formularzy bezpośrednio po ich wydrukowaniu.
3. Dokumentację towarzyszącą zgłoszeniu lub powiadomieniu składa się w wersji papierowej lub w postaci dokumentu elektronicznego, która może obejmować wzory:
1) oznakowania wyrobu;
2) instrukcji używania;
3) materiałów promocyjnych.
4. Dokument elektroniczny zgłoszenia, powiadomienia lub zgłoszenia zmiany danych oraz dokumentacji towarzyszącej przekazuje się w postaci odrębnych plików zapisanych na nośniku optycznym (CD lub DVD) do jednorazowego zapisu.
§ 8. [Wejście w życie]
Minister Zdrowia: K. Radziwiłł
1) Minister Zdrowia kieruje działem administracji rządowej - zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 17 listopada 2015 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. poz. 1908).
2) Niniejsze rozporządzenie służy wykonaniu decyzji Komisji (UE) nr 2010/227/UE z dnia 19 kwietnia 2010 r. w sprawie europejskiej bazy danych o wyrobach medycznych (Eudamed) (Dz. Urz. UE L 102 z 23.04.2010, str. 45).
3) Niniejsze rozporządzenie było poprzedzone rozporządzeniem Ministra Zdrowia z dnia 18 października 2010 r. w sprawie sposobu dokonywania zgłoszeń i powiadomień dotyczących wyrobów (Dz. U. z 2016 r. poz. 59), które traci moc z dniem 20 lutego 2016 r. w związku z wejściem w życie ustawy z dnia 11 września 2015 r. o zmianie ustawy o wyrobach medycznych oraz niektórych innych ustaw (Dz. U. poz. 1918).
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 17 lutego 2016 r. (poz. 210)
Załącznik nr 1
WZÓR – FORMULARZ DLA PODMIOTÓW

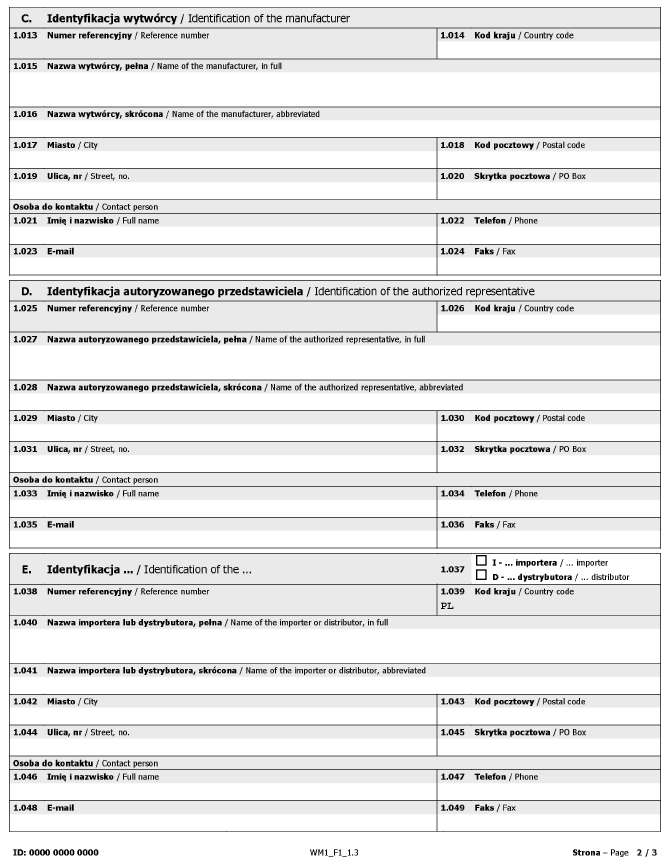
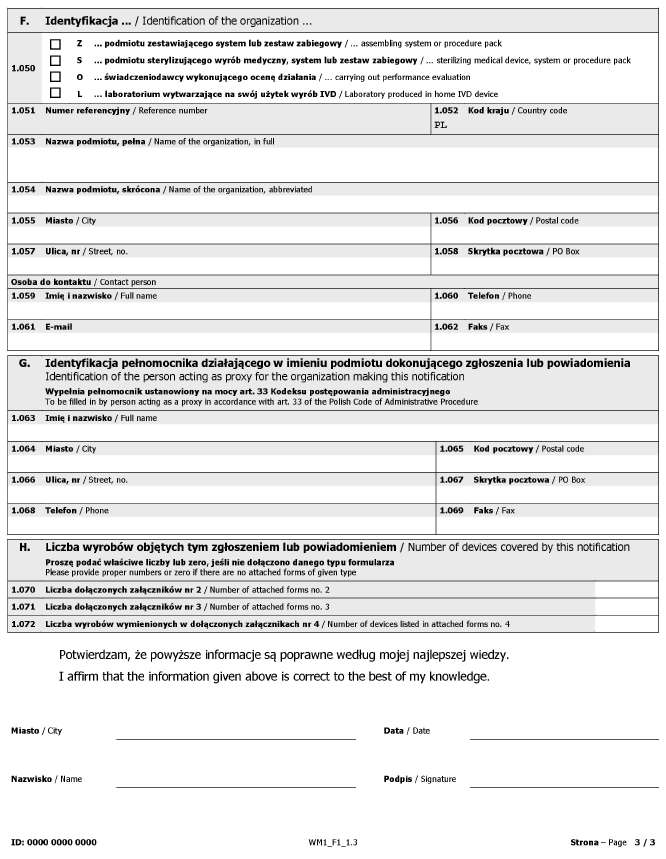
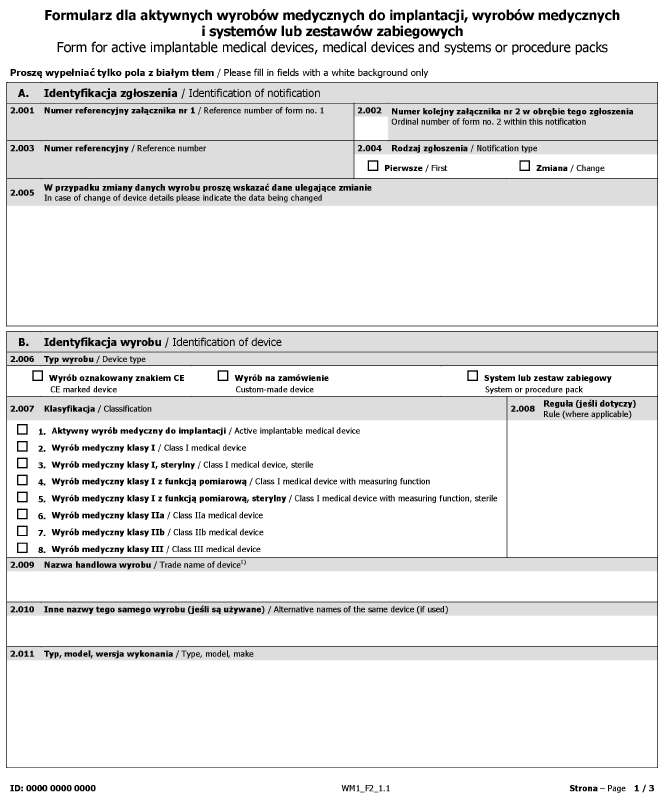
Załącznik nr 2
WZÓR – FORMULARZ DLA AKTYWNYCH WYROBÓW MEDYCZNYCH DO IMPLANTACJI, WYROBÓW MEDYCZNYCH I SYSTEMÓW LUB ZESTAWÓW ZABIEGOWYCH


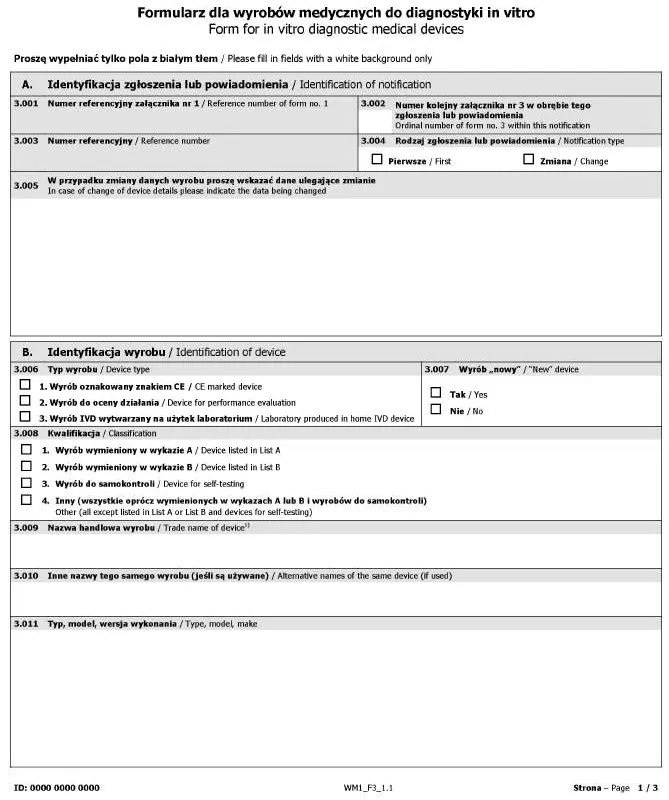
Załącznik nr 3
WZÓR – FORMULARZ DLA WYROBÓW MEDYCZNYCH DO DIAGNOSTYKI IN VITRO


Załącznik nr 4
WZÓR – WYKAZ WYROBÓW OBJĘTYCH POWIADOMIENIEM

- Data ogłoszenia: 2016-02-19
- Data wejścia w życie: 2016-02-20
- Data obowiązywania: 2020-12-12
- Dokument traci ważność: 2022-05-26
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
