REKLAMA
Dziennik Ustaw - rok 2004 nr 251 poz. 2515
ROZPORZĄDZENIE MINISTRA ZDROWIA1)
z dnia 3 listopada 2004 r.
w sprawie wymagań zasadniczych dla wyrobów medycznych do diagnostyki in vitro2)
Na podstawie art. 20 ustawy z dnia 20 kwietnia 2004 r. o wyrobach medycznych (Dz. U. Nr 93, poz. 896) zarządza się, co następuje:
1) wymagania zasadnicze dla wyrobów medycznych do diagnostyki in vitro;
2) wykaz A i wykaz B wyrobów medycznych do diagnostyki in vitro;
3) procedury oceny zgodności dla wyrobów medycznych do diagnostyki in vitro;
4) wykaz procedur zgodności, które mogą być prowadzone przez autoryzowanego przedstawiciela dla wyrobów medycznych do diagnostyki in vitro.
2. Wytwórca wyrobów medycznych do diagnostyki in vitro do samodzielnego stosowania, innych niż wyroby z wykazu A i z wykazu B oraz innych niż przeznaczone do oceny działania, przed sporządzeniem deklaracji zgodności WE, o której mowa w ust. 1, przeprowadza ocenę zgodności, uwzględniając wymagania określone w ust. 1–6 załącznika nr 3 do rozporządzenia.
3. W przypadku, o którym mowa w ust. 2, wytwórca w celu oznakowania wyrobów znakiem CE może także przeprowadzić ocenę zgodności z zastosowaniem procedury, o której mowa w § 5 albo w § 6.
1) deklaracji zgodności WE – pełny system zapewnienia jakości, określonej w załączniku nr 4 do rozporządzenia, lub
2) badania typu WE, określonego w załączniku nr 5 do rozporządzenia, w połączeniu z procedurą dotyczącą deklaracji zgodności WE – zapewnienie jakości produkcji, określoną w załączniku nr 7 do rozporządzenia.
1) deklaracji zgodności WE – pełny system zapewnienia jakości, określonej w załączniku nr 4 do rozporządzenia, lub
2) badania typu WE, określonego w załączniku nr 5 do rozporządzenia, w połączeniu z procedurą dotyczącą:
a) weryfikacji WE, określoną w załączniku nr 6 do rozporządzenia, lub
b) deklaracji zgodności WE – zapewnienie jakości produkcji, określoną w załączniku nr 7 do rozporządzenia.
1) nazwę i adres wytwórcy lub jego autoryzowanego przedstawiciela, jeżeli dotyczy;
2) dane identyfikujące wyrób;
3) oświadczenie o zgodności wyrobu z odpowiednimi wymaganiami rozporządzenia;
4) powołanie zastosowanych norm zharmonizowanych lub specyfikacji;
5) numer identyfikacyjny jednostki notyfikowanej, która brała udział w ocenie zgodności, jeżeli dotyczy;
6) imię, nazwisko, stanowisko i podpis osoby upoważnionej przez wytwórcę do wystawiania deklaracji;
7) miejsce i datę wydania.
Minister Zdrowia: M. Balicki
|
|
1) Minister Zdrowia kieruje działem administracji rządowej – zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 11 czerwca 2004 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U Nr 134, poz. 1439).
2) Niniejsze rozporządzenie wdraża postanowienia Dyrektywy Parlamentu Europejskiego i Rady 98/79/WE z dnia 27 października 1998 r. w sprawie wyrobów medycznych używanych do diagnozy in vitro (Dz. Urz. WE L 331 z 7.12.1998).
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 3 listopada 2004 r. (poz. 2515)
Załącznik nr 1
WYMAGANIA ZASADNICZE DLA WYROBÓW MEDYCZNYCH DO DIAGNOSTYKI IN VITRO






Załącznik nr 2
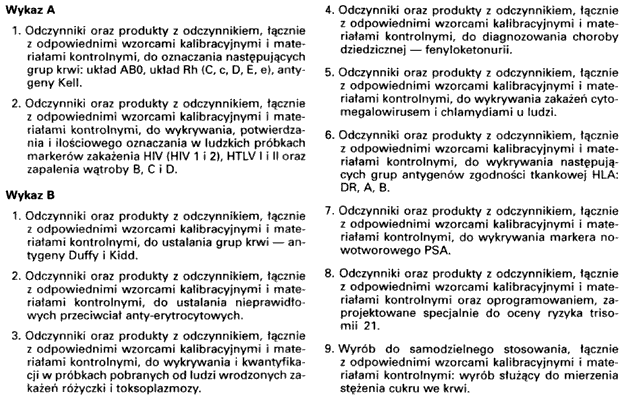
WYKAZ A I WYKAZ B
WYROBÓW MEDYCZNYCH DO DIAGNOSTYKI IN VITRO
Załącznik nr 3
DEKLARACJA ZGODNOŚCI WE


Załącznik nr 4
DEKLARACJA ZGODNOŚCI WE
(Pełny system zapewnienia jakości)



Załącznik nr 5
BADANIE TYPU WE

Załącznik nr 6
WERYFIKACJE WE

Załącznik nr 7
DEKLARACJA ZGODNOŚCI WE
(Zapewnienie jakości produkcji)

Załącznik nr 8
OŚWIADCZENIE I PROCEDURY DOTYCZĄCE WYROBÓW MEDYCZNYCH DO DIAGNOSTYKI IN VITRO DO OCENY DZIAŁANIA

- Data ogłoszenia: 2004-11-25
- Data wejścia w życie: 2004-12-03
- Data obowiązywania: 2005-10-28
- Dokument traci ważność: 2010-09-18
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
