REKLAMA
Dziennik Ustaw - rok 2003 nr 21 poz. 184
ROZPORZĄDZENIE MINISTRA ZDROWIA1)
z dnia 20 grudnia 2002 r.
w sprawie wzorów dokumentów dotyczących badań klinicznych wyrobów medycznych
Na podstawie art. 24 ust. 3a ustawy z dnia 27 lipca 2001 r. o wyrobach medycznych (Dz. U. Nr 126, poz. 1380 oraz z 2002 r. Nr 152, poz. 1264) zarządza się, co następuje:
1) wzór wniosku wytwórcy o pozwolenie na rozpoczęcie badań klinicznych wyrobu medycznego;
2) wzór oświadczenia wytwórcy o zgodności wyrobu medycznego przeznaczonego do badań klinicznych z wymaganiami w zakresie bezpieczeństwa wyrobu medycznego;
3) wzór sprawozdania końcowego z wykonania badań klinicznych wyrobu medycznego.
2. Wzór oświadczenia wytwórcy o zgodności wyrobu medycznego przeznaczonego do badań klinicznych z wymaganiami w zakresie bezpieczeństwa wyrobu medycznego określa załącznik nr 2 do rozporządzenia.
3. Wzór sprawozdania końcowego z wykonania badań klinicznych wyrobu medycznego określa załącznik nr 3 do rozporządzenia.
Minister Zdrowia: M. Łapiński
|
|
1) Minister Zdrowia kieruje działem administracji rządowej – zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 28 czerwca 2002 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. Nr 93, poz. 833).
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 20 grudnia 2002 r. (poz. 184)
Załącznik nr 1


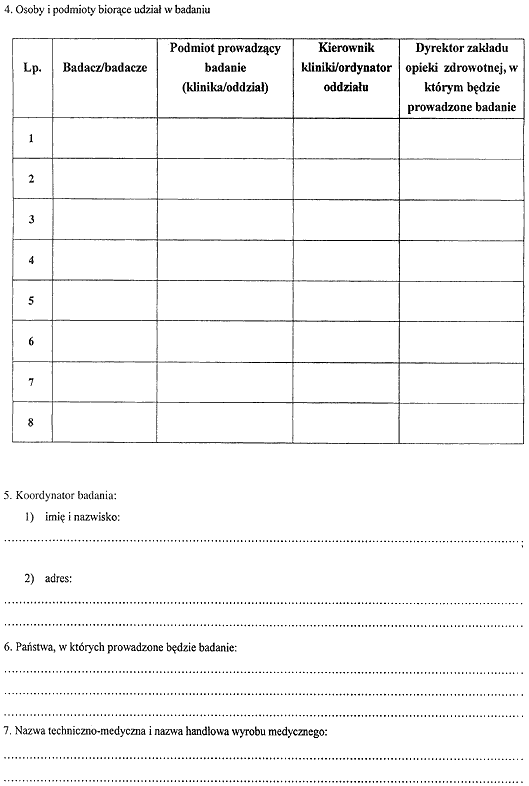


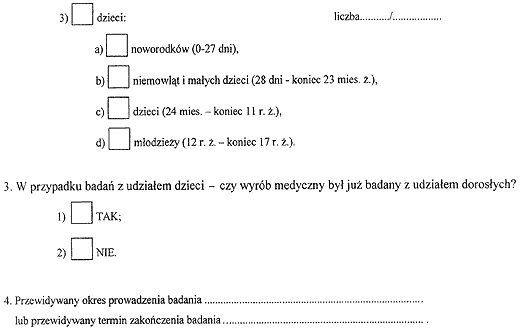






Załącznik nr 2



Załącznik nr 3




- Data ogłoszenia: 2003-02-10
- Data wejścia w życie: 2003-02-25
- Data obowiązywania: 2003-02-25
- Dokument traci ważność: 2004-05-01
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
