REKLAMA
Monitor Polski - rok 2020 poz. 73
OBWIESZCZENIE
MINISTRA ZDROWIA1)
z dnia 4 grudnia 2019 r.
w sprawie sposobu i kryteriów stwierdzenia trwałego nieodwracalnego ustania czynności mózgu
Na podstawie art. 43a ust. 3 pkt 1 ustawy z dnia 5 grudnia 1996 r. o zawodach lekarza i lekarza dentysty (Dz. U. z 2019 r. poz. 537, 577, 730 i 1590) ogłasza się sposób i kryteria stwierdzenia trwałego nieodwracalnego ustania czynności mózgu, ustalone przez specjalistów z dziedzin medycyny: anestezjologii i intensywnej terapii, intensywnej terapii, audiologii i foniatrii, pediatrii, toksykologii klinicznej, medycyny nuklearnej, medycyny sądowej, neurochirurgii, neurologii, neurologii dziecięcej, otorynolaryngologii, radiologii i diagnostyki obrazowej, reumatologii, chorób wewnętrznych, neonatologii oraz dziedzin: inżynierii biomedycznej, biologii medycznej, stanowiące załącznik do obwieszczenia2).
Minister Zdrowia: wz. J. Szczurek-Żelazko
|
|
1) Minister Zdrowia kieruje działem administracji rządowej - zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 18 listopada 2019 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. poz. 2269).
2) Niniejsze obwieszczenie było poprzedzone obwieszczeniem Ministra Zdrowia z dnia 17 lipca 2007 r. w sprawie kryteriów i sposobu stwierdzenia trwałego nieodwracalnego ustania czynności mózgu (M.P. poz. 547).
Załącznik do obwieszczenia Ministra Zdrowia
z dnia 4 grudnia 2019 r. (poz. 73)
SPOSÓB I KRYTERIA STWIERDZENIA TRWAŁEGO NIEODWRACALNEGO USTANIA CZYNNOŚCI MÓZGU
I. ZAŁOŻENIA OGÓLNE
II. ROZPOZNANIE ŚMIERCI MÓZGU
Etapy postępowania diagnostycznego
Wytyczne organizacyjne
Wytyczne techniczne i kwalifikacyjne
Uwagi do sposobu przeprowadzania postępowania diagnostycznego
Uwaga 1 - potwierdzenie ciężkiego uszkodzenia mózgu
Uwaga 2 - określenie czasu trwania obserwacji wstępnej
Uwaga 3 - objawy, które nie wykluczają rozpoznania śmierci mózgu
Uwaga 4 - próba bezdechu, informacje dodatkowe
Uwaga 5 - odrębności w rozpoznawaniu śmierci mózgu u dzieci
Uwaga 6 - instrumentalne badania potwierdzające
Wprowadzenie
Badania elektrofizjologiczne
Badanie EEG
Multimodalne potencjały wywołane
Słuchowe potencjały wywołane pnia mózgu
Somatosensoryczne potencjały wywołane
Badanie przepływu mózgowego
Przezczaszkowa ultrasonografia dopplerowska
Scyntygrafia perfuzyjna
Angiografia mózgowa
Angiografia i perfuzja metodą tomografii komputerowej
Uwaga 7 - Wykluczenie wpływu leków na odruchy pniowe
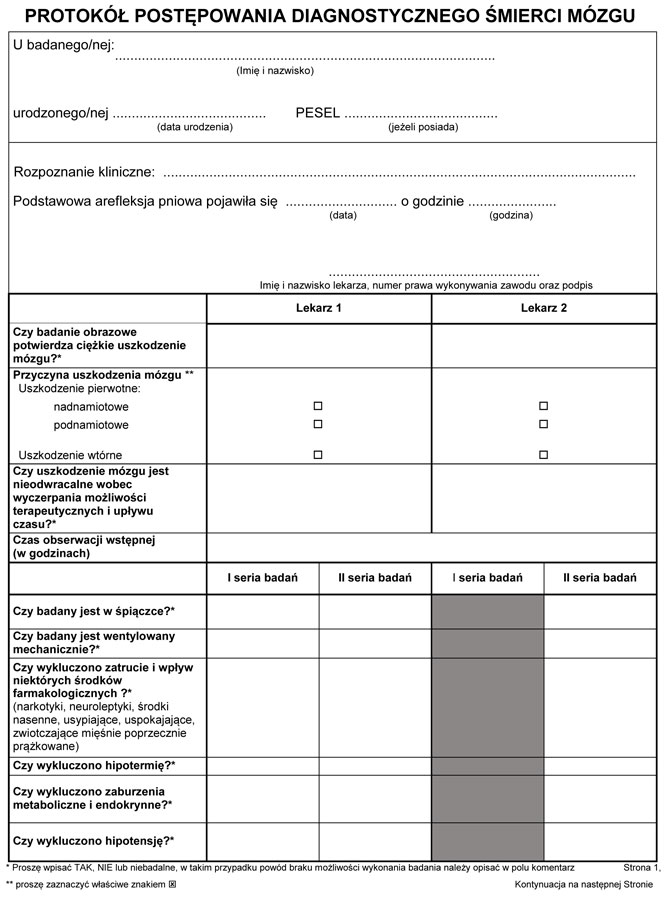
PROTOKÓŁ POSTĘPOWANIA DIAGNOSTYCZNEGO ŚMIERCI MÓZGI
załączony formularz
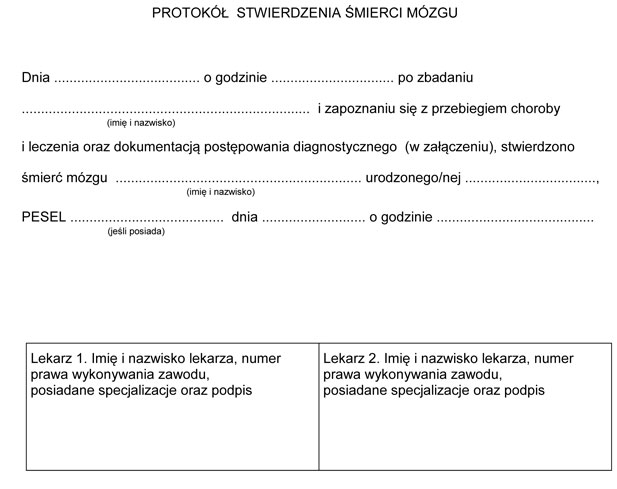
PROTOKÓŁ STWIERDZENIA ŚMIERCI MÓZGU - załączony formularz
I. ZAŁOŻENIA OGÓLNE
Kryteria śmierci człowieka wraz z postępem wiedzy medycznej ulegają ewolucji i co pewien czas są nowelizowane drogą uzgodnień prowadzących do jednomyślności przez naukowe środowiska medyczne. Ewolucja kryteriów śmierci człowieka każdorazowo jednak potwierdza, że dotychczasowe orzecznictwo w tym zakresie było i jest pewne i potwierdza biologiczny fakt śmierci.
Na międzynarodowym spotkaniu ekspertów, które odbyło się w Montrealu w 2012 r., opracowano uniwersalną definicję śmierci w brzmieniu: "Śmierć jest to trwała utrata przytomności oraz trwała utrata wszystkich funkcji pnia mózgu. Może być spowodowana trwałym ustaniem krążenia lub krytycznym uszkodzeniem mózgu. W kontekście stwierdzania śmierci określenie "trwałe" oznacza utratę funkcji, która nie może powrócić spontanicznie i nie będzie przywrócona na drodze interwencji.".
Zgodnie z tą definicją, krytyczne uszkodzenie mózgu prowadzi do rozpoznania śmierci w oparciu o kryteria neurologiczne, tradycyjnie określanej jako śmierć mózgu. W Montrealu zaproponowano całościowe podejście do zagadnienia śmierci, definiując ją jako nieodwracalne uszkodzenie mózgu, podkreślając jednocześnie, że może do niego dojść wskutek patologicznych procesów ogólnoustrojowych, wśród których dominuje zatrzymanie systemowego krążenia krwi, lub z powodu zmian chorobowych pierwotnie zlokalizowanych w jamie czaszki, prowadzących do krytycznego wzrostu ciśnienia w jej obrębie i przez to do zahamowania mózgowego przepływu krwi. Według tej definicji, kryteria neurologiczne znajdują zastosowanie w diagnostyce śmierci mózgu, a co za tym idzie śmierci człowieka jako całości niezależnie od mechanizmu, który do niej doprowadził.
W większości przypadków obrzęk mózgu wynikający z jego uszkodzenia narasta od strony przestrzeni nadnamiotowej, a pień mózgu umiera jako ostatnia jego część. Trwałe uszkodzenie pnia mózgu ustala się na podstawie braku określonych odruchów nerwowych i braku spontanicznej czynności oddechowej. Postępowanie takie, oparte przede wszystkim na badaniach klinicznych, w przeważającej liczbie przypadków jest możliwe, a jego wynik jest pewny. W szczególnych okolicznościach (np. w urazach twarzoczaszki) badanie odruchów pniowych nie jest jednak możliwe do przeprowadzenia, a w innych (np. zatrucia, farmakoterapia) ich interpretacja jest trudna. Co więcej, w pierwotnie podnamiotowych uszkodzeniach mózgu śmierć mózgu wymaga szczególnego postępowania diagnostycznego, bowiem kliniczne objawy trwałego uszkodzenia pnia mózgu nie oznaczają w tym przypadku jednoczesnego nieodwracalnego uszkodzenia całego mózgu. W takich przypadkach podejrzenie śmierci mózgu musi być potwierdzone badaniami instrumentalnymi.
Poszerzanie wiedzy i doświadczenia lekarskiego, wdrażanie nowych metod i technologii medycznych w diagnostyce śmierci człowieka jest procesem ciągłym. Pozwala na wprowadzanie do praktyki lekarskiej coraz lepszych, pewniejszych sposobów postępowania diagnostycznego i terapeutycznego. Włączenie do procedur stwierdzania śmierci mózgu metod instrumentalnych to cenne uzupełnienie badań klinicznych, a w niektórych przypadkach również postępowanie rozstrzygające o życiu lub śmierci. Ponadto, metody instrumentalne jako uzupełnienie badań klinicznych pozwalają na ustalenie śmierci mózgu w czasie zbliżonym do biologicznego zaistnienia tego faktu.
Wieloletnia praktyka medyczna jednoznacznie wykazała, że w wybranych przypadkach odstąpienie od sposobu stwierdzania śmierci człowieka na podstawie rozpoznania nieodwracalnego zatrzymania krążenia na rzecz stwierdzania śmierci na podstawie rozpoznania śmierci mózgu jest uzasadnione z naukowego i praktycznego punktu widzenia. W świetle postępu medycyny i dynamicznego rozwoju intensywnej terapii takie stanowisko okazuje się być potrzebne i słuszne. Pomimo ogromnych możliwości ratowania ludzkiego zdrowia i życia, jakie aktualnie posiada nowoczesna medycyna, istnieją granice ich stosowania. Jedną z nich jest śmierć mózgu, czyli śmierć człowieka.
W przypadkach ciężkiego uszkodzenia mózgu, w których nie są spełnione wszystkie kryteria śmierci mózgu, a jednocześnie na podstawie aktualnego doświadczenia i wiedzy medycznej stwierdza się, że dalsze leczenie ma cechy terapii daremnej, należy rozważyć jego ograniczenie zgodnie z aktualnie obowiązującymi zasadami.
II. ROZPOZNANIE ŚMIERCI MÓZGU
Etapy postępowania diagnostycznego
Rozpoznanie śmierci mózgu opiera się na stwierdzeniu nieodwracalnej utraty jego funkcji. Postępowanie kwalifikacyjne jest dwuetapowe:
1) etap I: stwierdzenie podstawowej arefleksji pniowej, określenie przyczyny, która doprowadziła do katastrofalnego (skrajnie ciężkiego) uszkodzenia mózgu, i przeprowadzenie obserwacji wstępnej;
2) etap II: dwukrotna analiza stwierdzeń i wykluczeń, dwukrotne wykonanie badań potwierdzających arefleksję pniową oraz trwały bezdech, a w uzasadnionych przypadkach wykonanie dodatkowego badania instrumentalnego.
Etap I
1. Stwierdzenie podstawowej arefleksji pniowej określonej jako zanik odruchów kaszlowego i wymiotnego oraz rozszerzenie i brak reakcji źrenic na światło.
2. Analiza dotychczasowego przebiegu leczenia i wykonanie badania obrazowego potwierdzającego ciężkie uszkodzenie mózgu (Uwaga 1).
3. Ustalenie, czy uszkodzenie mózgu jest spowodowane:
1) przyczyną nadnamiotową czy podnamiotową;
2) przyczyną pierwotną czy wtórną.
4. Ustalenie, czy uszkodzenie jest nieodwracalne i czy brak jest możliwości skutecznej interwencji terapeutycznej.
5. Przeprowadzenie obserwacji wstępnej (Uwaga 2).
Etap II
1. Stwierdzenia:
1) pacjent jest w śpiączce;
2) pacjent jest sztucznie wentylowany.
2. Wykluczenia:
1) hipotermia;
2) zatrucie i wpływ niektórych środków farmakologicznych (narkotyki, neuroleptyki, leki uspokajające, nasenne i zwiotczające mięśnie poprzecznie prążkowane);
3) zaburzenia metaboliczne i endokrynne;
4) hipotensja.
3. Arefleksja pniowa:
1) brak reakcji źrenic na światło;
2) brak odruchu rogówkowego;
3) brak ruchów gałek ocznych spontanicznych;
4) brak ruchów gałek ocznych przy próbie kalorycznej;
5) brak jakichkolwiek reakcji ruchowych na bodziec bólowy zastosowany w zakresie unerwienia nerwów czaszkowych, jak również brak reakcji ruchowej w obrębie twarzy w odpowiedzi na bodźce bólowe zastosowane w obszarze unerwienia rdzeniowego;
6) brak odruchów wymiotnych i kaszlowych;
7) brak odruchu oczno-mózgowego.
4. Trwały bezdech.
Dopuszcza się niespełnienie wymogu zawartego w ust. 2 pkt 2 i/lub ust. 2 pkt 3. W takich przypadkach procedura rozpoznawania śmierci mózgu powinna być uzupełniona o badanie przepływu mózgowego krwi (patrz: Uwaga 6).
Wytyczne organizacyjne:
1) informacje o czasie wystąpienia podstawowej arefleksji pniowej należy zamieścić w dokumentacji medycznej;
2) w procesie diagnostyki śmierci mózgu czas obserwacji wstępnej jest liczony od chwili pojawienia się podstawowej arefleksji pniowej do chwili rozpoczęcia wykonywania pierwszej serii badań;
3) w przypadku zastosowania hipotermii terapeutycznej, znieczulenia w hipotermii lub przypadkowego wychłodzenia poniżej 32°C liczenie czasu obserwacji wstępnej może się rozpocząć nie wcześniej niż 24 godziny od uzyskania temperatury głębokiej ≥ 35°C;
4) czas obserwacji wstępnej u dorosłych powinien wynosić co najmniej:
a) w uszkodzeniach pierwotnych - 6 godzin,
b) w uszkodzeniach wtórnych, spowodowanych między innymi takimi czynnikami jak niedotlenienie, zatrzymanie krążenia, hipoglikemia i inne - 12 godzin,
c) w przypadku wykonania w czasie procesu leczenia i monitorowania chorego badania instrumentalnego potwierdzającego zatrzymanie krążenia mózgowego czas wykonania badania może być uznany za czas zakończenia obserwacji wstępnej. W takich przypadkach można od razu przystąpić do przeprowadzenia pierwszej serii badań;
5) dwie serie analiz stwierdzeń i wykluczeń oraz dwie serie badań klinicznych u dorosłych powinny być wykonywane po upływie okresu obserwacji wstępnej w odstępach czasowych wynoszących co najmniej:
a) w uszkodzeniach pierwotnych - 6 godzin,
b) w uszkodzeniach wtórnych - 24 godziny,
c) w przypadku wykonania instrumentalnego badania potwierdzającego czas ten może być skrócony do trzech godzin;
6) lekarz 11) powinien wykonać obydwie serie badań, lekarz 22) uczestniczy w drugiej serii badań;
7) próba bezdechu powinna być wykonana dwukrotnie, na zakończenie każdej z serii badań;
8) rozpoznawanie śmierci mózgu u dzieci powinno odbywać się zgodnie z zasadami przedstawionymi w Uwadze 5;
9) w szczególnych przypadkach określonych w Uwadze 6 w uzupełnieniu postępowania diagnostycznego powinny być wykonane instrumentalne badania potwierdzające;
10) po przeanalizowaniu dokumentacji medycznej, wykonaniu dwóch serii badań klinicznych według załączonego protokołu oraz, w razie potrzeby, instrumentalnych badań potwierdzających stwierdzana jest śmierć mózgu. Po stwierdzeniu śmierci mózgu lekarz 1 i lekarz 2 wypełniają i podpisują protokół stwierdzenia śmierci mózgu.
Wytyczne techniczne i kwalifikacyjne:
1) ustalenie przyczyny i rodzaju uszkodzenia mózgu odbywa się na podstawie wywiadu i wyników badań.
Może ono być:
a) nadnamiotowe lub podnamiotowe, w zależności od obszaru, w którym rozpoczął się proces uszkadzający,
b) pierwotne, jeżeli czynnik sprawczy doprowadził do bezpośredniego uszkodzenia mózgu, np. uraz lub katastrofa naczyniowa w postaci krwawienia wewnątrzczaszkowego lub masywnego udaru niedokrwiennego,
c) wtórne, jeżeli uszkodzenie mózgu dokonało się pośrednio, np. w wyniku niedotlenienia lub hipoglikemii,
d) mieszane, w których na uszkodzenie pierwotne nakłada się dodatkowe uszkodzenie wtórne (np. zatrzymanie krążenia),
e) w przypadkach uszkodzeń mieszanych diagnostyka powinna odbywać się tak jak dla uszkodzeń wtórnych,
f) w przypadkach uszkodzeń wtórnych diagnostyka powinna odbywać się tak jak dla uszkodzeń nadnamiotowych;
2) wykluczenie hipotermii - temperatura głęboka powinna wynosić ≥ 35°;
3) wykluczenie zatrucia i wpływu niektórych depresyjnych środków farmakologicznych powinno odbywać się zgodnie z odrębnymi wytycznymi przedstawionymi w Uwadze 7;
4) wykluczenie zaburzeń metabolicznych i ze strony układu endokrynnego - parametry laboratoryjne powinny zostać skorygowane w przypadku stwierdzenia:
a) hiponatremii - Na+< 110 mEq/l oraz hipernatremii Na+ > 160 mEq/l,
b) hipokaliemii K+ < 2,5 mEq/L,
c) hipoglikemii - poziom glukozy < 70 mg/dL, hiperglikemii - poziom glukozy > 300 mg/dL,
d) kwasicy - pH < 7,2;
5) wykluczenie hipotensji - średnie ciśnienie tętnicze badanego powinno wynosić ≥ 70 mmHg, a w czasie wykonywania badań przepływu mózgowego krwi powinno wynosić ≥ 80 mmHg. U dzieci średnie ciśnienie tętnicze powinno mieć wartość zgodną z normą dla wieku;
6) badanie odruchów pniowych:
a) badanie reakcji źrenic na światło:
- u chorego z podejrzeniem śmierci mózgu źrenice powinny być rozszerzone, niereagujące na światło,
- przed próbą należy przez około 30 sekund utrzymywać u chorego zamknięte powieki, następnie odsłonić równocześnie obie źrenice, oświetlając je światłem z silnego źródła, i obserwować średnicę źrenic przez około 5 sekund, w przypadku wątpliwości można użyć szkła powiększającego,
- badanie należy przeprowadzić 3-krotnie w odstępach około 30-sekundowych,
b) badanie odruchu rogówkowego:
- unieść powiekę i odsłonić gałkę oczną,
- dotknąć rogówki 3-krotnie w około 5-sekundowych odstępach jałowym gazikiem,
- badania wykonać obustronnie,
- obserwować zachowanie się powiek podczas próby,
c) próba kaloryczna:
- przed wykonaniem próby sprawdzić wziernikiem pełną drożność przewodów słuchowych zewnętrznych (brak woskowiny skrzepów i innych ciał obcych), a w razie potrzeby oczyścić je,
- skierować strumień z 20 ml zimnej wody (temp. 3-10°C) na błonę bębenkową,
- obserwować zachowanie się gałek ocznych;
7) sprawdzanie reakcji bólowych w obszarze unerwienia pniowego i rdzeniowego:
a) w zakresie nerwów czaszkowych: ucisk opuszką palca na okolicę anatomicznych miejsc wyjścia nerwów czaszkowych z jamy czaszki: nadoczodołowego i podoczodołowego (obustronnie),
b) w zakresie nerwów obwodowych: ucisk płytki paznokciowej w okolicy wzrostowej krawędzią paznokcia (obustronnie),
c) obserwacja zachowania się mięśni mimicznych twarzy i innych grup mięśniowych,
d) różnicowanie reakcji pniowych i rdzeniowych (Uwaga 3);
8) sprawdzanie odruchów wymiotnych i kaszlowych:
a) wprowadzić zgłębnik do gardła i początkowego odcinka przełyku oraz sprawdzić, czy ruchy osiowe zgłębnikiem nie wywołują odruchu wymiotnego,
b) wprowadzić zgłębnik do tchawicy oraz oskrzeli i obserwować, czy osiowe poruszanie nim nie wywołuje odruchu kaszlowego (zgłębnik nie może być podłączony do urządzenia ssącego),
c) obserwować zachowanie się mięśni mimicznych twarzy, mięśni klatki piersiowej i brzucha;
9) badanie odruchu oczno-mózgowego:
a) stanąć za głową badanego i ująć ją obiema rękami z boków,
b) odsłonić gałki oczne, odsuwając kciukami powieki ku górze,
c) obrócić głowę badanego najpierw w jedną stronę i zatrzymać 3-5 sekund w tej pozycji,
d) obrócić głowę badanego w przeciwną stronę i zatrzymać ją przez 3-5 sekund w tej pozycji,
e) obserwować zachowanie się gałek ocznych;
10) badanie trwałego bezdechu (dodatkowe wyjaśnienia w Uwadze 4);
11) próba bezdechu u pacjentów poddanych wentylacji mechanicznej:
a) po ustabilizowaniu wartości prężności CO2 (PaCO2) we krwi tętniczej w przedziale 35-45 mmHg należy przeprowadzić 10-minutową wentylację płuc badanego z FiO2 = 1,0 pobrać krew tętniczą do badania gazometrycznego i po stwierdzeniu oczekiwanego zakresu PaCO2 rozpocząć próbę bezdechu w jednym z następujących wariantów:
- zastosowanie ciągłego dodatniego ciśnienia w drogach oddechowych (CPAP) z FiO2 = 1,0 przy pomocy respiratora lub z zastosowaniem worka rezerwuarowego z zastawką CPAP. Wartość CPAP należy ustalić w zakresie 5-10 cm H2O, lub wyższym, jeżeli prowadzono wentylację z wysokimi wartościami PEEP. W takich przypadkach wartość CPAP nie powinna przekraczać wartości PEEP stosowanej podczas leczenia wentylacyjnego,
- hipowentylacja z FiO2 = 1,0, z ustaleniem parametrów minimalnej wentylacji minutowej dopuszczanej przez oprogramowanie respiratora bez włączenia tzw. wentylacji bezdechu. Takie ustawienie ma na celu uniknięcie automatycznego włączenia tej funkcji w trybie alarmowym przez respiratory, które posiadają taką funkcję fabrycznie zaprogramowaną, bez możliwości jej wyłączenia. W innych przypadkach wentylację bezdechu należy wyłączyć,
- odłączenie badanego od respiratora i rozpoczęcie równocześnie insuflacji O2 przez założony do rurki intubacyjnej zgłębnik o średnicy < 70% średnicy rurki intubacyjnej, z wylotem powyżej jej zakończenia, z przepływem 6 l/min, a u dzieci odpowiednio mniej, metoda insuflacyjna nie jest rekomendowana u pacjentów ze wskaźnikiem tlenowym PaO2/FiO2 < 200 mmHg ze względu na niebezpieczeństwo spowodowania niedotlenienia, wiąże się także z ryzykiem objętościowego uszkodzenia płuc w przypadku zastosowania cewnika insuflacyjnego o zbyt dużej średnicy,
b) próbki krwi tętniczej na badanie gazometryczne należy pobierać po pierwszych 5 minutach, a następnie w odstępach czasu zależnych od szybkości narastania PaCO2 do chwili uzyskania wartości PaCO2 co najmniej 60 mmHg i przyrostu o co najmniej 20 mmHg,
c) od chwili rozpoczęcia próby bezdechu należy obserwować klatkę piersiową i nadbrzusze, a także wskazania respiratora lub ruchomość worka rezerwuarowego O2, jeżeli badany był do nich podłączony,
d) stwierdzenie braku ruchów oddechowych (poza oddechami wymuszonymi z respiratora w trybie hipowentylacji minimalnej dopuszczalnej) pomimo osiągnięcia wartości PaCO2 co najmniej 60 mmHg i przyrostu o co najmniej 20 mmHg jest potwierdzeniem trwałego bezdechu,
e) po zakończeniu badania, przed powrotem do wentylacji wyjściowej wykonać manewr rekrutacji pęcherzyków płucnych,
f) w przypadku spadku SpO2 poniżej 90% przez okres > 30s, wystąpienia spadku skurczowego ciśnienia tętniczego u dorosłych poniżej 90 mmHg, a u dzieci poniżej wartości prawidłowej dla wieku, lub zaburzeń rytmu serca należy pobrać próbkę krwi tętniczej w celu określenia PaCO2 i następnie badanego podłączyć do respiratora, po sprawdzeniu wyników badania gazometrycznego należy ocenić, czy osiągnięta prężność dwutlenku węgla we krwi tętniczej jest wystarczająca do rozpoznania trwałego bezdechu;
12) próba bezdechu u chorych leczonych pozaustrojową oksygenacją membranową (ECMO extracorporeal membranę oxygenation):
a) zasady rozpoznawania bezdechu chorych podłączonych do ECMO nie różnią się w podstawowych założeniach od zasad przyjętych dla chorych wentylowanych tradycyjnie. W pierwszym etapie należy ustabilizować PaCO2 w zakresie 35-45 mmHg przez regulację wielkości przepływu gazów przez oksygenator,
b) w celu właściwego przeprowadzenia próby bezdechu należy wybrać referencyjną tętnicę do pobierania próbek gazometrycznych. Zaleca się równoczesne pobranie próbek z obu tętnic promieniowych i wybór tętnicy, po stronie której PaCO2 ma mniejszą wartość. Postępowanie takie jest konieczne z uwagi na potencjalne różnice w prężności dwutlenku węgla pomiędzy jednoimiennymi tętnicami. Wybór tętnic promieniowych jest podyktowany unaczynieniem ośrodka oddechowego od odgałęzień tętnic podobojczykowych podobnie jak tętnic promieniowych, które same także są odgałęzieniami tętnic podobojczykowych. W przypadku VV-ECMO wybór tętnicy referencyjnej nie jest konieczny,
c) dziesięciominutową preoksygenację należy wykonać przez:
- zastąpienie przez 100% O2 FiO2 =1,0 mieszaniny gazów przepływających przez oksygenator,
- wentylację mechaniczną z FiO2 = 1,0,
- pobranie próbki krwi tętniczej do wyjściowego badania gazometrycznego,
- przerwanie wentylacji mechanicznej i rozpoczęcie typowej próby bezdechu w wariancie:
- - zastosowanie CPAP z użyciem z FiO2 = 1,0,
- - hipowentylacja z FiO2 = 1,0,
- zmniejszenie szybkości przepływu O2 przez oksygenator do jak najmniejszej wartości zapewniającej prawidłową SpO2 > 90%. Dla osób dorosłych wspomniany przepływ gazu zazwyczaj można bezpiecznie zmniejszyć od 0.5 do 1 l/min (VA-ECMO), w niektórych przypadkach VV-ECMO może być możliwe bezpieczne dalsze zmniejszenie przepływu gazów nawet od całkowitego zatrzymania,
- próbki krwi na badanie gazometryczne należy pobierać podobnie jak w typowej próbie bezdechu,
- badanie należy kontynuować do czasu osiągnięcia zalecanych wartości PaCO2,
- należy uważnie obserwować klatkę piersiową i brzuch chorego pod kątem wystąpienia efektywnych ruchów oddechowych,
- w przypadku poważnej desaturacji - SpO2 < 85% lub poważnej niestabilności hemodynamicznej należy pobrać krew tętniczą na badanie gazometryczne i zaraz po tym przerwać próbę. Po sprawdzeniu wyników gazometrii należy ocenić, czy osiągnięta prężność dwutlenku węgla we krwi tętniczej jest wystarczająca do rozpoznania trwałego bezdechu.
Uwagi do sposobu przeprowadzania postępowania diagnostycznego
Uwaga 1 - potwierdzenie ciężkiego uszkodzenia mózgu
Do wykazania zmian w mózgowiu świadczących o jego ciężkim uszkodzeniu, które może być przyczyną śpiączki i śmierci mózgu, wykorzystywane są najczęściej badania tomografii komputerowej (TK) i rzadziej, rezonansu magnetycznego (MR), a u noworodków i niemowląt także badania przezciemiączkowe usg.
Najczęstszymi zmianami stwierdzanymi w pierwotnym uszkodzeniu mózgu są masywne krwawienie (samoistne albo pourazowe) lub niedokrwienie.
Ponadto w badaniach neuroobrazowych typowo obserwuje się cechy uogólnionego obrzęku mózgu. Mogą one występować pod postacią spłaszczenia zakrętów i zaciśnięcia przymózgowych przestrzeni płynowych - bruzd i zbiorników podstawy, zmniejszenia zróżnicowania między istotą szarą a istotą białą lub wgłobienia: migdałków móżdżku w otwór wielki, zakrętu obręczy pod sierp mózgu, pnia mózgu w otwór wielki, zakrętu przyhipokampowego we wcięcie namiotu móżdżku.
W obrazach T2-zależnych MR widoczne jest zwiększenie sygnału obejmujące przede wszystkim istotę szarą. W obrazowaniu dyfuzji wody metodą MR (DWI) w fazie obrzęku cytotoksycznego obserwuje się uogólnioną restrykcję dyfuzji. Kolejnym objawem widocznym w obrazach T2-zależnych jest brak fizjologicznie występującego zjawiska zaniku sygnału w naczyniach mózgowych. Świadczy to o skrajnym upośledzeniu albo zatrzymaniu krążenia mózgowego.
W uszkodzeniach wtórnych w mechanizmie niedotlenieniowo-niedokrwiennym spowodowanym zatrzymaniem krążenia, albo zapalnym, zmiany są zazwyczaj słabiej wyrażone i pojawiają się później niż w uszkodzeniach pierwotnych.
W wątpliwych przypadkach badanie obrazowe należy powtórzyć po pewnym czasie lub w dalszym postępowaniu diagnostycznym zastosować badanie instrumentalne.
Uwaga 2 - określenie czasu trwania obserwacji wstępnej
Potwierdzenie nieodwracalności uszkodzenia mózgu wobec wyczerpania możliwości terapeutycznych i upływu czasu wymaga przeprowadzenia odpowiednio długiej obserwacji wstępnej (zgodnie z pkt 4 w części Wytyczne organizacyjne) przed rozpoczęciem II etapu procedury stwierdzania śmierci mózgu.
Uwaga 3 - objawy, które nie wykluczają rozpoznania śmierci mózgu
U pacjentów z dokonaną śmiercią mózgu jest wykluczona jakakolwiek reakcja ruchowa w obszarze twarzoczaszki, jak również w obszarze unerwienia rdzeniowego na jakiekolwiek bodźce bólowe zastosowane w obszarze unerwienia z pnia mózgu. Wykluczona jest także jakakolwiek reakcja w obszarze twarzoczaszki w odpowiedzi na bodźce zastosowane w obszarze unerwienia rdzeniowego. Powyższe reakcje świadczyłyby o zachowanej funkcji pnia mózgu.
Jednocześnie, u pacjentów z dokonaną śmiercią mózgu zachowana jest perfuzja rdzenia kręgowego i po okresie arefleksji spowodowanej wstrząsem rdzeniowym, podobnie jak w przypadku wysokiego uszkodzenia rdzenia kręgowego, mogą pojawić się odruchy i automatyzmy rdzeniowe. Są one czasami wygórowane z powodu zaniku hamującej funkcji wyższych pięter centralnego układu nerwowego, co może niekiedy spowodować trudności interpretacyjne. U pacjentów z dokonaną śmiercią mózgu najczęściej w piśmiennictwie opisywane były:
1) subtelne, okresowe i rytmiczne ruchy mięśni twarzy - to zjawisko może wynikać z odnerwienia mięśni w obszarze unerwianym przez nerw VII;
2) zgięciowe ruchy palców dłoni;
3) toniczne odruchy szyjne - ruchy szyi, złożone ruchy kończyn inne niż patologiczne zgięcie lub wyprost, zgięcie tułowia, powolny obrót głowy oraz przywodzenie w stawach ramiennych ze zgięciem w stawach łokciowych; takie ruchy zdarzają się czasem podczas próby bezdechu lub po stwierdzeniu śmierci mózgu i odłączeniu respiratora; mogą one przybierać dramatyczną formę (tzw. objaw Łazarza);
4) inne ruchy tułowia, obejmujące asymetryczne ustawienie tułowia z odgięciem głowy do tyłu, zachowane głębokie i powierzchowne odruchy skórne brzuszne;
5) zachowane odruchy ścięgniste, objaw trójzgięcia (w stawie biodrowym, kolanowym i skokowym, np. podczas wywoływania objawu Babińskiego), odruch kolanowy;
6) naprzemienne ruchy zgięciowe i wyprostne palców stóp (objaw falujących palców stóp) lub zgięcie palców stóp po opukiwaniu stopy, dodatni objaw Babińskiego;
7) odruch polegający na nawróceniu i wyproście kończyny górnej;
8) ruchy podobne do oddechowych obserwowane w czasie próby bezdechu (uniesienie i przywiedzenie ramion, wygięcie grzbietu, rozszerzenie przestrzeni międzyżebrowych, skurcz mięśni brzucha) bez wygenerowania znaczącej objętości oddechowej.
Uwaga 4 - próba bezdechu, informacje dodatkowe
Celem próby bezdechu jest sprawdzenie zdolności reakcji ośrodka oddechowego w pniu mózgu na najsilniejszy bodziec oddechowy, jakim jest wzrost PaCO2 we krwi tętniczej. U pacjentów z przewlekłą chorobą płuc, zwartością PaCO2 utrzymującą się powyżej 45 mmHg próba bezdechu może być niewiarygodna ze względu na nieprzewidywalną reaktywność ośrodka oddechowego na wzrost PaCO2. Dlatego też, jeżeli w trakcie próby bezdechu u takich pacjentów zostaną stwierdzone ruchy oddechowe, należy to uznać za dowód zachowanej czynności ośrodka oddechowego. Natomiast w przypadku niestwierdzenia aktywności oddechowej należy dodatkowo wykonać badanie przepływu mózgowego krwi.
Prężność CO2 wzrasta przeciętnie o około 3-6 mmHg/min w ciągu pierwszych 5 minut po zaprzestaniu wentylacji, później wzrost ten ulega spowolnieniu. Dlatego też zaproponowano wykonanie pierwszej kontrolnej gazometrii po 5 minutach trwania próby, a następnych w odstępach czasu zależnych od szybkości narastania PaCO2 do chwili osiągnięcia zalecanych wzrostów PaCO2. W większości przypadków czas wykonania próby może być krótszy niż 10 min, co było zalecane we wcześniejszych kryteriach. Umożliwia to uniknięcie obserwowanych niekiedy spadków SpO2 lub zaburzeń krążenia pod koniec dziesięciominutowej próby.
Należy unikać używania cewników o średnicy większej niż 70% średnicy rurki intubacyjnej, jak również zbyt głębokiego ich wprowadzenia ze względu na możliwość spowodowania barotraumy płuc. Dodatkowo zbyt głębokie wprowadzenie cewnika może spowodować wypłukiwanie CO2 i spowolnienie narastania jego prężności.
U pacjentów z cechami śmierci mózgu często obserwowany jest niski systemowy opór naczyniowy i podwyższony rzut serca, co może pośrednio w czasie próby bezdechu powodować wahania ciśnienia w drogach oddechowych i autowzbudzenie respiratora. Może to być błędnie zinterpretowane jako wdech zainicjowany przez chorego. W przypadku podejrzenia wystąpienia takiego zjawiska należy dokonać analizy kardiogennych oscylacji ciśnienia na monitorze respiratora i ustawić czułość triggera powyżej ich zakresu.
Rekrutacja pęcherzyków płucnych po zakończeniu próby bezdechu umożliwia odwrócenie ich zapadnięcia obserwowanego niekiedy po jej wykonaniu w wariancie insuflacyjnym lub po zastosowaniu zbyt niskich, wartości CPAP w wariancie z zastosowaniem CPAP.
Uwaga 5 - odrębności w rozpoznawaniu śmierci mózgu u dzieci
1) dla potrzeb diagnostyki śmierci mózgu dzieci podzielono na dwie grupy wiekowe:
a) noworodki - od urodzenia do 28. doby życia włącznie,
b) pozostałe dzieci - od 29. doby życia do 18. roku życia;
2) w okresie noworodkowym procedurę rozpoznawania śmierci mózgu (początek okresu obserwacji wstępnej) można rozpocząć:
a) u noworodków donoszonych (wiek postkoncepcyjny > 37 tygodni) - co najmniej 48 godzin od urodzenia,
b) u noworodków urodzonych przedwcześnie - co najmniej 48 godzin od ukończenia 37 tygodni wieku postkoncepcyjnego;
3) czas obserwacji wstępnej, liczony od chwili stwierdzenia podstawowej arefleksji pniowej, niezależnie od rodzaju uszkodzenia mózgu powinien wynosić co najmniej:
a) u noworodków - 48 godzin,
b) u pozostałych dzieci - 24 godziny;
4) dwie serie analiz stwierdzeń i wykluczeń oraz dwie serie badań klinicznych u dzieci powinny być wykonywane po upływie okresu obserwacji wstępnej w odstępach czasowych wynoszących co najmniej:
a) u noworodków - 24 godziny niezależnie od rodzaju uszkodzenia mózgu,
b) u dzieci od 29. doby życia:
- 24 godziny niezależnie od typu uszkodzenia mózgu, jeżeli nie będzie wykonane badanie instrumentalne,
- 3 godziny, jeżeli zostanie wykonane badanie instrumentalne;
5) dodatkowe badania instrumentalne mogą być przeprowadzone z tych samych wskazań co u dorosłych z ograniczeniem w postaci braku rekomendacji do wykonania badania przepływu mózgowego metodą Dopplera u dzieci z niezarośniętymi ciemiączkami oraz do wykonania angiografii i perfuzji TK u dzieci przed ukończeniem 12. roku życia.
Uwaga 6 - Instrumentalne badania potwierdzające
Wprowadzenie
Rozpoznanie śmierci mózgu w większości przypadków opiera się na badaniu klinicznym i dokładnej analizie przyczyny oraz mechanizmu i skutku uszkodzenia mózgu. Jednakże zdarzają się szczególne sytuacje, w których badania kliniczne nie mogą być wykonane lub jednoznacznie interpretowane. Przyczynami powodującymi trudności diagnostyczne są:
1) rozległe urazy twarzoczaszki;
2) uszkodzenia podnamiotowe mózgu;
3) obecność nietypowych odruchów;
4) inne przyczyny (np. niektóre środki trujące lub preparaty farmakologiczne, ciężkie zaburzenia metaboliczne i endokrynne).
W takich szczególnych przypadkach w rozpoznawaniu śmierci mózgu powinno być zastosowane jedno z następujących dodatkowych badań instrumentalnych:
1) badania elektrofizjologiczne:
a) EEG,
b) multimodalne potencjały wywołane;
2) badania przepływu mózgowego:
a) przezczaszkowa ultrasonografia Dopplerowska,
b) angiografia mózgowa,
c) angiografia metodą tomografii komputerowej,
d) perfuzja metodą tomografii komputerowej,
e) scyntygrafia perfuzyjna.
Badania elektrofizjologiczne
Badanie EEG
Zapis EEG powinien być wykonany przez osobę posiadającą dokument (licencję/certyfikat) Polskiego Towarzystwa Neurofizjologii Klinicznej uprawniający do wykonywania badań EEG oraz oceniony przez doświadczonego lekarza w interpretacji badań EEG posiadającego dokument (licencję/certyfikat) Polskiego Towarzystwa Neurofizjologii Klinicznej uprawniający do ich opisywania, zgodnie z poniższymi zaleceniami:
1) rejestracja musi być przeprowadzona przez co najmniej 30 minut;
2) zalecane jest stosowanie elektrod powierzchniowych miseczkowych;
3) elektrody powinny być umieszczone zgodnie z układem 10-20. W montażu zalecane jest stosowanie połączeń między elektrodami odległymi co najmniej 10 cm lub podwójnych odległości elektrod np. Fpl-C3, F3-P3, C3-O1;
4) rejestracja powinna być przeprowadzona na przynajmniej 19 kanałach, łącznie z elektrodami Fz, Cz, Pz. Dodatkowo równocześnie powinien być rejestrowany zapis EKG i inne sygnały polifizjograficzne, np. okulograficzne, oddechowy, mięśniowy w celu ułatwienia identyfikacji artefaktów;
5) wartość impedancji elektrod powinna wynosić 0,1-10 kΩ. Pomiar impedancji dotyczy także elektrody referencyjnej oraz uziemiającej. Wartości impedancji muszą być udokumentowane na początku i na końcu każdego badania. Wartości impedancji powinny być zrównoważone dla wszystkich elektrod;
6) rejestracja powinna odbywać się w możliwie najszerszym paśmie częstotliwości. Dolna częstotliwość graniczna nie może być wyższa niż 1 Hz, a górna niższa niż 30 Hz;
6) rejestracja powinna rozpoczynać się od ustawienia czułości wzmacniacza na 5 do 10 µV/mm. Ze względów interpretacyjnych przynajmniej 30-minutowe odcinki zapisu EEG muszą być zarejestrowane przy czułości minimum 2 µV/mm. Amplituda sygnału kalibracji powinna odpowiadać jego czułości. Wartość sygnału kalibracji powinna być sprawdzana na początku, przy każdej zmianie i na końcu każdej rejestracji. Wszelkie zmiany ustawienia parametrów wzmacniacza muszą być dokumentowane;
8) szumy aparatu EEG w pełnym paśmie rejestracji muszą być okresowo kontrolowane i powinny być nie większe niż 2 µV p-p, aby możliwa była identyfikacja potencjałów EEG o amplitudzie 2 µV;
9) przed rozpoczęciem rejestracji należy sprawdzić tor sygnałowy przez celowe wywołanie artefaktów (np. stuknięcie elektrody ołówkiem);
10) w przypadku wątpliwości dotyczących jakości technicznej zapisu lub interpretacji badanie należy powtórzyć.
Brak aktywności bioelektrycznej mózgu można stwierdzić, gdy w zapisie EEG między parami elektrod rozmieszczonych na powierzchni głowy w odległości co najmniej 10 cm, trwającym co najmniej 30 min, nie rejestruje się czynności o amplitudzie powyżej 2 µV (p-p). Badanie EEG może być wykonane po wykluczeniu wpływu leków neurodepresyjnych na organizm chorego według kryteriów podanych w Uwadze 7.
Multimodalne potencjały wywołane
Słuchowe potencjały wywołane pnia mózgu (SPWPM, ABR - auditory brainstem response)
Zapis SPWPM/ABR powinien być wykonany przez osobę posiadającą dokument (licencję/certyfikat) Polskiego Towarzystwa Neurofizjologii Klinicznej uprawniający do wykonywania badań potencjałów wywołanych (PW) lub dokument (licencję/certyfikat) Polskiego Towarzystwa Audiologicznego i Foniatrycznego uprawniający do wykonywania obiektywnych badań słuchu lub licencję Sekcji Audiologicznej Polskiego Towarzystwa Otolaryngologów Chirurgów Głowy i Szyi na wykonywanie obiektywnych badań słuchu. Ocena wyniku badania musi być przeprowadzona przez lekarza specjalistę z dziedziny neurologii lub neurologii dziecięcej, posiadającego dokument Polskiego Towarzystwa Neurofizjologii Klinicznej upoważniający do wykonywania i opisywania badań SPWPM/ABR lub specjalistę audiologii i foniatrii, doświadczonego w wykonywaniu i interpretacji zapisów słuchowych potencjałów wywołanych pnia mózgu. Słuchowe potencjały wywołane nie mają zastosowania w rozpoznawaniu śmierci mózgu w uszkodzeniach podnamiotowych.
Nieodwracalności uszkodzenia mózgu w badaniu SPWPM/ABR dowodzi obecność w zapisie odpowiedzi jedynie załamka (fali) I, lub załamków (fal) I i II przy jednoczesnym braku obecności załamków (fal) III-V.
Metodyka stymulacji w badaniu SPWPM/ABR:
1) słuchawki: standardowe audiometryczne nauszne lub wewnątrzkanałowe;
2) bodziec akustyczny: trzask o czasie trwania 100 (µs, częstość stymulacji w granicach 10-15/s (częstość stymulacji nie powinna być podharmoniczną częstotliwości 50 Hz);
3) natężenie trzasku: w granicach od 90 do 100 dB nHL;
4) szum maskujący ucho przeciwne: natężenie w granicach 35-45 dB HL;
5) polaryzacja trzasku: naprzemienna, ujemna i dodatnia;
6) zapis dla każdej polaryzacji trzasku musi być wykonany dwukrotnie w celu oceny powtarzalności odpowiedzi.
Parametry akwizycji w badaniu SPWPM/ABR:
1) czas analizy: 10-20 ms;
2) dolna częstotliwość graniczna wzmacniacza: od 20 do 200 Hz;
3) górna częstotliwość graniczna wzmacniacza: od 1500 do 3000 Hz;
4) układ elektrod: elektroda czynna na wierzchołku w punkcie vertex (Cz) lub w linii środkowej (Fpz), elektroda odniesienia na płatku małżowiny usznej lub na wyrostku sutkowatym ipsilateralnie do ucha stymulowanego, elektroda uziemiająca na płatku małżowiny usznej lub na wyrostku sutkowatym kontralateralnie do ucha stymulowanego;
5) elektrody: powierzchniowe, wartość impedancji elektroda-skóra poniżej 5 kΩ;
6) uśrednienie: 1000-3000 odpowiedzi;
7) badanie SPWPM/ABR może być wykonane po wykluczeniu wpływu leków neurodepresyjnych na organizm chorego według kryteriów podanych w Uwadze 7.
Somatosensoryczne potencjały wywołane (SEP - somatosensory evoked potentials)
Zapis SEP powinien być wykonany przez osobę posiadającą dokument (licencję/certyfikat) Polskiego Towarzystwa Neurofizjologii Klinicznej uprawniający do wykonywania badań potencjałów wywołanych oraz oceniony przez lekarza specjalistę w dziedzinie neurologii lub neurologii dziecięcej posiadającego dokument Polskiego Towarzystwa Neurofizjologii Klinicznej upoważniający do ich opisywania.
Brak załamków rejestrowanych znad szyjnego odcinka kręgosłupa w badaniu SEP przy stymulacji nerwu pośrodkowego odpowiada zanikaniu krążenia w obszarze kraniokaudalnym i nie musi występować równocześnie ze zmianami w badaniach EEG i SPWPM/ABR. Badanie SEP dla celów potwierdzenia nieodwracalnego uszkodzenia mózgu nie może być stosowane przy uszkodzeniu szyjnego odcinka rdzenia kręgowego ani w przypadku pierwotnego podnamiotowego uszkodzenia mózgu.
Jeżeli nie ma bezpośrednich dowodów na uszkodzenie odcinka szyjnego rdzenia kręgowego, opisane poniżej nieprawidłowości w badaniu SEP dowodzą nieodwracalności utraty funkcji mózgu w pierwotnie nadnamiotowych oraz wtórnych uszkodzeniach mózgu:
1) brak komponentu N13 przy braku komponentów korowych odpowiedzi zarejestrowanej przy wykorzystaniu Fz jako elektrody odniesienia;
2) brak odpowiedzi korowej (potencjałów dalekiego pola występujących po komponentach N11/P11) zarejestrowanej przy wykorzystaniu zewnątrzczaszkowej elektrody odniesienia i elektrody czynnej umieszczonej ponad korą czuciową.
Sposób wykonania badania:
1) metodyka stymulacji: bodziec prostokątny o czasie trwania 0,1-0,2 ms, częstość stymulacji 3-5 Hz, poziom stymulacji 2-3 mA powyżej progu ruchowego lub 20-30 mA przy braku ruchu, katoda proksymalnie;
2) czas analizy: stymulacja nerwów kończyny górnej 40-50 ms, przy braku odpowiedzi należy go wydłużyć dwukrotnie;
3) ustawienia filtrów (6 dB/oktawę): dolna granica dla korowych SEP: 5-10 Hz, dla rdzeniowych SEP 20-50 Hz; górna granica: 1000-2000 Hz;
4) układ elektrod: elektrody czynne w punkcie Erba tożstronnie do stymulacji, na poziomie C7 i C2 oraz w C3' i C4'; elektroda odniesienia - w punkcie Erba przeciwstronnie do stymulacji;
5) elektrody: powierzchniowe, wartość impedancji elektrod poniżej 5 kΩ;
6) uśrednienie: 512-1024 odpowiedzi, dwa powtarzalne zapisy pomimo braku odpowiedzi.
Badanie SEP może być wykonane po wykluczeniu wpływu leków neurodepresyjnych na organizm chorego według kryteriów podanych w Uwadze 7.
Badanie przepływu mózgowego
Nieodwracalna utrata funkcji mózgu jest najczęściej następstwem braku krążenia mózgowego.
W dużych otwartych urazach czaszkowo-mózgowych i w niektórych wtórnych uszkodzeniach mózgu może nie dochodzić jednak do ustania krążenia mózgowego, gdy wzrost ciśnienia wewnątrzczaszkowego nie jest wystarczający do zatrzymania tego krążenia. W takich przypadkach badanie przepływu mózgowego nie może być zastosowane do potwierdzenia śmierci mózgu.
Przezczaszkowa ultrasonografia dopplerowska (TCD - Transcranial Doppler)
Badanie TCD musi przeprowadzić lekarz o dużym doświadczeniu w zakresie badań neurosonologicznych, posiadający certyfikat Sekcji Neurosonologii Polskiego Towarzystwa Neurologicznego lub po odbyciu specjalistycznego szkolenia w zakresie przezczaszkowego badania dopplerowskiego w stwierdzaniu zatrzymania krążenia mózgowego.
Przy pomocy badania TCD z zastosowaniem sondy 2 MHz z falą pulsacyjną ocenia się przepływ w tętnicach na podstawie mózgu: w tętnicy środkowej mózgu obustronnie przez okno skroniowe oraz w tętnicy podstawnej i obu tętnicach kręgowych przez okno podpotyliczne. Badanie musi być wykonane dwukrotnie w odstępie przynajmniej 30 minut.
Podczas badania należy utrzymywać średnie ciśnienie tętnicze na stałym poziomie > 80 mmHg i ciśnienie rozkurczowe > 50 mmHg - dorośli, u dzieci na poziomie prawidłowym dla wieku, a pacjent nie może być hiperwentylowany (Pa CO2 ≥ 35 mmHg). U pacjenta akcja serca powinna wynosić ≤ 120/min. Jeżeli akcja serca wynosi powyżej 120/min, wówczas należy przyspieszyć przesuw podstawy czasu.
Stwierdzenie następujących rodzajów przepływu w co najmniej trzech tętnicach na podstawie mózgu (obie tętnice środkowe mózgu oraz tętnica podstawna) potwierdza zatrzymanie krążenia mózgowego:
1) małe piki wczesnoskurczowe, które wykazują maksymalną prędkość poniżej 50 cm/s, lub
2) przepływ "z odbicia" (oscylacyjny, wahadłowy dwufazowy) z krótkim zespołem skurczowym i składową rozkurczową, której kierunek jest przeciwstawny do zespołu skurczowego przez cały okres trwania rozkurczu - w tej sytuacji należy monitorować przepływ u pacjenta przez 30 minut, aby wykluczyć wpływ przejściowej zwyżki ciśnienia środczaszkowego (wówczas powtórzenie badania po 30 minutach nie jest konieczne), lub
3) brak przepływu mózgowego w trzech wyżej wymienionych tętnicach na podstawie mózgu, w których przepływ wcześniej (tj. kilka dni lub tygodni) rejestrowano. Należy wyraźnie wykazać zanik przepływu. Jednorazowe stwierdzenie braku przepływu mózgowego bez odniesienia do wcześniejszego badania wyjściowego nie świadczy o zatrzymaniu krążenia mózgowego ze względu na możliwość braku odpowiedniego okna kostnego.
Jako kryterium dodatkowe (pośrednie i nieobowiązkowe) można uznać stwierdzenie powyższych patologicznych rodzajów przepływu w obu tętnicach kręgowych i w obu tętnicach szyjnych wewnętrznych w odcinku wewnątrz - lub zewnątrzczaszkowym (zewnątrzczaszkowo za pomocą badania duplex Doppler).
Czułość badania TCD przekracza 90%, a jego swoistość wynosi 100%. Parametry techniczne i ustawienia aparatu:
1) wzmocnienie (gain) - duże;
2) filtr wysokich częstotliwości ≤ 50 Hz;
3) objętość próbki ≥ 10 mm;
4) obwiednię należy wyłączyć;
5) głębokość pomiaru przepływu w tętnicy środkowej mózgu 50-65 mm (należy unikać rozwidlenia tętnicy szyjnej).
Badania TCD nie można stosować u dziecka z niezarośniętym ciemiączkiem ze względu na brak badań walidacyjnych.
W przypadku nieprzezierności skroniowego okna kostnego lub innych okoliczności uniemożliwiających badanie dopplerowskie przezczaszkowe, badanie USG duplex Doppler tętnic szyjnych i kręgowych w odcinkach zewnątrzczaszkowych wskazujące na możliwość zatrzymania krążenia mózgowego (obecność przepływu wahadłowego dwu- lub trójfazowego lub pików wczesnoskurczowych) może służyć do wyboru odpowiedniego czasu przeprowadzenia innego badania potwierdzającego zatrzymanie krążenia mózgowego.
Scyntygrafia perfuzyjna
Metody z zakresu medycyny nuklearnej są uznaną formą diagnostyki śmierci mózgowej. Metody te w sposób jednoznaczny pozwalają na określenie jednego z podstawowych parametrów śmierci mózgu - brak przepływu krwi w mózgu. W tym celu podstawowe znaczenie odgrywa badanie scyntygraficzne po podaniu radiofarmaceutyku - 99m Tc-HM-PAO lub 99m Tc-ECD.
Do tej pory nie opisano przypadku wyniku fałszywie dodatniego. Przedstawione radiofarmaceutyki charakteryzują się właściwościami lipofilnymi i obojętnym ładunkiem elektrycznym. Właściwości te zapewniają ich dyfuzję zarówno przez nieuszkodzoną, jak i uszkodzoną barierę krew - mózg. Badanie ma charakter nieinwazyjny - znacznik podawany jest dożylnie, a jego stężenie w roztworze jest śladowe. Dzięki temu całkowicie można wykluczyć jakikolwiek wpływ radiofarmaceutyków na czynność innych narządów i na łożysko naczyniowe. Interpretacja badania jest jednoznaczna.
Stwierdza się następujące wzorce krążenia krwi u pacjentów kierowanych w celu rozpoznania śmierci mózgu:
1) brak przepływu (brak radioaktywności) zarówno w strukturach nad-, jak i podnamiotowych;
2) brak przepływu krwi w strukturach nadnamiotowych z zachowanym przepływem w strukturach podnamiotowych;
3) brak przepływu w strukturach podnamiotowych z zachowanym przepływem w strukturach nadnamiotowych;
4) zachowany przepływ krwi zarówno w strukturach nad-, jak i podnamiotowych.
Tylko w przypadku wzorca (1) należy rozpoznać brak przepływu mózgowego krwi.
Uwagi dotyczące wykonywania badań:
1) badania mogą być wykonywane tylko w zakładzie medycyny nuklearnej, w którym wykonuje się rutynowo badania przepływu krwi w mózgu;
2) bezpośrednio przed podaniem radiofarmaceutyku musi być wykonany test kontroli jakości (dopuszczalna czystość radiochemiczna dla 99m Tc-HM-PAO > 80%, dla 99m Tc-ECD > 90%);
3) średnie tętnicze ciśnienie krwi w trakcie badania musi wynosić u dorosłych > 80 mmHg, u dzieci powinno być utrzymane na poziomie prawidłowym dla wieku;
4) podana dawka radiofarmaceutyku musi wynosić > 740 MBq, radiofarmaceutyk musi być podany w formie bolusa, u dzieci dawkę farmaceutyku należy wyliczyć wg masy ciała;
5) badanie musi składać się z dwóch faz: fazy dynamicznej (obrazy co 1 s przez 30 s) i fazy statycznej (obrazy w projekcjach AP i bocznych - każdy trwający co najmniej 3 minuty).
Angiografia mózgowa (DSA - Digital Subtraction Angiography)
Reakcją mózgowia na uszkodzenie jest obrzęk skutkujący wzrostem ciśnienia śródczaszkowego i, zarazem, spadkiem ciśnienia perfuzji mózgowej. W tych warunkach, napływ środka kontrastowego do tętnic mózgowych i odpływ żylny są zwolnione. Przy dalszym spadku ciśnienia perfuzji mózgowej dochodzi do zatrzymania krążenia mózgowego, a jeśli ten stan trwa odpowiednio długo, do śmierci mózgu. Wyniki badań dowodzą, że w części przypadków, przez pewien czas obserwuje się wahadłowe przemieszczanie krwi w drożnych, początkowych odcinkach tętnic mózgowych. Jest to przyczyną opóźnionego kontrastowania tętnic podstawy mózgu w angiografii, określanego w piśmiennictwie terminem "stasis filling". Wykazano, że zjawisko to nie jest przejawem zachowanego krążenia mózgowego, a więc nie wyklucza rozpoznania śmierci mózgu, pod warunkiem braku zakontrastowania gałęzi korowych tętnic mózgowych i żył głębokich mózgu.
DSA - technika wykonania
Dorośli:
1) podanie środka kontrastowego do aorty wstępującej drogą cewnikowania z dostępu przez tętnicę udową, ramienną lub promieniową;
2) cewnik typu PIG-tail 4-5F wielootworowy;
3) środek kontrastowy jodowy, niejonowy o stężeniu ≥ 300 mg I/ml;
4) objętość 30 ml podana przy użyciu strzykawki automatycznej;
5) przepływ 15 ml/s;
6) opóźnienie 0,5 s;
7) P.S.I. 750-1000 w zależności od używanego cewnika;
8) czas serii zdjęciowej 20 s.
Dzieci od 1. do 12. roku życia (odmiany techniki):
1) cewnik typu PIG-tail 3-5F;
2) środek kontrastowy w objętości 1,5-2 ml/kg m.c. nie więcej, niż 30 ml;
3) przepływ zgodnie z masą ciała i wiekiem, nie więcej niż 15 ml/s;
4) P.S.I. 450-1000 w zależności od używanego cewnika.
Dzieci poniżej 1 roku życia (odmiany techniki):
1) cewnik typu PIG-tail 3-4F;
2) środek kontrastowy w objętości 6-8 ml;
3) przepływ 2 ml/s;
4) P.S.I. 450-700 w zależności od używanego cewnika.
DSA - kryteria
Uwidocznienie tętnic w odcinku zewnątrzczaszkowym i brak przepływu wewnątrzczaszkowego potwierdza rozpoznanie zatrzymania krążenia mózgowego. Zakontrastowanie tętnic podstawy mózgu i początkowych odcinków tętnic mózgowych bez uwidocznienia fazy miąższowej i żylnej również potwierdza rozpoznanie zatrzymania krążenia mózgowego.
Alternatywna metoda wybiorczej arteriografii czteronaczyniowej (podanie środka kontrastowego bezpośrednio do tętnic szyjnych i kręgowych) powinna być wykorzystywana jedynie w ośrodkach neuroradiologii zabiegowej, ze względu na możliwość powikłań i obrazów artefaktycznych.
Badanie angiograficzne wykonywane być powinno w warunkach średniego ciśnienia tętniczego ≥ 80 mmHg u dorosłych, a u dzieci na poziomie prawidłowym dla wieku.
Angiografia i perfuzja metodą tomografii komputerowej (CTA - Computed Tomography Angiography, CTP - Computed Tomography Perfusion)
Po uzyskaniu dowodów naukowych na wiarygodność metod angiografii i perfuzji TK w rozpoznawaniu zatrzymania krążenia mózgowego podjęto decyzję wprowadzenia ich do zestawu badań instrumentalnych, które mogą mieć zastosowanie w diagnostyce śmierci mózgu u dzieci powyżej 12. roku życia. Powinny one być wykonywane po upływie co najmniej 6 godzin od chwili wystąpienia klinicznych cech śmierci mózgu w warunkach średniego ciśnienia tętniczego ≥ 80 mmHg u dorosłych, a u dzieci na poziomie prawidłowym dla wieku. Angiografia i perfuzja TK nie są obecnie rekomendowane do oceny zatrzymania krążenia mózgowego u dzieci poniżej 12. roku życia z uwagi na brak ewaluacji ww. metod w tej grupie wiekowej.
CTA - technika wykonania
Badanie angiografii TK w celu rozpoznania zatrzymania krążenia mózgowego składa się z następujących części:
1) skanowanie spiralne bez wzmocnienia kontrastowego obejmujące zakres od poziomu kręgu C1-C2 do sklepienia czaszki w warstwach ≤ 1,5 mm;
2) co najmniej dwukrotne skanowanie spiralne po podaniu środka kontrastowego o stężeniu jodu co najmniej 350 mg/ml, w objętości 80 ml, z przepływem 4 ml/s:
a) pierwsza faza rozpoczynana po 20 sekundach od początku podawania środka kontrastowego lub automatycznie przy użyciu techniki śledzenia bolusa (bolus tracking) z próbkowaniem ustawionym w łuku aorty na wartość 100 j.H. lub na podstawie bolusa testowego (test bolus),
b) druga faza rozpoczynana po 40 sekundach od początku pierwszej.
Badaniem należy objąć zakres od poziomu kręgu C5-C6 (z podziałem tętnicy szyjnej wspólnej) do sklepienia czaszki. Należy zastosować warstwy grubości ≤ 1,5 mm.
Objętość środka kontrastowego może zostać zwiększona w uzasadnionych przypadkach. Zaleca się podanie, bezpośrednio po środku kontrastowym, 0,9% NaCl w objętości 40 ml z przepływem 4 ml/s.
Badanie bez wzmocnienia kontrastowego stanowi odniesienie w ocenie zakontrastowania naczyń. Pierwsza faza po podaniu środka kontrastowego służy ocenie zakontrastowania gałęzi tętnic szyjnych zewnętrznych - tętnic skroniowych powierzchownych lub tętnic twarzowych, co świadczy o prawidłowym napływie środka kontrastowego do tętnic dogłowowych. Druga faza po podaniu środka kontrastowego służy ocenie zakontrastowania tętnic i żył wewnątrzczaszkowych.
CTA - kryteria
Warunkiem rozpoznania zatrzymania krążenia mózgowego w angiografii TK jest stwierdzenie:
1) obustronnego braku zakontrastowania gałęzi korowych tętnic mózgu środkowych (MCA-M4) w drugiej fazie po podaniu środka kontrastowego oraz
2) obustronnego braku zakontrastowania żył mózgu wewnętrznych (ICV) w drugiej fazie po podaniu środka kontrastowego, oraz
3) zakontrastowania gałęzi tętnic szyjnych zewnętrznych - tętnic skroniowych powierzchownych i/lub tętnic twarzowych w pierwszej fazie po podaniu środka kontrastowego.
Jednostronne zakontrastowanie jednej lub dwóch gałęzi korowych tętnicy mózgu środkowej (MCA-M4) nie wyklucza rozpoznania zatrzymania krążenia mózgowego pod warunkiem jednoczesnego braku zakontrastowania żył mózgu wewnętrznych (ICV).
CTA - uwagi
W przypadku niespełnienia podanych kryteriów zaleca się powtórzenie badania angiografii TK lub wykonanie badania perfuzji TK po upływie co najmniej 12 godzin.
Podwyższenie współczynnika osłabienia promieniowania rentgenowskiego przestrzeni podpajęczynówkowej występujące w krwawieniu podpajęczynówkowym, a także w obrzęku mózgu, zapaleniu opon mózgowo-rdzeniowych lub po wcześniejszym podaniu środka kontrastowego do przestrzeni podpajęczynówkowej może imitować zakontrastowanie naczyń wewnątrzczaszkowych. W celu uniknięcia błędnej interpretacji należy w każdym przypadku ocenić obrazy przed i po wzmocnieniu kontrastowym.
W przypadku gdy badanie angiografii TK wykonano w celu innym niż rozpoznanie zatrzymania krążenia mózgowego i według innego protokołu, badanie w celu rozpoznania zatrzymania krążenia mózgowego należy wykonać zgodnie z opisanym wyżej protokołem po upływie co najmniej 15 minut.
CTP - technika wykonania
Badanie perfuzji TK może być metodą pierwszego wyboru umożliwiającą ocenę perfuzji tkankowej mózgu w wyznaczonych obszarach - ROI (ang. Regions Of Interest) z jednoczesnym obrazowaniem poziomu zakontrastowania naczyń mózgowych. Ocena perfuzji może być również metodą rozstrzygającą w rzadkich przypadkach, w których stwierdza się zakontrastowanie tętnic korowych lub żył mózgu wewnętrznych u badanych z utrzymującymi się klinicznymi objawami śmierci mózgu.
Wykonanie badania perfuzji TK dopuszcza się, jeżeli aparat umożliwia objęcie skanowaniem całego mózgowia (dopuszczalne jest zastosowanie techniki "shuttle-mode" albo "toggle table"). W takim przypadku należy podać 50 ml środka kontrastowego z przepływem 6-8 ml/s, a następnie 40-50 ml 0,9% NaCl; czas trwania skanowania - co najmniej 60 s; zakres badania - od poziomu otworu wielkiego do sklepienia czaszki. Zaleca się przygięcie głowy pacjenta w celu zmniejszenia zakresu badania w osi z. Ze względu na często spotykany brak zakontrastowania tętnic mózgowych i niewystarczające zakontrastowanie zatok żylnych mózgowia u pacjentów z dokonaną śmiercią mózgu, w badaniu perfuzji TK jako naczynie referencyjne (ang. Arterial Input Function - AIF i Venous Output Function - VOF) należy użyć tętnicy szyjnej wewnętrznej w odcinku jamistym. Wartość parametrów regionalnego przepływu (ang. regional Cerebral Blood Flow - rCBF) i objętości krwi (ang. regional Cerebral Blood Volume - rCBV) należy analizować w obszarach zainteresowania - ROI-ach o polu powierzchni co najmniej 2 cm2 rozmieszczonych w pniu mózgu oraz obustronnie w płatach czołowych, ciemieniowych, skroniowych, potylicznych, jądrach podstawy i półkulach móżdżku.
Jeżeli oceny zakontrastowania naczyń dokonuje się na podstawie skanów perfuzji TK (ang. CTP derived CTA), to zakontrastowanie gałęzi tętnic szyjnych zewnętrznych należy ocenić na podstawie obrazów wykonanych w 15-20 s po podaniu środka kontrastowego. Za poziom zakontrastowania tętnic mózgu środkowych i żył mózgu wewnętrznych należy uznać najwyższy poziom zaobserwowany w całej serii obrazów. Do tego celu można wykorzystać technikę timing-invariant CTA. Przy zastosowaniu tej metody obrazowania w rozpoznaniu zatrzymania krążenia mózgowego obowiązują takie same kryteria interpretacji poziomu zakontrastowania naczyń jak dla metody dwufazowej angiografii TK.
CTP - kryteria
Warunkiem rozpoznania zatrzymania krążenia mózgowego w perfuzji TK jest stwierdzenie wartości rCBF poniżej 10 ml/100g/min i rCBV poniżej 1 ml/100g we wszystkich ROI-ach.
W szczególnych przypadkach, u pacjentów z cechami śmierci mózgu, w okolicy kraniektomii odbarczającej lub otwartych złamań mogą pojawić się obszary regionalnej dekompresji. W regionach tych mogą występować izolowane obszary wykazujące wyższe od granicznych wartości rCBF i rCBV. Zjawisko to nie wyklucza rozpoznania zatrzymania krążenia mózgowego, jeżeli w pozostałych ROI-ach, w tym w pniu mózgu, stwierdzane są wartości rCBF poniżej 10 ml/100g/min i rCBV poniżej 1 ml/100g.
CTP - uwagi
Oceny perfuzji TK nie należy przeprowadzać w przypadkach, w których najwyższa wartość (peak) krzywej AIF jest niższa niż 100 j.H., a także gdy artefakty uniemożliwiają wiarygodne obliczenia rCBF i rCBV.
Uwaga 7- Wykluczenie wpływu leków narkotycznych, neurodepresyjnych i zwiotczających, a także środków psychoaktywnych na odruchy pniowe
Badania potwierdzające arefleksję pniową, a także badania elektrofizjologiczne w diagnostyce śmierci mózgu mogą być niewiarygodne u tych pacjentów, którzy są pod wpływem leków narkotycznych, neurodepresyjnych i zwiotczających, a także środków psychoaktywnych. Wynika to z tego, że każda ww. substancja obecna w surowicy krwi w odpowiednio wysokich stężeniach, może wywołać kliniczne objawy śmierci mózgu. Dlatego też w takich przypadkach konieczne jest wykonanie badań obrazowych potwierdzających zatrzymanie krążenia mózgowego.
Na podstawie dostępnych doniesień naukowych przyjęto, że leki zastosowane w celach medycznych, w dawkach terapeutycznych, nie mogą być odpowiedzialne za wystąpienie arefleksji pniowej, zanik czynności bioelektrycznej mózgu oraz brak odpowiedzi w badaniu potencjałów wywołanych słuchowych i somatosensorycznych, jeżeli:
1) w czasie ostatnich 24 godzin terapii zastosowano: opioidy z wyłączeniem remifentanylu, barbiturany lub benzodiazepiny w ilości nie większej niż podwójna rutynowo zalecana dawka jednorazowa;
2) do terapii wykorzystano bolusy lub wlewy ketaminy, propofolu lub remifentanylu, ale od wstrzymania ich podaży upłynęło co najmniej 12 godzin;
3) od zakończenia znieczulenia ogólnego upłynęły co najmniej 24 godziny;
4) w czasie określonym w pkt 1-3 badany nie był w stanie hipotermii oraz hipotensji, przy dodatkowym założeniu, że jego narządy, eliminujące leki, były wydolne.
Celem oceny wydolności narządów, w zakresie ich zdolności do eliminacji leków przyjęto, że o możliwości upośledzenia tego procesu mogą świadczyć:
1) niewydolność nerek w stopniu II i III wg kryteriów AKIN;
2) niewydolność wątroby prowadząca do wzrostu poziomu bilirubiny całkowitej w surowicy krwi, która przekracza trzykrotną wartość normy tego parametru dla laboratorium wykonującego badanie.
W przypadku medycznego zastosowania barbituranów, benzodiazepin czy leków o działaniu narkotycznym, w dawkach wyższych niż opisane powyżej (tj. wyższych niż podwójna rutynowo zalecana dawka jednorazowa), przed rozpoczęciem badania klinicznego należy odczekać okres równy lub dłuższy od czterokrotnego okresu półtrwania podanego w tabeli 1 (jeżeli pacjent nie był w tym czasie w stanie hipotermii i hipotensji oraz narządy eliminujące leki były wydolne) lub wyznaczyć stężenie takiego leku w surowicy krwi. W przypadku zastosowania hipotermii terapeutycznej lub znieczulenia w hipotermii należy odczekać okres równy lub dłuższy od pięciokrotnego okresu półtrwania ww. leków.
Dla leków nieujętych w tabeli 1 za wartość okresu półtrwania należy przyjąć dane zawarte w publikacji: Martin Schulz i współautorzy: "Therapeutic and toxic blood concentrations of nearly 1,000 drugs and other xenobiotics", Critical Care 2012, 16: R136 dostępnej pod adresem https://doi.org/10.1186/cc11441.
Przetrwałe zwiotczenie, wynikające z zastosowania leków zwiotczających, może zostać wykluczone, jeżeli podczas badania stwierdzone zostaną rdzeniowe odruchy ruchowe lub przy użyciu stymulatora nerwowo-mięśniowego wywołana zostanie reakcja ruchowa.
W przypadku oznaczenia stężenia leków o działaniach narkotycznych, neurodepresyjnych, zwiotczających oraz środków psychoaktywnych w surowicy krwi:
1) jeżeli wartość stężenia leku jest równa lub niższa niż połowa minimalnego stężenia podanego w tabeli 1, można rozpocząć badanie kliniczne i badania elektrofizjologiczne;
2) dla leków nieujętych w tabeli 1 należy przyjąć wartość połowy minimalnego stężenia terapeutycznego podanego w kolumnie drugiej (therapeutic "normal"), a dla środków, dla których nie określono stężenia terapeutycznego, jako zalecaną granicę analityczną należy przyjąć wartość stężenia toksycznego podaną w trzeciej kolumnie tabeli [toxic (from)] we wspomnianej powyżej publikacji Martina Schulza i współautorów;
3) jeżeli wartość stężenia leku jest wyższa niż określona w pkt 1 i 2, należy powtórzyć badanie toksykologiczne w terminie późniejszym lub wykonać badanie przepływu mózgowego krwi.
W przypadku badań chemiczno-toksykologicznych należy postępować zgodnie z następującymi zasadami:
1) w pierwszej kolejności należy przeprowadzić przesiewowe, jakościowe badania toksykologiczne jedną z dostępnych metod immunochemicznych (np. EMIT, FPIA, ELISA) lub instrumentalnych;
2) w przypadku potwierdzenia obecności środka należy wyznaczyć jego stężenie przy użyciu metody działającej na innej zasadzie detekcji niż użyta metoda przesiewowa (np. LC/MS, GC/MS, HPLC/DAD).
W sytuacji podejrzenia pozamedycznego zastosowania leków lub użycia innych substancji psychoaktywnych w celach niemedycznych (ostre zatrucia, rekreacyjne stosowanie środków odurzających i substancji psychotropowych) zawsze należy wykonać badanie przepływu mózgowego krwi.
Wywiad i dokumentacja medyczna mają podstawowe znaczenie w ustaleniu sposobu postępowania diagnostycznego w ocenie śmierci mózgu.
Tabela 1
Stężenia i okresy półtrwania najczęściej stosowanych leków oraz ksenobiotyków istotne w rozpoznawaniu śmierci mózgu.
| Lp. | Związek farmakologicznie czynny/ aktywny metabolit | Minimalna granica stężeń terapeutycznych dla leków [mg/l] oraz zalecana granica analityczna dla innych środków | Okres półtrwania w osoczu - T ½ [h] | |
| 1 | Baklofen | 0,05 | 4 | |
| 2 | Barbiturany długo działające | Fenobarbital | 5,0 | 90 |
| 3 | Barbiturany krótko działające | Tiopental | 0,5 | 46 |
| Pentobarbital | 0,5 | 30 | ||
| 4 | Buprenorfina | 0,001 | 36 (po podaniu przezskórnym) | |
| 5 | Dantrolen | 0,3 | 9 | |
| 6 | Diazepam | 0,06 | 40 | |
| 7 | Fenotiazyny | 0,025 | 18 | |
| 8 | Fentanyl | 0,0015 | 3,5 | |
| 9 | Gabapentyna | 2,0 | 11 | |
| 10 | Haloperidol | 0,003 | 40 | |
| 11 | Karbamazepina | 2,25 | 25 | |
| 12 | Klobazam | 0,1 | 58 | |
| 13 | Klomipramina | 0,015 | 37 | |
| 14 | Klozapina | 0,1 | 26 | |
| 15 | Kwas walproinowy | 25,0 | 20 | |
| 16 | Lorazepam | 0,02 | 24 | |
| 17 | Midazolam | 0,04 | 5 | |
| 18 | Morfina | 0,04 | 3 | |
| 19 | Nitrazepam | 0,015 | 38 | |
| 20 | Nordiazepam | 0,1 | 100 | |
| 21 | Oksykodon | 0,008 | 6 | |
| 22 | Sufentanyl | 0,001 | 12 | |
| 23 | Temazepam/oksazepam | 0,15 | 15 | |
| 24 | Tramadol | 0,05 | 6 | |
| 25 | Kodeina | 0,1 | 4 | |
| 26 | Delta-9-THC czynny tetrahydrokannabinol zawarty w konopiach indyjskich (np. w marihuanie, haszyszu) | < 2 ng/ml | okres eliminacji 8 | |
| 27 | Alkohole: |
|
| |
|
| Etylowy | Stężenie maksymalnie < 0,2 mg/ml | okres eliminacji 0,15 mg/ml/h (średnio) | |
|
| Metylowy | Stężenie maksymalnie < 0,1 mg/ml | - | |
|
| Glikol etylenowy | Stężenie maksymalnie < 15 mg% | - | |
Uwagi dotyczące zapisu stosowanych jednostek:
mg/l = µg/ml (miligram w litrze = mikrogram w mililitrze surowicy),
mg/ml = ‰ (promille),
mg% = miligram w 100 ml surowicy.
Zalecane do wykorzystania metody analityczne:
LC-MS - wysokosprawna chromatografia cieczowa sprzężona ze spektrometrią mas.
HPLC-DAD - wysokosprawna chromatografia cieczowa z detekcją diodową.
EMIT, FPIA, ELISA - metody immunochemiczne - pozwalają na ocenę półilościową związków z danej grupy farmakologicznej (bez rozróżniania konkretnej pochodnej). Dotyczy to np. benzodiazepin, TLPD itd. W przypadku potrzeby indywidualnego, celowanego oznaczenia związku z danej grupy, np. temazepamu, należy zastosować techniki chromatograficzne.
Kryteria i sposób stwierdzenia trwałego nieodwracalnego ustania czynności mózgu opracował zespół specjalistów w składzie:
ANESTEZJOLOGIA I INTENSYWNA TERAPIA
Prof dr hab. n. med. Romuald Bohatyrewicz - przewodniczący Zespołu
Prof dr hab. n. med. Krzysztof Kusza - zastępca przewodniczącego Zespołu
Prof. dr hab. n. med. Andrzej Nestorowicz
Prof. dr hab. n. med. Radosław Owczuk
Prof. dr hab. n. med. Piotr Knapik
Prof. dr hab. n. med. Andrzej Kϋbler
Prof. dr hab. n. med. Wojciech Krajewski
Prof. dr hab. n. med. Maciej Żukowski
Dr hab. n. med. Mariusz Piechota
Dr n. med. Joanna Sołek-Pastuszka
Dr n. med. Waldemar Iwańczuk
Dr n. med. Wojciech Saucha
Dr n. med. Zbigniew Szkulmowski
INTENSYWNA TERAPIA
Dr hab. n. med. Dariusz Maciejewski
ANESTEZJOLOGIA INTENSYWNA TERAPIA/NEONATOLOGIA
Prof. dr hab. n. med. Andrzej Piotrowski
Dr n. med. Wojciech Walas
NEONATOLOGIA
Prof. dr hab. med. Ewa Helwich
NEUROLOGIA
Prof. dr hab. n. med. Danuta Ryglewicz
Prof. dr hab. n. med. Jan Kochanowski
Dr n. med. Joanna Wojczal
NEUROCHIRURGIA
Prof. dr hab. n.med. Tomasz Trojanowski
NEUROLOGIA DZIECIĘCA/PEDIATRIA
Prof. dr hab. n. med. Sergiusz Jóźwiak
Dr hab. med. Ewa Emich-Widera
PEDIATRIA
Dr n. med. Marek Migdał
RADIOLOGIA I DIAGNOSTYKA OBRAZOWA
Prof. dr hab. n. med. Jerzy Wałecki
Prof. dr hab. n. med. Monika Bekiesińska-Figatowska
Dr hab. n. med. Elżbieta Jurkiewicz
Dr hab. n. med. Marcin Sawicki
MEDYCYNA NUKLEARNA
Prof. dr hab. n. med. Leszek Królicki
MEDYCYNA SĄDOWA
Dr hab. n. med. Grzegorz Teresiński
TOKSYKOLOGIA KLINICZNA
dr hab. n. med Jacek Anand
dr hab. n. med. Anna Krakowiak
dr n med. Magdalena Łukasik-Głębocka
dr n. med. Piotr Burda
AUDIOLOGIA I FONIATRIA, OTORYNOLARYNGOLOGIA
Prof. dr hab. n. med. Mariola Śliwińska-Kowalska
REUMATOLOGIA
Prof. dr hab. n. med. Anna Machoy-Mokrzyńska
SPECJALNOŚCI NIELEKARSKIE:
Prof. dr hab. n. med. Krzysztof Borowiak - toksykologia
Prof. dr hab. inż. Ewa Zalewska - inżynieria biomedyczna
Dr hab. nauk farmaceutycznych Maria Kała - toksykologia
Dr hab. med. inż. Krzysztof Kochanek - biologia medyczna
PROTOKÓŁ POSTĘPOWANIA DIAGNOSTYCZNEGO ŚMIERCI MÓZGU

PROTOKÓŁ STWIERDZENIA ŚMIERCI MÓZGU
|
|
1) Lekarz 1 - lekarz, o którym mowa w art. 43a ust. 5 ustawy z dnia 5 grudnia 1996 r. o zawodach lekarza i lekarza dentysty - specjalista posiadający tytuł specjalisty lub specjalizację II stopnia w dziedzinie anestezjologii i intensywnej terapii lub neonatologii.
2) Lekarz 2 - lekarz, o którym mowa w art. 43a ust. 5 ustawy z dnia 5 grudnia 1996 r. o zawodach lekarza i lekarza dentysty - specjalista posiadający tytuł specjalisty lub specjalizację II stopnia w dziedzinie neurologii, neurologii dziecięcej lub neurochirurgii.
- Data ogłoszenia: 2020-01-17
- Data wejścia w życie: 2020-01-17
- Data obowiązywania: 2020-01-17
REKLAMA
Monitor Polski
REKLAMA
REKLAMA
