REKLAMA
Dziennik Ustaw - rok 2021 poz. 2342
ROZPORZĄDZENIE
MINISTRA ZDROWIA1)
z dnia 2 grudnia 2021 r.
w sprawie programu pilotażowego przeglądów lekowych
Na podstawie art. 48e ust. 5 ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych (Dz. U. z 2021 r. poz. 1285, z późn. zm.2)) zarządza się, co następuje:
§ 1. [Program pilotażowy przeglądów lekowych]
§ 2. [Definicje]
1) apteka - aptekę ogólnodostępną, o której mowa w ustawie z dnia 6 września 2001 r. - Prawo farmaceutyczne (Dz. U. z 2021 r. poz. 1977 i 2120);
2) lek - produkt leczniczy, o którym mowa w ustawie z dnia 6 września 2001 r. - Prawo farmaceutyczne;
3) pacjent - świadczeniobiorcę w rozumieniu art. 2 ust. 1 ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych;
4) preparat - produkt niebędący lekiem, posiadający status suplementu diety, wyrobu medycznego, żywności specjalnego przeznaczenia medycznego albo jakikolwiek inny status, mogący być przez pacjenta traktowany jako lek albo jego ekwiwalent;
5) wielochorobowość - stan pacjenta przejawiający się jednoczesnym występowaniem u niego co najmniej 3 chorób, których przebieg ma charakter przewlekły;
6) wielolekowość - stan przyjmowania przez pacjenta wielu leków jednocześnie, związany z wielochorobowością tego pacjenta.
§ 3. [Cel pilotażu]
2. Do celów pilotażu należy również:
1) ocena przeglądów lekowych jako adekwatnego i efektywnego narzędzia identyfikacji i ograniczania zjawiska nadmiernego stosowania leków, w tym wielolekowości;
2) ocena adekwatności i praktycznej efektywności przeglądów lekowych jako narzędzia identyfikacji źródeł zjawiska nadmiernego stosowania leków, w tym wielolekowości w populacji, oraz ocena możliwości zastosowania przeglądów lekowych w ograniczaniu tego zjawiska;
3) ocena zasadności uwzględnienia przeglądu lekowego jako części opieki farmaceutycznej i uznania jej za świadczenia opieki zdrowotnej oraz finansowania ich ze środków publicznych jako tego rodzaju świadczenia, dokonana przez pryzmat ocen, o których mowa w pkt 1 i 2;
4) wypracowanie optymalnego modelu prowadzenia dokumentacji opieki farmaceutycznej na bazie dokumentacji przygotowanej na podstawie przeprowadzonych przeglądów lekowych.
§ 4. [Podmiot prowadzący pilotaż]
2. Realizatorem pilotażu może być apteka, która spełnia następujące wymagania:
1) zgłosiła podmiotowi leczniczemu gotowość do udziału w pilotażu;
2) realizuje umowę na realizację recept refundowanych zawartą z Narodowym Funduszem Zdrowia, zwanym dalej "Funduszem", i przedstawi jej kopię podmiotowi leczniczemu;
3) nie toczy się postępowanie administracyjne w przedmiocie cofnięcia zezwolenia na jej prowadzenie;
4) spełnia warunki określone w § 5;
5) zatrudnia farmaceutę spełniającego wymagania, o których mowa w § 6;
6) wyrazi zgodę na poddanie się nadzorowi podmiotu leczniczego w zakresie realizacji pilotażu.
3. Podmiot leczniczy w celu wyłonienia realizatorów pilotażu przeprowadza postępowanie w przedmiocie zawarcia umowy o realizację pilotażu.
4. Wyboru realizatorów pilotażu w liczbie nie większej niż 75 podmiot leczniczy dokonuje z uwzględnieniem:
1) udziału podmiotów z obszaru całego kraju, przy czym należy dążyć do zapewnienia udziału podmiotów ze wszystkich województw, zarówno z terenów miejskich, jak i wiejskich;
2) kolejności zgłoszeń;
3) uczestnictwa w pilotażu nie więcej niż 75 farmaceutów.
5. Podmiot leczniczy występuje do wojewódzkiego inspektora farmaceutycznego właściwego ze względu na miejsce lokalizacji apteki o przekazanie informacji w zakresie określonym w ust. 2 pkt 3 oraz o opinię o spełnianiu warunków określonych w § 5. Informacja i opinia są przekazywane w terminie 30 dni od dnia otrzymania wystąpienia.
6. Podmiot leczniczy przekazuje:
1) aptece informację w sprawie zakwalifikowania do pilotażu;
2) Funduszowi listę realizatorów pilotażu.
7. Apteka zakwalifikowana do pilotażu ma obowiązek informowania podmiotu leczniczego o wszelkich zmianach w zakresie spełniania wymagań określonych w ust. 2 pkt 2-5.
§ 5. [Obowiązki w aptece będącej realizatorem pilotażu]
1) przeprowadzać przeglądy lekowe w miejscu i w sposób zapewniający poszanowanie praw pacjenta oraz bezpieczeństwo przekazywanych przez niego informacji;
2) zapewnić miejsce siedzące dla pacjenta;
3) przechowywać dokumentację związaną z prowadzonym pilotażem zgodnie z ogólnie przyjętymi zasadami bezpieczeństwa przechowywania recept w aptece.
§ 6. [Przegląd lekowy w ramach pilotażu]
1) ukończył studia podyplomowe w zakresie opieki farmaceutycznej lub
2) posiada co najmniej roczną praktykę wykonywania przeglądów lekowych w innym kraju potwierdzoną przetłumaczonym na język polski dokumentem wydanym w tym kraju, potwierdzającym kwalifikacje tego farmaceuty do prowadzenia przeglądów lekowych.
§ 7. [Ilość pacjentów objętych pilotażem]
2. Pilotażem może zostać objęta osoba:
1) w wieku pomiędzy 18 a 60 rokiem życia, przyjmująca na stałe nie mniej niż 5 leków wydawanych z przepisu lekarza, w tym co najmniej 2 leki należące do kategorii C zgodnie z aktualną klasyfikacją anatomiczno-terapeutyczno-chemiczną produktów leczniczych (ATC) sporządzoną przez Centrum Współpracy nad Metodologią Statystyczną Leków, które podlega pod Światową Organizację Zdrowia, albo która ukończyła 60 rok życia, przyjmująca na stałe nie mniej niż 10 leków, w tym co najmniej 2 leki należące do kategorii C zgodnie z tą klasyfikacją; w przypadku gdy w skład leku wydawanego z przepisu lekarza wchodzi więcej niż jedna substancja czynna, każda z tych substancji liczona jest jako jeden lek;
2) u której farmaceuta zidentyfikował nadmierną liczbę stosowanych jednocześnie leków;
3) która wyraziła pisemną zgodę na objęcie jej pilotażem prowadzonym w danej aptece, w tym stosowanie się do ustalonych z farmaceutą zaleceń będących wynikiem dokonanego przez niego przeglądu lekowego;
4) która wyraziła gotowość osobistego kontaktowania się z farmaceutą w sprawach związanych z pilotażem, a w szczególnych przypadkach za pośrednictwem urządzeń do komunikacji na odległość;
5) która wyraziła gotowość do współdziałania z farmaceutą i lekarzem podstawowej opieki zdrowotnej w zakresie dokonania optymalizacji farmakoterapii i suplementacji.
3. Kwalifikacji pacjenta do pilotażu obejmującej ustalenie spełniania przesłanek, o których mowa w ust. 2, dokonuje farmaceuta, o którym mowa w § 6. O zakwalifikowaniu pacjenta do pilotażu farmaceuta informuje niezwłocznie podmiot leczniczy.
4. Formularz zgody, o której mowa w ust. 2 pkt 3, podlega zniszczeniu w aptece niezwłocznie po podjęciu przez nią działania, o którym mowa w § 11 ust. 2.
§ 8. [Przegląd lekowy w drodze analizy farmakoterapeutycznej]
2. Celem przeglądu lekowego jest:
1) identyfikacja:
a) rzeczywistych lub potencjalnych problemów pacjenta związanych ze stosowaniem leków i ich przyczyn, w tym związanych z przestrzeganiem przez pacjenta zaleceń dotyczących farmakoterapii oraz jego udziału w procesie farmakoterapii, oraz uszeregowanie tych problemów według ich ważności i poziomu ryzyka dla pacjenta,
b) czynników mających wpływ na prawidłowość stosowanej farmakoterapii, w tym działań, o których mowa w art. 2 pkt 3a lub 3d ustawy z dnia 6 września 2001 r. - Prawo farmaceutyczne, mogących być wynikiem przyjmowanych leków lub interakcji spowodowanych ich przyjmowaniem;
2) edukacja pacjenta w zakresie:
a) właściwego sposobu stosowania leków,
b) profilaktyki i zdrowego stylu życia,
c) przestrzegania zaleceń farmakoterapeutycznych,
d) prawa do uzyskania wyczerpującej informacji o stosowanej farmakoterapii podczas każdej wizyty u lekarza i podczas konsultacji farmaceutycznej.
3. Wynikiem przeglądu lekowego w ramach pilotażu jest opracowanie dla pacjenta:
1) indywidualnego planu opieki farmaceutycznej, zwanego dalej "IPOF", w którym określa się algorytm działań farmaceuty w czasie służący uzyskaniu celu terapeutycznego, ekonomiczno-finansowego względem pacjenta lub poprawie jakości jego życia; plan ten opracowuje się w oparciu o model opieki farmaceutycznej Therapeutic Outcome Monitoring (TOM) i zasady medycyny opartej na faktach, koncentrujący się na nadzorze nad farmakoterapią osób przewlekle chorych wymagających długotrwałego stosowania leków, którzy potrzebują wsparcia merytorycznego i edukacyjnego w czasie farmakoterapii;
2) planu rozwiązania wszystkich wykrytych rzeczywistych lub potencjalnych problemów pacjenta związanych ze stosowaniem leków według metody SOATP uwzględniającej dane subiektywne, dane obiektywne, ocenę przyczyn takich problemów, określenie zamierzonego efektu terapeutycznego oraz plan działania.
§ 9. [Granice czasowe pilotażu]
1) organizacji pilotażu, który trwa do 3 miesięcy od dnia wejścia w życie rozporządzenia i obejmuje dokonanie przez podmiot leczniczy wyboru realizatorów pilotażu oraz zawarcie przez podmiot leczniczy umów o realizację pilotażu z realizatorami;
2) realizacji pilotażu, który trwa 6 miesięcy od dnia zakończenia etapu organizacji pilotażu i obejmuje kwalifikację pacjentów do pilotażu na zasadach określonych w § 7 oraz wykonywanie przeglądów lekowych;
3) ewaluacji pilotażu, który następuje po etapie realizacji pilotażu i kończy się nie później, niż z dniem upływu terminu realizacji pilotażu i obejmuje analizę danych z przeprowadzonych przeglądów lekowych, oraz przedstawienie na ich podstawie oraz na podstawie związanego z nimi pomiaru wskaźników, o którym mowa w § 13, wniosków w sprawach, o których mowa w § 3.
§ 10. [Przebieg etapu realizacji pilotażu, o którym mowa w § 9 pkt 2]
2. Pierwszy kontakt obejmuje szczegółowy wywiad farmaceutyczny przeprowadzany z pacjentem, który polega na zadaniu zestawu odpowiednio dobranych i sformułowanych pytań, mających na celu pozyskanie wiedzy w szczególności o:
1) stosowanych przez pacjenta lekach lub preparatach, różnych postaciach i częstotliwości ich stosowania, ostatnich zmianach w zakresie stosowania leków przez pacjenta lub powodach zaprzestania przyjmowania przez niego leków;
2) zdiagnozowanych u pacjenta chorobach;
3) obecnych objawach chorobowych lub dolegliwościach, które pacjent zgłasza lub których występowanie podejrzewa, w tym o podejrzeniach działań, o których mowa w art. 2 pkt 3a lub 3d ustawy z dnia 6 września 2001 r. - Prawo farmaceutyczne;
4) alergiach i nietolerancjach na leki lub preparaty lub innych problemach pacjenta związanych z ich stosowaniem.
3. Drugi kontakt odbywa się do 10 dni od dnia pierwszego kontaktu i obejmuje wdrożenie wobec pacjenta IPOF, który:
1) w przypadku gdy wykryte w trakcie pierwszego kontaktu problemy pacjenta związane ze stosowaniem leków dotyczą leków o kategorii dostępności wydawane bez przepisu lekarza - OTC lub preparatów - polega na rozmowie informacyjno-edukacyjnej farmaceuty realizującego przegląd lekowy z pacjentem i wydaniu pisemnego zalecenia w celu optymalizacji farmakoterapii oraz uświadomienia pacjenta w zakresie niebezpieczeństw płynących z samoleczenia, a także edukacji w zakresie działań profilaktycznych;
2) w przypadku gdy wykryte w trakcie pierwszego kontaktu problemy pacjenta związane ze stosowaniem leków dotyczą leków innych niż określone w pkt 1 i farmaceuta realizujący przegląd lekowy:
a) podejrzewa albo stwierdza niepoprawną realizację zaleceń farmakoterapeutycznych - polega na przeprowadzeniu rozmowy informacyjno-edukacyjnej farmaceuty realizującego przegląd lekowy z pacjentem w celu poprawy podatności pacjenta na zalecenia lekarskie oraz uświadomienia pacjentowi konsekwencji zdrowotnych niestosowania się do zaleceń,
b) podejrzewa albo stwierdza niepoprawną farmakoterapię - polega na:
- przeprowadzeniu rozmowy farmaceuty realizującego przegląd lekowy z pacjentem i wydaniu pacjentowi pisemnego zalecenia zawierającego informację merytoryczną kierowaną do lekarza opatrzoną danymi farmaceuty dokonującego przeglądu lekowego, w celu nawiązania kontaktu pacjenta z lekarzem i potwierdzenia prawidłowości albo skorygowania zaleceń farmakoterapeutycznych,
- przeprowadzeniu rozmowy farmaceuty realizującego przegląd lekowy z lekarzem prowadzącym farmakoterapię pacjenta, w celu potwierdzenia prawidłowości dotychczasowych zaleceń farmakoterapeutycznych albo ich stosownego skorygowania.
4. Trzeci kontakt odbywa się po upływie miesiąca od dnia drugiego kontaktu i obejmuje weryfikację prawidłowości zastosowania się pacjenta do wdrożonego IPOF oraz weryfikację działań lekarza, o którym mowa w ust. 3 pkt 2 lit. b, w tym wskazania, w jaki sposób lekarz odniósł się do rekomendacji farmaceuty oraz w jaki sposób pacjent zareagował na proces wdrażania IPOF.
5. W przypadku, o którym mowa w ust. 3 pkt 2 lit. a, farmaceuta może samodzielnie skonsultować prawidłowość zaleceń lub preskrypcji z lekarzem, który wystawił receptę albo na którego zlecenie taką receptę wystawiła pielęgniarka albo położna w ramach kontynuacji zlecenia lekarskiego.
6. W przypadku stwierdzenia niepoprawności farmakoterapii, o którym mowa w ust. 3 pkt 2 lit. b, farmaceuta może - zamiast pacjenta, biorąc pod uwagę jego potrzeby i oczekiwania, samodzielnie ustalić z lekarzem prawidłowy schemat farmakoterapii.
7. W przypadku podejrzenia niepoprawności farmakoterapii, o którym mowa w ust. 3 pkt 2 lit. b, farmaceuta samodzielnie dokonuje w tym zakresie konsultacji z lekarzem, który wystawił receptę albo na którego zlecenie taką receptę wystawiła pielęgniarka albo położna w ramach kontynuacji zlecenia lekarskiego.
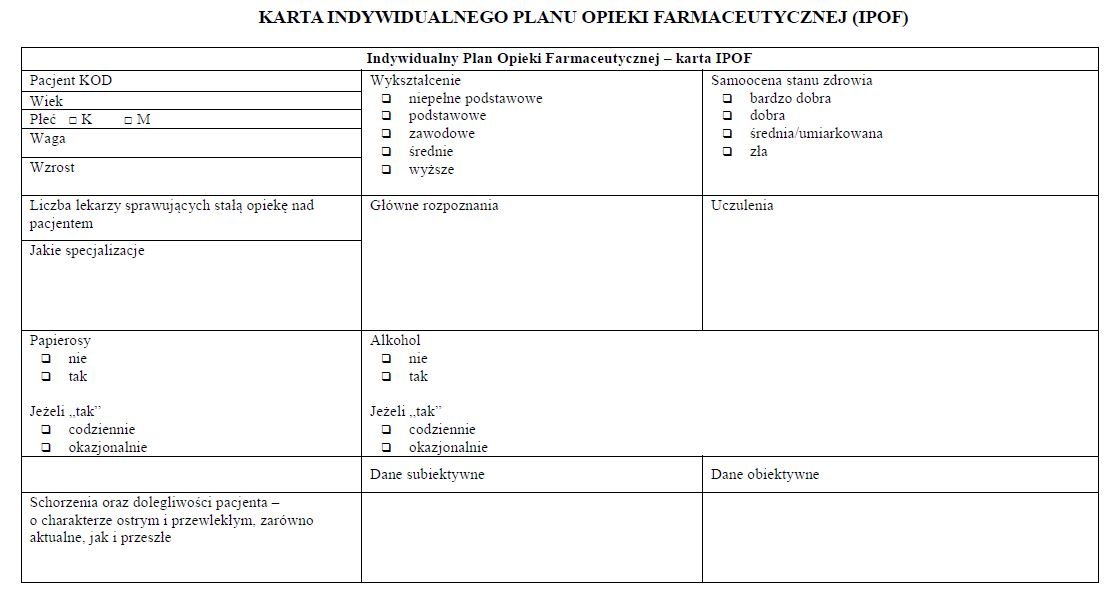
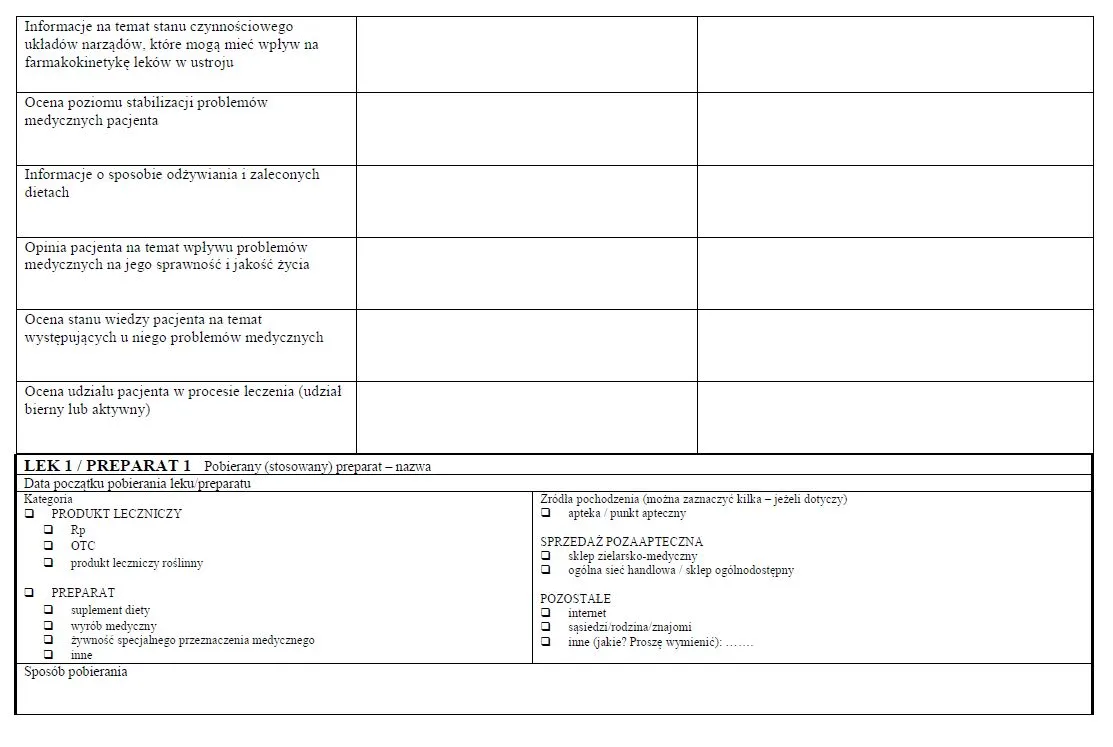
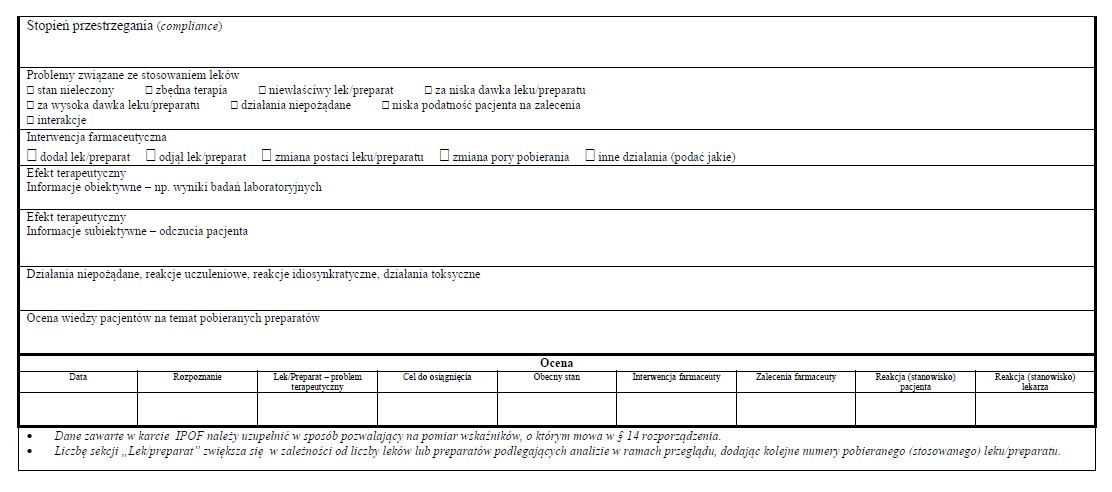
§ 11. [Karta IPOF]
2. Karta IPOF jest przekazywana, w postaci papierowej, niezwłocznie po zakończeniu etapu realizacji pilotażu, o którym mowa w § 9 pkt 2, do podmiotu leczniczego, w celu dokonania - w ramach działań ewaluacyjnych określonych w § 9 pkt 3 - analizy danych zawartych w tych kartach.
3. Dokumentacja, o której mowa w ust. 2, podlega zniszczeniu przez podmiot leczniczy niezwłocznie po zakończeniu etapu ewaluacji pilotażu, o którym mowa w § 9 pkt 3.
§ 12. [Zapewnienie koordynacji przebiegu pilotażu]
2. Koordynatorem może być farmaceuta posiadający co najmniej stopień naukowy doktora nauk farmaceutycznych lub nauk medycznych oraz umiejętności, doświadczenie praktyczne i naukowe w zakresie opieki farmaceutycznej, a także wiedzę i umiejętności praktyczne w zakresie wykonywania i nadzorowania przeglądów lekowych realizowanych w sposób przewidziany dla pilotażu.
3. Do zadań koordynatora należy:
1) udzielanie realizatorom pilotażu wsparcia i informacji o organizacji procesu przeprowadzania przeglądów lekowych, ich praktycznego wykonywania oraz dokonywania oceny ich przebiegu i efektów;
2) zapewnienie współpracy i wymiany doświadczeń między realizatorami pilotażu.
§ 13. [Wskaźniki realizacji projektu]
1) łączna liczba pacjentów objętych pilotażem;
2) łączna liczba wykonanych przeglądów lekowych;
3) spadek natężenia wielolekowości u pacjentów w wyniku objęcia ich przeglądem lekowym;
4) odsetek przypadków, w których w wyniku przeprowadzenia przeglądu lekowego nastąpiła poprawa subiektywnie ocenianego samopoczucia pacjenta mierzonego spadkiem liczby i natężenia zgłaszanych przez niego dolegliwości;
5) odsetek przypadków, w których w wyniku dokonanego przeglądu lekowego nastąpiło u pacjentów zidentyfikowanie i wyeliminowanie istotnych klinicznie interakcji lek-lek lub lek-choroba;
6) odsetek przypadków, w których w wyniku dokonanego przeglądu lekowego nastąpiło wyeliminowanie potencjalnie niepoprawnej farmakoterapii pacjentów;
7) odsetek przypadków, w których w wyniku dokonanego przeglądu lekowego nastąpił znaczący spadek liczby problemów pacjenta związanych ze stosowaniem leków;
8) liczba i odsetek przypadków, w których lekarze zaakceptowali rekomendacje farmaceuty wynikające z dokonanego u pacjenta przeglądu lekowego;
9) liczba i odsetek przypadków, w których pacjenci zaakceptowali rekomendacje farmaceuty wynikające z dokonanego u nich przeglądu lekowego;
10) liczba i odsetek przypadków, w których pacjenci ocenili rekomendacje farmaceuty wynikające z dokonanego przeglądu lekowego jako zwiększające poziom ich wiedzy o przyjmowanych lekach lub zwiększające bezpieczeństwo przyjmowania tych leków;
11) liczba i odsetek pacjentów, którzy rozpoczęli i nie ukończyli pilotażu.
§ 14. [Pomiar wskaźników realizacji projektu]
2. Pomiar, o którym mowa w ust. 1, polega na zliczeniu danych dotyczących poszczególnych wskaźników wymienionych w § 13 i wyrażeniu ich - w zależności od przypadku - w sposób liczbowy, procentowy albo łącznie liczbowy i procentowy.
§ 15. [Finansowanie pilotażu]
2. Maksymalny koszt pilotażu wynosi 150 000 zł.
3. Koszt realizacji przez podmiot leczniczy zadań określonych w rozporządzeniu, w tym wynagrodzenia wskazanych przez ten podmiot koordynatorów, o których mowa w § 12, nie może przekroczyć 50 000 zł.
4. Dla celów finansowania i rozliczania wykonanych w ramach pilotażu przeglądów lekowych stosuje się ryczałt, który stanowi iloczyn liczby pacjentów objętych pilotażem oraz stawki w wysokości 100 zł za pacjenta należnej farmaceucie, który przeprowadził przegląd lekowy zgodnie z wymaganiami określonymi w § 10, przekazywanej mu przez realizatora pilotażu, u którego ten farmaceuta jest zatrudniony, po otrzymaniu środków na ten cel zgodnie z ust. 5.
5. Po zakończeniu etapu organizacji pilotażu minister właściwy do spraw zdrowia przekazuje środki, o których mowa w ust. 2, z przeznaczeniem na sfinansowanie działań określonych w ust. 3 i 4, do Funduszu w ramach dotacji celowej.
6. Na podstawie umowy pomiędzy Funduszem a podmiotem leczniczym Fundusz przekazuje środki, o których mowa w ust. 5, do podmiotu leczniczego, który dzieli te środki pomiędzy realizatorów pilotażu. W umowie określa się wysokość kosztów podmiotu leczniczego z uwzględnieniem działań podejmowanych przez podmiot leczniczy w ramach pilotażu, w tym jego koordynacji.
§ 16. [Podmiot obowiązany do wdrożenia, monitorowania i ewaluacji pilotażu]
2. Fundusz przedstawia ministrowi właściwemu do spraw zdrowia raport zawierający wnioski wynikające z ewaluacji pilotażu, o których mowa w § 9 pkt 3, w terminie miesiąca od dnia jego zakończenia.
3. Raport, o którym mowa w ust. 2, jest publikowany w Biuletynie Informacji Publicznej na stronie podmiotowej Funduszu.
§ 17. [Wejście w życie]
Minister Zdrowia: A. Niedzielski
1) Minister Zdrowia kieruje działem administracji rządowej - zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 27 sierpnia 2020 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. z 2021 r. poz. 932).
2) Zmiany tekstu jednolitego wymienionej ustawy zostały ogłoszone w Dz. U. z 2021 r. poz. 1292, 1559, 1773, 1834, 1981, 2105, 2120, 2232 i 2270.
Załącznik do rozporządzenia Ministra Zdrowia
z dnia 2 grudnia 2021 r. (poz. 2342)
WZÓR - KARTA INDYWIDUALNEGO PLANU OPIEKI FARMACEUTYCZNEJ (IPOF)
- Data ogłoszenia: 2021-12-17
- Data wejścia w życie: 2022-01-01
- Data obowiązywania: 2022-05-10
- Dokument traci ważność: 2023-04-06
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
