REKLAMA
Dziennik Ustaw - rok 2021 poz. 523
OBWIESZCZENIE
MARSZAŁKA SEJMU RZECZYPOSPOLITEJ POLSKIEJ
z dnia 1 marca 2021 r.
w sprawie ogłoszenia jednolitego tekstu ustawy o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych
1. Na podstawie art. 16 ust. 1 zdanie pierwsze ustawy z dnia 20 lipca 2000 r. o ogłaszaniu aktów normatywnych i niektórych innych aktów prawnych (Dz. U. z 2019 r. poz. 1461) ogłasza się w załączniku do niniejszego obwieszczenia jednolity tekst ustawy z dnia 12 maja 2011 r. o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych (Dz. U. z 2020 r. poz. 357), z uwzględnieniem zmian wprowadzonych:
1) ustawą z dnia 16 kwietnia 2020 r. o zmianie ustawy o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych oraz niektórych innych ustaw (Dz. U. poz. 945),
2) ustawą z dnia 14 sierpnia 2020 r. o zmianie niektórych ustaw w celu zapewnienia funkcjonowania ochrony zdrowia w związku z epidemią COVID-19 oraz po jej ustaniu (Dz. U. poz. 1493),
3) ustawą z dnia 7 października 2020 r. o Funduszu Medycznym (Dz. U. poz. 1875),
4) ustawą z dnia 27 listopada 2020 r. o zmianie niektórych ustaw w celu zapewnienia w okresie ogłoszenia stanu zagrożenia epidemicznego lub stanu epidemii kadr medycznych (Dz. U. poz. 2401),
5) ustawą z dnia 21 stycznia 2021 r. o zmianie ustawy o szczególnych rozwiązaniach związanych z zapobieganiem, przeciwdziałaniem i zwalczaniem COVID-19, innych chorób zakaźnych oraz wywołanych nimi sytuacji kryzysowych oraz niektórych innych ustaw (Dz. U. poz. 159)
oraz zmian wynikających z przepisów ogłoszonych przed dniem 24 lutego 2021 r.
2. Podany w załączniku do niniejszego obwieszczenia jednolity tekst ustawy nie obejmuje:
1) art. 4, art. 5 i art. 7 ustawy z dnia 16 kwietnia 2020 r. o zmianie ustawy o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych oraz niektórych innych ustaw (Dz. U. poz. 945), które stanowią:
„Art. 4. 1. W latach 2020–2029 maksymalny limit wydatków budżetu państwa będących skutkiem finansowym niniejszej ustawy, w związku z realizacją zadania, o którym mowa w art. 43b ustawy zmienianej w art. 1, wynosi 336 314 tys. zł, z tym że w poszczególnych latach wyniesie odpowiednio:
1) w 2020 r. – 11 000 tys. zł;
2) w 2021 r. – 24 200 tys. zł;
3) w 2022 r. – 26 620 tys. zł;
4) w 2023 r. – 28 982 tys. zł;
5) w 2024 r. – 31 820 tys. zł;
6) w 2025 r. – 35 002 tys. zł;
7) w 2026 r. – 38 502 tys. zł;
8) w 2027 r. – 42 353 tys. zł;
9) w 2028 r. – 46 588 tys. zł;
10) w 2029 r. – 51 247 tys. zł.
2. Minister właściwy do spraw zdrowia monitoruje wykorzystanie rocznych limitów wydatków, o których mowa w ust. 1.
3. W przypadku gdy ze sprawozdań przekazywanych ministrowi właściwemu do spraw zdrowia przez Narodowy Fundusz Zdrowia na podstawie przepisów wydanych na podstawie art. 43b ust. 9 ustawy zmienianej w art. 1 będzie wynikać, że w pierwszym półroczu danego roku nastąpiło faktyczne przekroczenie 60% limitu wydatków przewidzianych na ten rok, minister właściwy do spraw zdrowia wdraża mechanizm korygujący polegający na ograniczeniu wykazu leków, o którym mowa w art. 37 ust. 1 ustawy zmienianej w art. 2, w zakresie leków, o których mowa w art. 37 ust. 2b ustawy zmienianej w art. 2.
4. Ograniczenie wykazu leków, o którym mowa w ust. 3, następuje w drugim półroczu danego roku, nie później jednak niż wraz z ogłoszeniem drugiego wykazu, o którym mowa w art. 43b ust. 6 ustawy zmienianej w art. 1, wydawanego w tym półroczu.
5. Minister właściwy do spraw zdrowia może wdrożyć mechanizm korygujący, o którym mowa w ust. 3, jeżeli z analizy danych uzyskanych w toku działań, o których mowa w ust. 2, będzie wynikać, że roczny limit wydatków przewidzianych na finansowanie bezpłatnego zaopatrzenia w leki świadczeniobiorców w okresie ciąży może zostać przekroczony.
Art. 5. Pierwszy wykaz, o którym mowa w art. 37 ust. 1 ustawy zmienianej w art. 2, uwzględniający leki, o których mowa w art. 37 ust. 2b tej ustawy, minister właściwy do spraw zdrowia ogłosi nie później niż w terminie 4 miesięcy od dnia wejścia w życie niniejszej ustawy, biorąc pod uwagę wytyczne określone w art. 43b ust. 6 ustawy zmienianej w art. 1.”
„Art. 7. Ustawa wchodzi w życie z dniem 1 lipca 2020 r.”;
2) art. 27 i art. 47 ustawy z dnia 14 sierpnia 2020 r. o zmianie niektórych ustaw w celu zapewnienia funkcjonowania ochrony zdrowia w związku z epidemią COVID-19 oraz po jej ustaniu (Dz. U. poz. 1493), które stanowią:
„Art. 27. 1. Do dnia 1 lipca 2021 r. lek lub środek spożywczy specjalnego przeznaczenia żywieniowego stosowany w ramach programu lekowego, dla którego nie wydano kolejnej decyzji o objęciu refundacją, a który jest dostępny na terytorium Rzeczypospolitej Polskiej, i nie ma żadnej alternatywnej refundowanej technologii lekowej, za zgodą ministra właściwego do spraw zdrowia wydaną na wniosek Prezesa Narodowego Funduszu Zdrowia, może być finansowany przez tego Prezesa na dotychczasowych warunkach wynikających z ostatniej decyzji o objęciu refundacją dotyczącej tego leku lub środka spożywczego specjalnego przeznaczenia żywieniowego, wyłącznie świadczeniobiorcom, którzy rozpoczęli proces leczenia w tym programie najpóźniej w ostatnim dniu obowiązywania tej decyzji, do ukończenia terapii, nie dłużej jednak niż przez okres roku od dnia zakończenia obowiązywania decyzji o objęciu refundacją leku lub środka spożywczego specjalnego przeznaczenia żywieniowego stosowanego w ramach programu lekowego.
2. W celu objęcia finansowaniem leku lub środka spożywczego specjalnego przeznaczenia żywieniowego, o którym mowa w ust. 1, podmiot odpowiedzialny, o którym mowa w ustawie zmienianej w art. 3, składa wniosek do Prezesa Narodowego Funduszu Zdrowia.
3. Wniosek, o którym mowa w ust. 2, podmiot odpowiedzialny składa najpóźniej w terminie 14 dni od dnia ogłoszenia pierwszego obwieszczenia, o którym mowa w art. 37 ust. 1 ustawy zmienianej w art. 11, wydanego po wygaśnięciu ostatniej decyzji, o której mowa w ust. 1. Wniosek ten zawiera:
1) oznaczenie (firmę) wnioskodawcy, adres siedziby albo miejsca wykonywania działalności gospodarczej, imię i nazwisko, telefon, telefaks, adres poczty elektronicznej i adres korespondencyjny osoby upoważnionej do jego reprezentowania w sprawie tego wniosku;
2) datę i numer ostatniej decyzji, o której mowa w ust. 1.
4. Do rozliczania świadczeń opieki zdrowotnej udzielonych zgodnie z ust. 1 stosuje się odpowiednio przepisy dotyczące programów lekowych.”
„Art. 47. Ustawa wchodzi w życie z dniem następującym po dniu ogłoszenia, z wyjątkiem:
1) art. 1 pkt 2 i 3, art. 3 pkt 10 i 11 oraz art. 10 pkt 12 lit. c, które wchodzą w życie z dniem następującym po dniu ogłoszenia z mocą od dnia 13 marca 2020 r.;
2) art. 21, który wchodzi w życie z dniem następującym po dniu ogłoszenia z mocą od dnia 1 kwietnia 2020 r.;
3) art. 9 pkt 3, który wchodzi w życie z dniem następującym po dniu ogłoszenia z mocą od dnia 31 maja 2020 r.;
4) art. 23, który wchodzi w życie z dniem ogłoszenia z mocą od dnia 18 lipca 2020 r.;
5) art. 42, który wchodzi w życie z dniem 5 września 2020 r.;
6) art. 4 pkt 58 lit. b, który wchodzi w życie po upływie 60 dni od dnia ogłoszenia;
7) art. 3 pkt 2, 3 i 7 lit. c, art. 4 pkt 32 lit. b, art. 6, art. 10 pkt 2 lit. a, b i c w zakresie art. 5 ust. 3b i pkt 11, art. 35, art. 36 oraz załączniki nr 1 i 2 do ustawy, które wchodzą w życie po upływie czterech miesięcy od dnia ogłoszenia;
8) art. 4 pkt 4, 10 i 56 lit. a w zakresie art. 118 ust. 2 pkt 1 lit. e tiret trzecie, które wchodzą w życie z dniem 1 stycznia 2022 r.”;
3) art. 39 i art. 42 ustawy z dnia 7 października 2020 r. o Funduszu Medycznym (Dz. U. poz. 1875), które stanowią:
„Art. 39. 1. Przygotowanie przez Agencję Oceny Technologii Medycznych i Taryfikacji pierwszego wykazu technologii lekowych o wysokim poziomie innowacyjności, o którym mowa w art. 40a ust. 2 ustawy zmienianej w art. 36, i przedstawienie go ministrowi właściwemu do spraw zdrowia nastąpi nie później niż w terminie 3 miesięcy od dnia wejścia w życie niniejszej ustawy.
2. Pierwszy wykaz, o którym mowa w ust. 1, zawiera leki dopuszczone do obrotu w procedurze centralnej w Unii Europejskiej, o których mowa w art. 3 ust. 2 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne (Dz. U. z 2020 r. poz. 944 i 1493), od dnia 1 stycznia 2020 r.
3. Agencja Oceny Technologii Medycznych i Taryfikacji przygotuje wykaz technologii lekowych o wysokiej wartości klinicznej, o którym mowa w art. 40a ust. 8 ustawy zmienianej w art. 36, i przedstawi go ministrowi właściwemu do spraw zdrowia, w terminie 9 miesięcy od dnia wejścia w życie niniejszej ustawy.
4. Wykaz, o którym mowa w ust. 3, zawiera leki dopuszczone do obrotu w procedurze centralnej w Unii Europejskiej, o których mowa w art. 3 ust. 2 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne, od dnia 1 stycznia 2017 r.”
„Art. 42. Ustawa wchodzi w życie po upływie 30 dni od dnia ogłoszenia.”;
4) art. 26 i art. 28–31 ustawy z dnia 27 listopada 2020 r. o zmianie niektórych ustaw w celu zapewnienia w okresie ogłoszenia stanu zagrożenia epidemicznego lub stanu epidemii kadr medycznych (Dz. U. poz. 2401), które stanowią:
„Art. 26. Minister właściwy do spraw zdrowia podaje do publicznej wiadomości, nie później niż w okresie 6 miesięcy od dnia wejścia w życie niniejszej ustawy, ogłaszając na stronie podmiotowej Biuletynu Informacji Publicznej obsługującego go urzędu oraz w dzienniku urzędowym ministra właściwego do spraw zdrowia, informacje o uruchomieniu funkcjonalności wystawiania i realizacji zlecenia, o którym mowa w art. 38 ust. 4a ustawy zmienianej w art. 10, w brzmieniu nadanym niniejszą ustawą.”
„Art. 28. 1. Do dnia 30 czerwca 2021 r. zlecenia, o których mowa w art. 38 ust. 1 ustawy zmienianej w art. 10, są wystawiane, weryfikowane i realizowane na dotychczasowych zasadach.
2. Od dnia 1 lipca 2021 r. do dnia 31 grudnia 2021 r. zlecenia, o których mowa w art. 38 ust. 1 ustawy zmienianej w art. 10, mogą być wystawiane, weryfikowane i realizowane na dotychczasowych zasadach.
Art. 29. Do dnia 31 grudnia 2021 r. zlecenia, o których mowa w art. 38 ust. 4a ustawy zmienianej w art. 10, w brzmieniu nadanym niniejszą ustawą są podpisywane kwalifikowanym podpisem elektronicznym, podpisem zaufanym lub z wykorzystaniem sposobu potwierdzania pochodzenia oraz integralności danych dostępnego w systemie teleinformatycznym udostępnionym bezpłatnie przez Zakład Ubezpieczeń Społecznych.
Art. 30. Dotychczasowe przepisy wykonawcze wydane na podstawie art. 38 ust. 7 ustawy zmienianej w art. 10, zachowują moc do dnia wejścia w życie przepisów wykonawczych wydanych na podstawie art. 38 ust. 7 ustawy zmienianej w art. 10, w brzmieniu nadanym niniejszą ustawą, jednak nie dłużej niż do dnia 31 grudnia 2021 r.
Art. 31. Ustawa wchodzi w życie z dniem 30 grudnia 2020 r., z wyjątkiem:
1) art. 1–3, art. 5 pkt 1 i 2, art. 6–8, art. 11 i art. 12, które wchodzą w życie z dniem następującym po dniu ogłoszenia;
2) art. 9 pkt 5, który wchodzi w życie po upływie 7 dni od dnia ogłoszenia;
3) art. 9 pkt 1–4, art. 10 i art. 26–30, które wchodzą w życie z dniem 1 stycznia 2021 r.;
4) art. 13, który wchodzi w życie z dniem 1 stycznia 2022 r.”;
5) art. 43 ustawy z dnia 21 stycznia 2021 r. o zmianie ustawy o szczególnych rozwiązaniach związanych z zapobieganiem, przeciwdziałaniem i zwalczaniem COVID-19, innych chorób zakaźnych oraz wywołanych nimi sytuacji kryzysowych oraz niektórych innych ustaw (Dz. U. poz. 159), który stanowi:
„Art. 43. Ustawa wchodzi w życie z dniem następującym po dniu ogłoszenia, z wyjątkiem:
1) art. 30, który wchodzi w życie z dniem następującym po dniu ogłoszenia, z mocą od dnia 1 października 2020 r.;
2) art. 12 pkt 1 i art. 13 pkt 1 i 2, które wchodzą w życie z dniem następującym po dniu ogłoszenia, z mocą od dnia 27 grudnia 2020 r.;
3) art. 1 pkt 22–24, pkt 25 w zakresie art. 15zzzzl5 i pkt 27 oraz art. 9, art. 14, art. 21, art. 28 i art. 31, które wchodzą w życie z dniem następującym po dniu ogłoszenia, z mocą od dnia 1 stycznia 2021 r.;
4) art. 5, art. 8, art. 11, art. 16 oraz art. 36, które wchodzą w życie po upływie 14 dni od dnia ogłoszenia;
5) art. 19, który wchodzi w życie z dniem 1 marca 2021 r.”.
Marszałek Sejmu: E. Witek
Załącznik do obwieszczenia Marszałka Sejmu Rzeczypospolitej Polskiej
z dnia 1 marca 2021 r. (poz. 523)
USTAWA
z dnia 12 maja 2011 r.
o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych1)
Rozdział 1
Przepisy ogólne
Art. 1. Ustawa określa:
1) zasady, warunki i tryb podejmowania decyzji administracyjnej o objęciu refundacją leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego i uchylenia tej decyzji;
2) zasady finansowania leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego objętych decyzją, o której mowa w pkt 1;
3) kryteria tworzenia poziomów odpłatności i grup limitowych leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych objętych decyzją, o której mowa w pkt 1;
4) zasady i tryb oraz kryteria ustalania urzędowych cen zbytu na leki, środki spożywcze specjalnego przeznaczenia żywieniowego, wyroby medyczne, a także wysokość urzędowych marż hurtowych i urzędowych marż detalicznych;
5) zasady ustalania cen leków oraz środków spożywczych specjalnego przeznaczenia żywieniowego stosowanych w ramach udzielania świadczeń gwarantowanych;
6) zasady finansowania ze środków publicznych wyrobów medycznych przysługujących świadczeniobiorcom na zlecenie osoby uprawnionej;
7) obowiązki aptek wynikające z obrotu lekami, środkami spożywczymi specjalnego przeznaczenia żywieniowego, wyrobami medycznymi, objętymi decyzją, o której mowa w pkt 1, a także zasady kontroli aptek;
8) obowiązki osób uprawnionych do wystawiania recept na leki, środki spożywcze specjalnego przeznaczenia żywieniowego, wyroby medyczne, objęte decyzją, o której mowa w pkt 1.
Art. 2. Użyte w ustawie określenia oznaczają:
1) Agencja – Agencję Oceny Technologii Medycznych i Taryfikacji działającą na podstawie ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych (Dz. U. z 2020 r. poz. 1398, z późn. zm.2));
2) apteka – aptekę ogólnodostępną lub punkt apteczny w rozumieniu ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne (Dz. U. z 2020 r. poz. 944, 1493 i 2112 oraz z 2021 r. poz. 97);
3) całkowity budżet na refundację – wysokość środków publicznych przeznaczonych w planie finansowym Narodowego Funduszu Zdrowia, o którym mowa w art. 118 ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych, na refundowane leki, środki spożywcze specjalnego przeznaczenia żywieniowego, wyroby medyczne, o których mowa w art. 15 ust. 2 pkt 14, 16–18 oraz objęte programami lekowymi, o których mowa w art. 15 ust. 2 pkt 15 tej ustawy;
4) cena detaliczna – urzędową cenę zbytu leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego powiększoną o urzędową marżę hurtową i urzędową marżę detaliczną oraz należny podatek od towarów i usług;
5) cena hurtowa – urzędową cenę zbytu leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego powiększoną o urzędową marżę hurtową oraz należny podatek od towarów i usług;
6) cena zbytu netto – cenę sprzedaży leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego do podmiotów uprawnionych do obrotu, nieuwzględniającą należnego podatku od towarów i usług;
7) DDD – dobową dawkę leku ustaloną przez Światową Organizację Zdrowia;
8) Fundusz – Narodowy Fundusz Zdrowia w rozumieniu ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych;
9) grupa limitowa – grupę leków albo środków spożywczych specjalnego przeznaczenia żywieniowego albo wyrobów medycznych objętych wspólnym limitem finansowania;
10) lek – produkt leczniczy w rozumieniu ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne;
11) lek recepturowy – lek sporządzony w aptece na podstawie recepty lekarskiej;
12) nazwa międzynarodowa leku – nazwę leku zalecaną przez Światową Organizację Zdrowia;
13) odpowiednik – w przypadku:
a) leku – lek zawierający tę samą substancję czynną oraz mający te same wskazania i tę samą drogę podania przy braku różnic postaci farmaceutycznej,
b) środka spożywczego specjalnego przeznaczenia żywieniowego – środek spożywczy specjalnego przeznaczenia żywieniowego mający ten sam albo zbliżony skład, zastosowanie lub sposób przygotowania,
c) wyrobu medycznego – wyrób medyczny mający takie samo przewidziane zastosowanie oraz właściwości;
14) osoba uprawniona – osobę posiadającą prawo wykonywania zawodu medycznego, która na podstawie przepisów dotyczących wykonywania danego zawodu medycznego, jest uprawniona do wystawiania recept zgodnie z ustawą oraz ustawą z dnia 6 września 2001 r. – Prawo farmaceutyczne oraz zleceń na zaopatrzenie w wyroby medyczne, o których mowa w art. 38;
15) podmiot działający na rynku spożywczym – podmiot działający na rynku spożywczym w rozumieniu art. 3 pkt 3 rozporządzenia (WE) nr 178/2002 Parlamentu Europejskiego i Rady z dnia 28 stycznia 2002 r. ustanawiającego ogólne zasady i wymagania prawa żywnościowego, powołującego Europejski Urząd do Spraw Bezpieczeństwa Żywności oraz ustanawiającego procedury w sprawie bezpieczeństwa żywności (Dz. Urz. UE L 179 z 07.07.2007, str. 59);
16) podmiot odpowiedzialny – podmiot odpowiedzialny w rozumieniu ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne;
17) podmiot zobowiązany do finansowania świadczeń ze środków publicznych – podmiot zobowiązany do finansowania świadczeń opieki zdrowotnej ze środków publicznych w rozumieniu przepisów ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych;
18) program lekowy – program zdrowotny w rozumieniu art. 5 pkt 30 ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych obejmujący technologię lekową, w której substancja czynna w danym wskazaniu oraz dla danej populacji nie jest składową kosztową innych świadczeń gwarantowanych, lub środek spożywczy specjalnego przeznaczenia żywieniowego, który nie jest składową kosztową innych świadczeń gwarantowanych w rozumieniu art. 5 pkt 35 tej ustawy;
19) przedsiębiorca – przedsiębiorcę w rozumieniu przepisów ustawy z dnia 6 marca 2018 r. – Prawo przedsiębiorców (Dz. U. z 2021 r. poz. 162);
20) Rada Przejrzystości – Radę Przejrzystości działającą na podstawie ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych;
20a)3) system informacji w ochronie zdrowia – system, o którym mowa w ustawie z dnia 28 kwietnia 2011 r. o systemie informacji w ochronie zdrowia (Dz. U. z 2020 r. poz. 702, z późn. zm.4));
21) środek spożywczy specjalnego przeznaczenia żywieniowego – środek spożywczy, o którym mowa w art. 24 ust. 2 pkt 1 i 4 ustawy z dnia 25 sierpnia 2006 r. o bezpieczeństwie żywności i żywienia (Dz. U. z 2020 r. poz. 2021) przeznaczony do dietetycznego odżywiania pacjentów pod nadzorem lekarza, którego stosowania nie można uniknąć przez modyfikację normalnej diety lub podawanie innych środków spożywczych specjalnego przeznaczenia żywieniowego;
22) świadczenie gwarantowane – świadczenie gwarantowane w rozumieniu ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych;
23) świadczeniobiorca – świadczeniobiorcę w rozumieniu ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych;
24) świadczeniodawca – świadczeniodawcę w rozumieniu ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych;
24a)5) technologia lekowa o wysokiej wartości klinicznej – technologię lekową, która uzyskała pozwolenie na dopuszczenie do obrotu wydane przez Radę Unii Europejskiej lub Komisję Europejską od dnia 1 stycznia 2017 r., i która spełnia łącznie następujące warunki:
a) do dnia wydania decyzji o objęciu refundacją nie była finansowana ze środków publicznych,
b) została umieszczona w wykazie technologii lekowych o wysokiej wartości klinicznej, o którym mowa w art. 40a ust. 8;
24b)5) technologia lekowa o wysokim poziomie innowacyjności – technologię lekową stosowaną w onkologii lub chorobach rzadkich, która uzyskała pozwolenie na dopuszczenie do obrotu wydane przez Radę Unii Europejskiej lub Komisję Europejską i która została umieszczona w wykazie technologii lekowych o wysokim poziomie innowacyjności, o którym mowa w art. 40a ust. 2;
25) technologia lekowa – technologię medyczną w rozumieniu ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych, której główną składową kosztową jest lek;
25a) uprawnienia dodatkowe – uprawnienia wynikające z przepisów odrębnych ustaw oraz przepisów wydanych na podstawie art. 38 ust. 4, mające wpływ na wysokość udziału środków publicznych w cenie wyrobu medycznego;
26) urzędowa cena zbytu – cenę zbytu leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego ustaloną w decyzji administracyjnej o objęciu refundacją, uwzględniającą należny podatek od towarów i usług;
27) wnioskodawca – podmiot odpowiedzialny, przedstawiciela podmiotu odpowiedzialnego, podmiot uprawniony do importu równoległego w rozumieniu ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne, wytwórcę wyrobów medycznych, jego autoryzowanego przedstawiciela, dystrybutora albo importera, w rozumieniu ustawy z dnia 20 maja 2010 r. o wyrobach medycznych (Dz. U. z 2020 r. poz. 186 i 1493 oraz z 2021 r. poz. 255), a także podmiot działający na rynku spożywczym;
28) wyrób medyczny – wyrób medyczny, wyposażenie wyrobu medycznego, wyrób medyczny do diagnostyki in vitro, wyposażenie wyrobu medycznego do diagnostyki in vitro, o których mowa w art. 2 ust. 1 pkt 33, 34, 38 i 39 ustawy z dnia 20 maja 2010 r. o wyrobach medycznych;
29) wytwórca wyrobu medycznego – wytwórcę w rozumieniu ustawy z dnia 20 maja 2010 r. o wyrobach medycznych.
Art. 3. 1. Całkowity budżet na refundację wynosi nie więcej niż 17% sumy środków publicznych przeznaczonych na finansowanie świadczeń gwarantowanych w planie finansowym Funduszu.
2. Kwotę środków finansowych stanowiącą wzrost całkowitego budżetu na refundację w roku rozliczeniowym w stosunku do całkowitego budżetu na refundację w roku poprzedzającym przeznacza się na:
1) finansowanie:
a) dotychczas nieobjętych refundacją leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych, które nie mają swojego odpowiednika refundowanego w danym wskazaniu, z zakresu, o którym mowa w art. 15 ust. 2 pkt 14–16 ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych, zwanej dalej „ustawą o świadczeniach”, wobec których została wydana decyzja administracyjna o objęciu refundacją,
b) przewidywanego wzrostu refundacji w wybranych grupach limitowych wynikającego ze zmian w Charakterystyce Produktu Leczniczego lub ze zmian praktyki klinicznej;
2) refundację, w części dotyczącej finansowania świadczeń, o których mowa w art. 15 ust. 2 pkt 14 ustawy o świadczeniach.
3. Kwota środków finansowych, o której mowa w ust. 2 pkt 1, stanowi rezerwę.
4. Minister właściwy do spraw zdrowia określi, w drodze rozporządzenia, podział kwoty środków finansowych, o której mowa w ust. 2, uwzględniając realizację refundacji, a także liczbę i rodzaj złożonych wniosków, o których mowa w art. 24 ust. 1.
Art. 4. 1. W przypadku gdy w trakcie realizacji planu finansowego Funduszu dojdzie do przekroczenia całkowitego budżetu na refundację, w części dotyczącej finansowania świadczeń, o których mowa w art. 15 ust. 2 pkt 14 ustawy o świadczeniach, wyznacza się kwotę przekroczenia dla danej grupy limitowej. Wnioskodawca, który uzyskał decyzję administracyjną o objęciu refundacją, zwraca do Funduszu kwotę proporcjonalną do udziału kosztów refundacji leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego objętego tą decyzją, w tym przekroczeniu, w danej grupie limitowej.
2. Kwotę przekroczenia w danej grupie limitowej oblicza się według wzoru:
KP = Wr' – Wr
gdzie poszczególne symbole oznaczają:
KP – kwotę przekroczenia,
Wr' – kwotę refundacji w roku rozliczeniowym w danej grupie limitowej,
Wr – planowaną kwotę refundacji w danej grupie limitowej, wyliczoną jako iloczyn planowanej kwoty refundacji w tej grupie w roku poprzedzającym i współczynnika wzrostu stanowiącego iloraz całkowitego budżetu na refundację w roku rozliczeniowym pomniejszonego o rezerwę, o której mowa w art. 3 ust. 3, i całkowitego budżetu na refundację w roku poprzedzającym.
3. Udział w zwrocie kwoty przekroczenia w danej grupie limitowej biorą jedynie ci wnioskodawcy, którzy otrzymali decyzję administracyjną o objęciu refundacją, dla których dynamika poziomu refundacji leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego w danej grupie limitowej, w roku rozliczeniowym względem roku poprzedzającego, jest równa albo większa od 1, zgodnie z poniższym wzorem:
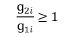
gdzie poszczególne symbole oznaczają:
g1i – kwotę refundacji na koniec roku poprzedzającego dla produktu i-tego wnioskodawcy, który otrzymał decyzję administracyjną o objęciu refundacją w danej grupie limitowej,
g2i – kwotę refundacji na koniec roku rozliczeniowego dla produktu i-tego wnioskodawcy, który otrzymał decyzję administracyjną o objęciu refundacją w danej grupie limitowej.
4. W przypadku wnioskodawcy, który otrzymał decyzję administracyjną o objęciu refundacją, a który nie uzyskiwał przychodów z tytułu refundacji w danej grupie limitowej w roku poprzedzającym, współczynnik dynamiki poziomu refundacji w danej grupie limitowej przyjmuje wartość 1.
5. Udział w kwocie przekroczenia jest proporcjonalny do udziału kwoty refundacji leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, w sumarycznej kwocie refundacji produktów w danej grupie limitowej, o których mowa w ust. 3. Udział w kwocie przekroczenia jest korygowany o iloraz urzędowej ceny zbytu za DDD leku wnioskodawcy, który otrzymał decyzję administracyjną o objęciu refundacją, na koniec roku rozliczeniowego i najniższej urzędowej ceny zbytu za DDD leku stanowiącego podstawę limitu w danej grupie limitowej w roku rozliczeniowym. Unormowany współczynnik udziału w kwocie przekroczenia w danej grupie limitowej dla produktu refundowanego danego wnioskodawcy, który otrzymał decyzję administracyjną o objęciu refundacją, wyliczany jest według wzoru:
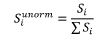
gdzie:
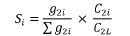
gdzie poszczególne symbole oznaczają:
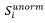
Si – współczynnik udziału w kwocie przekroczenia dla produktu i-tego wnioskodawcy, który otrzymał decyzję o objęciu refundacją w danej grupie limitowej,
g2i – kwotę refundacji na koniec roku rozliczeniowego dla produktu i-tego wnioskodawcy, który otrzymał decyzję o objęciu refundacją w danej grupie limitowej,
Σg2i – sumaryczną kwotę refundacji na koniec roku rozliczeniowego produktów wszystkich wnioskodawców, którzy otrzymali decyzję administracyjną o objęciu refundacją w danej grupie limitowej,
C2i – urzędową cenę zbytu za DDD leku i-tego wnioskodawcy, który otrzymał decyzję administracyjną o objęciu refundacją w danej grupie limitowej na koniec roku rozliczeniowego,
C2L – najniższą urzędową cenę zbytu za DDD leku stanowiącego podstawę limitu w danej grupie limitowej w roku rozliczeniowym.
6. Przepis ust. 5 stosuje się odpowiednio do środka spożywczego specjalnego przeznaczenia żywieniowego i wyrobu medycznego oraz leku, w odniesieniu do którego nie określono DDD.
7. Wnioskodawca, który otrzymał decyzję administracyjną o objęciu refundacją, biorący udział w zwrocie kwoty przekroczenia, zwraca Funduszowi kwotę odpowiednio dla danej grupy limitowej, w wysokości wyliczanej według wzoru:
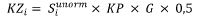
gdzie poszczególne symbole oznaczają:
KZi – kwotę zwracaną przez i-tego wnioskodawcę, który otrzymał decyzję administracyjną o objęciu refundacją w danej grupie limitowej,
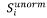
KP – kwotę przekroczenia w danej grupie limitowej,
G – współczynnik korygujący stanowiący iloraz różnicy poniesionych wydatków na refundację leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych w części dotyczącej finansowania świadczeń, o których mowa w art. 15 ust. 2 pkt 14 ustawy o świadczeniach, w danym roku rozliczeniowym i całkowitego budżetu na refundację w tej części w tym roku oraz sumy kwot przekroczenia w grupach limitowych.
8. Kwotę przekroczenia oraz kwotę zwrotu oblicza Fundusz w terminie 30 dni od zatwierdzenia sprawozdania finansowego Funduszu za rok poprzedni na podstawie danych, o których mowa w art. 45 ust. 1.
9. Zestawienie kwot zwrotu w odniesieniu do poszczególnych grup limitowych dla każdego produktu objętego refundacją, obliczonych w sposób określony w ust. 7, Prezes Funduszu niezwłocznie przekazuje ministrowi właściwemu do spraw zdrowia.
10. Kwotę zwrotu ustala w drodze decyzji administracyjnej minister właściwy do spraw zdrowia i podlega ona uiszczeniu w terminie 30 dni od dnia, w którym decyzja stała się ostateczna.
11. Przepisów ust. 1–10 nie stosuje się w przypadku ustalenia w decyzji administracyjnej o objęciu refundacją leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, instrumentów dzielenia ryzyka, o których mowa w art. 11 ust. 5.
Art. 5. W przypadku, gdy lek zawiera więcej niż jedną substancję czynną za podstawę obliczeń, o których mowa w art. 4, 6, 7, 9 i art. 13–15, przyjmuje się cenę DDD lub liczbę DDD substancji czynnej zawartej w tym leku o najwyższym koszcie DDD.
Rozdział 2
Poziomy odpłatności i marże refundowanych leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych
Art. 6. 1. Ustala się kategorię dostępności refundacyjnej:
1) lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny dostępny w aptece na receptę:
a) w całym zakresie zarejestrowanych wskazań i przeznaczeń,
b) we wskazaniu określonym stanem klinicznym;
2) lek, środek spożywczy specjalnego przeznaczenia żywieniowego stosowany w ramach programu lekowego;
3) lek stosowany w ramach chemioterapii:
a) w całym zakresie zarejestrowanych wskazań i przeznaczeń,
b) we wskazaniu określonym stanem klinicznym;
4) lek, środek spożywczy specjalnego przeznaczenia żywieniowego stosowany w ramach udzielania świadczeń gwarantowanych, innych niż wymienione w pkt 1–3.
2. Lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny, dla którego wydana została decyzja administracyjna o objęciu refundacją w zakresie nadanej kategorii dostępności refundacyjnej, o której mowa w ust. 1 pkt 1, jest wydawany świadczeniobiorcy:
1) bezpłatnie,
2) za odpłatnością ryczałtową,
3) za odpłatnością w wysokości 30% albo 50% ich limitu finansowania
– do wysokości limitu finansowania i za dopłatą w wysokości różnicy między ceną detaliczną a wysokością limitu finansowania.
3. Odpłatności, o których mowa w ust. 2, dotyczą jednostkowego opakowania leku, środka spożywczego specjalnego przeznaczenia żywieniowego oraz jednostkowego wyrobu medycznego, z tym że odpłatność, o której mowa w ust. 2 pkt 2, dotyczy jednostkowego opakowania leku zawierającego nie więcej niż 30 DDD, a w przypadku większej liczby DDD w opakowaniu odpłatność ta zwiększana jest proporcjonalnie do ilorazu liczby DDD w opakowaniu i 30 DDD.
4. W przypadku leku, dla którego DDD nie zostało określone, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego odpłatność, o której mowa w ust. 2 pkt 2, dotyczy jednostkowego opakowania leku albo środka spożywczego specjalnego przeznaczenia żywieniowego, albo liczby jednostkowych wyrobów medycznych, albo liczby jednostek wyrobu medycznego wystarczających na miesięczną terapię lub stosowanie. Zasady zwiększania odpłatności, o której mowa w ust. 2 pkt 2, określone w ust. 3 stosuje się odpowiednio.
5. Leki recepturowe przygotowane z surowców farmaceutycznych lub z leków gotowych, dla których została wydana decyzja administracyjna o objęciu refundacją, są wydawane świadczeniobiorcy za odpłatnością ryczałtową, pod warunkiem, że przepisana dawka leku recepturowego jest mniejsza od najmniejszej dawki leku gotowego w formie stałej stosowanej doustnie.
5a. Przepisu ust. 5 nie stosuje się do leków recepturowych przygotowanych z surowców farmaceutycznych, które uzyskały pozwolenie na dopuszczenie do obrotu na podstawie art. 33a ust. 1 ustawy z dnia 29 lipca 2005 r. o przeciwdziałaniu narkomanii (Dz. U. z 2020 r. poz. 2050).
6. Odpłatność ryczałtowa, o której mowa w ust. 2 pkt 2, wynosi 3,20 zł.
7. Odpłatność ryczałtowa, o której mowa w ust. 5, wynosi 0,50% wysokości minimalnego wynagrodzenia za pracę ogłaszanego w obwieszczeniu Prezesa Rady Ministrów wydanym na podstawie art. 2 ust. 4 ustawy z dnia 10 października 2002 r. o minimalnym wynagrodzeniu za pracę (Dz. U. z 2020 r. poz. 2207), z zaokrągleniem do pierwszego miejsca po przecinku.
8. Lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny, dla którego wydana została decyzja administracyjna o objęciu refundacją w zakresie nadanej kategorii dostępności refundacyjnej, o której mowa w ust. 1 pkt 2 i 3, jest wydawany świadczeniobiorcy bezpłatnie.
9. Apteka zobowiązana jest stosować odpłatność wynikającą z ustawy.
10. Minister właściwy do spraw zdrowia określi, w drodze rozporządzenia:
1) wykaz leków, które mogą być traktowane jako surowce farmaceutyczne przy sporządzaniu leków recepturowych,
2) ilość leku recepturowego, którego dotyczy odpłatność ryczałtowa, oraz sposób obliczania kosztu sporządzania leku recepturowego
– biorąc pod uwagę dostępność do leków, bezpieczeństwo ich stosowania oraz postać farmaceutyczną.
Art. 7. 1. Ustala się urzędową marżę hurtową w wysokości 5% urzędowej ceny zbytu.
2. Przedsiębiorcy prowadzący obrót hurtowy, w rozumieniu ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne, są obowiązani stosować marżę, o której mowa w ust. 1.
3. Marża, o której mowa w ust. 1, może być dzielona pomiędzy przedsiębiorców prowadzących obrót hurtowy.
4. Ustala się urzędową marżę detaliczną naliczaną od ceny hurtowej leku, środka spożywczego specjalnego przeznaczenia żywieniowego albo wyrobu medycznego stanowiącego podstawę limitu w danej grupie limitowej, w wysokości:
| od | do | zasada marży |
| – | 5,00 zł | 40% |
| 5,01 zł | 10,00 zł | 2 zł + 30% × (x – 5,00 zł) |
| 10,01 zł | 20,00 zł | 3,50 zł + 20% × (x – 10,00 zł) |
| 20,01 zł | 40,00 zł | 5,50 zł + 15% × (x – 20,00 zł) |
| 40,01 zł | 80,00 zł | 8,50 zł + 10% × (x – 40,00 zł) |
| 80,01 zł | 160,00 zł | 12,50 zł + 5% × (x – 80,00 zł) |
| 160,01 zł | 320,00 zł | 16,50 zł + 2,5% × (x – 160,00 zł) |
| 320,01 zł | 640,00 zł | 20,50 zł + 2,5% × (x – 320,00 zł) |
| 640,01 zł | 1280,00 zł | 28,50 zł + 2,5% × (x – 640,00 zł) |
| 1280,01 zł |
| 44,50 zł + 1,25% × (x – 1280,00 zł) |
– gdzie x oznacza cenę hurtową leku, środka spożywczego specjalnego przeznaczenia żywieniowego albo wyrobu medycznego stanowiącego podstawę limitu, uwzględniającą liczbę DDD leku, jednostek środka spożywczego specjalnego przeznaczenia żywieniowego w opakowaniu albo liczbę jednostkowych wyrobów medycznych, albo liczbę jednostek wyrobu medycznego.
5. Podmioty uprawnione do obrotu detalicznego, w rozumieniu ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne, są obowiązane stosować marżę, o której mowa w ust. 4.
6. Dla leków wydawanych w trybie, o którym mowa w art. 46 ustawy o świadczeniach, dla których nie ustalono limitu finansowania, stosuje się urzędową marżę detaliczną, w wysokości określonej w ust. 4, liczoną od ceny hurtowej, i nie może być wyższa niż 20 zł.
7. Dla leków oraz środków spożywczych specjalnego przeznaczenia żywieniowego, wydawanych w trybie, o którym mowa w art. 39 ust. 1, ustala się marżę hurtową w wysokości 10%. Marża detaliczna wynosi 100% wartości urzędowej marży detalicznej ustalonej w ust. 4 dla danego przedziału ceny hurtowej.
8. Dla leków, o których mowa w art. 6 ust. 5, ustala się marżę detaliczną w wysokości 25% liczoną od kosztu jego sporządzenia.
Art. 8. Urzędowe ceny zbytu, a także urzędowe marże hurtowe i detaliczne, mają charakter cen i marż sztywnych.
Art. 9. 1. Świadczeniodawca w celu realizacji świadczeń gwarantowanych jest obowiązany nabywać leki, środki spożywcze specjalnego przeznaczenia żywieniowego, wyroby medyczne po cenie nie wyższej niż urzędowa cena zbytu powiększona o marżę nie wyższą niż urzędowa marża hurtowa, a w przypadku nabywania od podmiotu innego niż przedsiębiorca prowadzący obrót hurtowy w rozumieniu ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne – po cenie nie wyższej niż urzędowa cena zbytu.
2. Lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny, o którym mowa w art. 6 ust. 1 pkt 1–3, świadczeniodawca jest obowiązany nabywać po cenie nie wyższej niż urzędowa cena zbytu leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, stanowiącego podstawę limitu, uwzględniając liczbę DDD leku, jednostek środka spożywczego specjalnego przeznaczenia żywieniowego w opakowaniu albo liczbę jednostkowych wyrobów medycznych, albo liczbę jednostek wyrobu medycznego, powiększoną o marżę nie wyższą niż urzędowa marża hurtowa, a w przypadku nabywania od podmiotu innego niż przedsiębiorca prowadzący obrót hurtowy w rozumieniu ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne – po cenie nie wyższej niż urzędowa cena zbytu.
3. Dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego, o którym mowa w art. 6 ust. 1 pkt 4, urzędową cenę zbytu ustala się:
1) na wniosek;
2) z urzędu, w przypadku gdy stanowią one istotną składową kosztową świadczeń gwarantowanych.
4. Minister właściwy do spraw zdrowia, wszczynając postępowanie z urzędu, wzywa podmiot odpowiedzialny lub podmiot działający na rynku spożywczym do przedstawienia informacji określonych w art. 28 pkt 3–7.
5. Podmiot, o którym mowa w ust. 4, jest zobowiązany do przedstawienia informacji, o których mowa w art. 28 pkt 1–7, w terminie 60 dni od dnia doręczenia wezwania.
6. W przypadku nieprzedstawienia informacji, o których mowa w art. 28 pkt 3–7, minister właściwy do spraw zdrowia ustala urzędową cenę zbytu na podstawie kryteriów, o których mowa w art. 13 ust. 8.
7. W przypadku, o którym mowa w ust. 3 pkt 2, opłat, o których mowa w art. 32 ust. 1, nie pobiera się.
Rozdział 3
Kryteria tworzenia poziomów odpłatności i grup limitowych oraz kryteria podejmowania decyzji o objęciu refundacją i zasady ustalania urzędowej ceny zbytu
Art. 10. 1. Refundowany może być lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny, który spełnia następujące wymagania:
1) jest dopuszczony do obrotu lub pozostaje w obrocie w rozumieniu ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne, albo jest wprowadzony do obrotu i do używania w rozumieniu ustawy z dnia 20 maja 2010 r. o wyrobach medycznych, albo jest wprowadzony do obrotu w rozumieniu ustawy z dnia 25 sierpnia 2006 r. o bezpieczeństwie żywności i żywienia;
2) jest dostępny na rynku;
3) posiada numer GTIN zgodny z systemem GS1 lub inny kod jednoznacznie identyfikujący wyrób medyczny lub środek spożywczy specjalnego przeznaczenia żywieniowego.
2. Refundowany może być również:
1) lek nieposiadający pozwolenia na dopuszczenie do obrotu lub niedostępny w obrocie na terytorium Rzeczypospolitej Polskiej i sprowadzany z zagranicy na warunkach i w trybie określonych w art. 4 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne;
2) lek, o którym mowa w art. 40;
3) środek spożywczy specjalnego przeznaczenia żywieniowego, o którym mowa w art. 29a ustawy z dnia 25 sierpnia 2006 r. o bezpieczeństwie żywności i żywienia.
3. Refundowany nie może być:
1) lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny w stanach klinicznych, w których możliwe jest skuteczne zastąpienie tego leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego poprzez zmianę stylu życia pacjenta;
2) lek o kategorii dostępności Rp, który posiada swój odpowiednik o kategorii dostępności OTC, chyba że wymaga stosowania dłużej niż 30 dni w określonym stanie klinicznym;
3) lek, środek spożywczy specjalnego przeznaczenia żywieniowego, ujęty w wykazie określonym w przepisach wydanych na podstawie art. 39 ust. 5.
Art. 11. 1. Objęcie refundacją leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego następuje w drodze decyzji administracyjnej ministra właściwego do spraw zdrowia.
2. Decyzja, o której mowa w ust. 1, zawiera:
1) oznaczenie (firmę) wnioskodawcy, adres siedziby albo miejsca wykonywania działalności gospodarczej;
2) nazwę leku, środka spożywczego specjalnego przeznaczenia żywieniowego albo nazwę i zastosowanie wyrobu medycznego, oraz jego dane identyfikujące;
3) kategorię dostępności refundacyjnej, a w przypadku kategorii, o której mowa w art. 6 ust. 1 pkt 2 – opis programu lekowego stanowiący załącznik do decyzji;
4) poziom odpłatności;
5) urzędową cenę zbytu;
6) termin wejścia w życie decyzji oraz okres jej obowiązywania;
7) instrumenty dzielenia ryzyka, jeżeli zostały ustalone;
8) określenie grupy limitowej.
3. Decyzję, o której mowa w ust. 1, wydaje się na okres:
1) (uchylony)
2) 3 lat – dla leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych, dla których nieprzerwanie obowiązywała decyzja administracyjna o objęciu refundacją lub w stosunku do których decyzja dla odpowiednika refundowanego w ramach tej samej kategorii dostępności refundacyjnej i w tym samym wskazaniu obowiązywała nieprzerwanie, przez okres dłuższy niż 3 lata,
3) 2 lat – dla leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych, dla których nieprzerwanie obowiązywała decyzja administracyjna o objęciu refundacją lub w stosunku do których decyzja dla odpowiednika refundowanego w ramach tej samej kategorii dostępności refundacyjnej i w tym samym wskazaniu obowiązywała nieprzerwanie, przez okres krótszy niż 3 lata, albo dla których wydawana jest pierwsza decyzja administracyjna o objęciu refundacją
– przy czym okres obowiązywania decyzji nie może przekraczać terminu wygaśnięcia okresu wyłączności rynkowej.
4. Podwyższenie albo obniżenie urzędowej ceny zbytu następuje w drodze zmiany decyzji, o której mowa w ust. 1.
5. Instrumenty dzielenia ryzyka, o których mowa w ust. 2 pkt 7, mogą dotyczyć:
1) uzależnienia wielkości przychodu wnioskodawcy od uzyskiwanych efektów zdrowotnych;
2) uzależnienia wysokości urzędowej ceny zbytu od zapewnienia przez wnioskodawcę dostaw po obniżonej ustalonej w negocjacjach cenie leku, środka spożywczego specjalnego przeznaczenia żywieniowego oraz wyrobu medycznego;
3) uzależnienia wysokości urzędowej ceny zbytu od wielkości obrotu lekiem, środkiem spożywczym specjalnego przeznaczenia żywieniowego oraz wyrobem medycznym;
4) uzależnienia wysokości urzędowej ceny zbytu od zwrotu części uzyskanej refundacji podmiotowi zobowiązanemu do finansowania świadczeń ze środków publicznych;
5) ustalenia innych warunków refundacji mających wpływ na zwiększenie dostępności do świadczeń gwarantowanych lub obniżenie kosztów tych świadczeń.
6. Minister właściwy do spraw zdrowia, w drodze decyzji administracyjnej, ustala urzędową cenę zbytu leku, środka spożywczego specjalnego przeznaczenia żywieniowego, o którym mowa w art. 6 ust. 1 pkt 4.
7. Decyzja, o której mowa w ust. 6, zawiera:
1) oznaczenie (firmę) wnioskodawcy, adres siedziby albo miejsca wykonywania działalności gospodarczej;
2) nazwę leku, środka spożywczego specjalnego przeznaczenia żywieniowego oraz jego dane identyfikujące;
3) urzędową cenę zbytu.
8. Okres obowiązywania decyzji, o której mowa w ust. 6, wynosi 3 lata.
9. Decyzja, o której mowa w ust. 6, wygasa w dniu umieszczenia leku, środka specjalnego przeznaczenia żywieniowego w obwieszczeniu, o którym mowa w art. 37. Wygaśnięcie stwierdza minister do spraw zdrowia w drodze decyzji.
10. Skrócenie okresu obowiązywania decyzji, o którym mowa w ust. 3 albo ust. 8, następuje w drodze decyzji ministra właściwego do spraw zdrowia.
11. Minister właściwy do spraw zdrowia odmawia wydania decyzji, o której mowa w ust. 10, jeżeli:
1) jej wydanie spowodowałoby:
a) istotne ograniczenie dostępności świadczeniobiorców do leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych,
b) znaczny wzrost odpłatności lub dopłat świadczeniobiorców;
2) urzędowa cena zbytu leku, środka spożywczego specjalnego przeznaczenia żywieniowego, o którym mowa w art. 6 ust. 1 pkt 4, została ustalona z urzędu.
Art. 12. Minister właściwy do spraw zdrowia, mając na uwadze uzyskanie jak największych efektów zdrowotnych w ramach dostępnych środków publicznych, wydaje decyzję administracyjną o objęciu refundacją i ustaleniu urzędowej ceny zbytu, przy uwzględnieniu następujących kryteriów:
1) stanowiska Komisji Ekonomicznej, o której mowa w art. 17,
2) rekomendacji Prezesa Agencji, o której mowa w art. 35 ust. 6,
3) istotności stanu klinicznego, którego dotyczy wniosek o objęcie refundacją,
4) skuteczności klinicznej i praktycznej,
5) bezpieczeństwa stosowania,
6) relacji korzyści zdrowotnych do ryzyka stosowania,
7) stosunku kosztów do uzyskiwanych efektów zdrowotnych dotychczas refundowanych leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych, w porównaniu z wnioskowanym,
8) konkurencyjności cenowej,
9) wpływu na wydatki podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych i świadczeniobiorców,
10) istnienia alternatywnej technologii medycznej, w rozumieniu ustawy o świadczeniach, oraz jej efektywności klinicznej i bezpieczeństwa stosowania,
11) wiarygodności i precyzji oszacowań kryteriów, o których mowa w pkt 3–10,
12) priorytetów zdrowotnych określonych w przepisach wydanych na podstawie art. 31a ust. 2 ustawy o świadczeniach,
13) wysokości progu kosztu uzyskania dodatkowego roku życia skorygowanego o jakość, ustalonego w wysokości trzykrotności Produktu Krajowego Brutto na jednego mieszkańca, o którym mowa w art. 6 ust. 1 ustawy z dnia 26 października 2000 r. o sposobie obliczania wartości rocznego produktu krajowego brutto (Dz. U. z 2021 r. poz. 151), a w przypadku braku możliwości wyznaczenia tego kosztu – koszt uzyskania dodatkowego roku życia
– biorąc pod uwagę inne możliwe do zastosowania w danym stanie klinicznym procedury medyczne, które mogą być zastąpione przez wnioskowany lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny.
Art. 13. 1. Minister właściwy do spraw zdrowia ustala urzędową cenę zbytu leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, dla którego żaden odpowiednik nie jest refundowany w danym wskazaniu, przy uwzględnieniu następujących kryteriów:
1) stanowiska Komisji Ekonomicznej, o której mowa w art. 17,
2) rekomendacji Prezesa Agencji, o której mowa w art. 35 ust. 6, w szczególności wyników analizy stosunku kosztów do uzyskanych efektów zdrowotnych,
3) konkurencyjności cenowej
– biorąc pod uwagę równoważenie interesów świadczeniobiorców i przedsiębiorców zajmujących się wytwarzaniem lub obrotem lekami, środkami spożywczymi specjalnego przeznaczenia żywieniowego, wyrobami medycznymi, możliwości płatnicze podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych oraz działalność naukowo-badawczą i inwestycyjną wnioskodawcy w zakresie związanym z ochroną zdrowia na terytorium Rzeczypospolitej Polskiej oraz w innych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA).
2. W pierwszej decyzji administracyjnej wydanej po zaistnieniu okoliczności, o których mowa w art. 11 ust. 3, urzędowa cena zbytu nie może być wyższa niż 75% urzędowej ceny zbytu określonej w poprzedniej decyzji administracyjnej o objęciu refundacją.
3. Jeżeli analiza kliniczna, o której mowa w art. 25 pkt 14 lit. c tiret pierwsze, nie zawiera randomizowanych badań klinicznych, dowodzących wyższości leku nad technologiami medycznymi, w rozumieniu ustawy o świadczeniach, dotychczas refundowanymi w danym wskazaniu, to urzędowa cena zbytu leku musi być skalkulowana w taki sposób, aby koszt stosowania leku wnioskowanego do objęcia refundacją nie był wyższy niż koszt technologii medycznej, w rozumieniu ustawy o świadczeniach, dotychczas finansowanej ze środków publicznych, o najkorzystniejszym współczynniku uzyskiwanych efektów zdrowotnych do kosztów ich uzyskania.
4. Urzędowa cena zbytu dla leku, w sytuacji, o której mowa w ust. 3, ustalona zostaje w decyzji administracyjnej o objęciu refundacją wyłącznie w ten sposób, aby koszt stosowania leku wnioskowanego do objęcia refundacją nie był wyższy niż koszt technologii medycznej, w rozumieniu ustawy o świadczeniach, dotychczas finansowanej ze środków publicznych, o najkorzystniejszym współczynniku uzyskiwanych efektów zdrowotnych do kosztów ich uzyskania.
5. Minister właściwy do spraw zdrowia ustala urzędową cenę zbytu leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, dla którego co najmniej jeden odpowiednik jest refundowany w danym wskazaniu, przy uwzględnieniu kryteriów, o których mowa w ust. 1, biorąc pod uwagę równoważenie interesów świadczeniobiorców i przedsiębiorców zajmujących się wytwarzaniem lub obrotem lekami, środkami spożywczymi specjalnego przeznaczenia żywieniowego oraz wyrobami medycznymi, możliwości płatnicze podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych oraz działalność naukowo-badawczą i inwestycyjną wnioskodawcy w zakresie związanym z ochroną zdrowia na terytorium Rzeczypospolitej Polskiej oraz w innych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA).
6. Urzędowa cena zbytu, o której mowa w ust. 5, z uwzględnieniem liczby DDD w opakowaniu jednostkowym, nie może być wyższa niż:
1) 75% urzędowej ceny zbytu jedynego odpowiednika refundowanego w danym wskazaniu;
2) urzędowa cena zbytu:
a) odpowiednika wyznaczającego podstawę limitu albo
b) najtańszego odpowiednika o ile podstawę limitu w danej grupie limitowej wyznacza lek z inną substancją czynną
– w przypadku kolejnego odpowiednika refundowanego w danym wskazaniu.
6a.6) Urzędowa cena zbytu ustalona w decyzji, o której mowa w art. 11 ust. 1, nie może być wyższa niż urzędowa cena zbytu leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, obowiązująca w dniu złożenia wniosku, o którym mowa w art. 24 ust. 1 pkt 1, 1a lub 1b, w odniesieniu do leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, który w dniu złożenia tego wniosku był zawarty w wykazie, o którym mowa w art. 37 ust. 1.
6b.7) W przypadku technologii lekowych o wysokiej wartości klinicznej oraz technologii lekowych o wysokim poziomie innowacyjności, gdy urzędowa cena zbytu w przeliczeniu na jedno opakowanie lub na jednego pacjenta ulega obniżeniu na skutek zawarcia instrumentu dzielenia ryzyka (cena efektywna) w kolejnej decyzji o objęciu refundacją leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego, cena efektywna nie może być wyższa niż wynikająca z decyzji w odniesieniu do leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego, który w dniu złożenia tego wniosku był zawarty w wykazie, o którym mowa w art. 37 ust. 1.
7. Przepis ust. 6 stosuje się odpowiednio do środka spożywczego specjalnego przeznaczenia żywieniowego i wyrobu medycznego.
8. Minister właściwy do spraw zdrowia ustala urzędową cenę zbytu leku, środka spożywczego specjalnego przeznaczenia żywieniowego, o którym mowa w art. 6 ust. 1 pkt 4, przy uwzględnieniu kryteriów:
1) stanowiska Komisji Ekonomicznej, o której mowa w art. 17,
2) minimalnej ceny zbytu netto, uzyskanej na terytorium Rzeczypospolitej Polskiej w okresie roku przed złożeniem wniosku dla wnioskowanej wielkości opakowania i dawki,
3) minimalnej ceny zbytu netto, uzyskanej w poszczególnych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA) w ramach finansowania ze środków publicznych tych państw, w okresie roku przed złożeniem wniosku, przeliczone w złotych polskich po średnim kursie Narodowego Banku Polskiego z miesiąca poprzedzającego miesiąc złożenia wniosku; w przypadku gdy przedmiot wniosku nie jest finansowany ze środków publicznych w danym państwie, uwzględnia się odpowiednio ceny uzyskane na wolnym rynku,
4) urzędowej ceny zbytu leków posiadających tę samą nazwę międzynarodową albo inne nazwy międzynarodowe, ale podobne działanie terapeutyczne oraz środków spożywczych specjalnego przeznaczenia żywieniowego, przy zastosowaniu następujących kryteriów:
a) tych samych wskazań lub przeznaczeń,
b) podobnej skuteczności
– biorąc pod uwagę równoważenie interesów świadczeniobiorców i przedsiębiorców zajmujących się wytwarzaniem lub obrotem lekami, środkami spożywczymi specjalnego przeznaczenia żywieniowego, możliwości płatnicze podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych oraz działalność naukowo-badawczą i inwestycyjną wnioskodawcy w zakresie związanym z ochroną zdrowia na terytorium Rzeczypospolitej Polskiej oraz w innych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA).
Art. 14. 1. Minister właściwy do spraw zdrowia, wydając decyzję o objęciu refundacją, dokonuje kwalifikacji do następujących odpłatności:
1) bezpłatnie – leku, wyrobu medycznego mającego udowodnioną skuteczność w leczeniu nowotworu złośliwego, zaburzenia psychotycznego, upośledzenia umysłowego lub zaburzenia rozwojowego albo choroby zakaźnej o szczególnym zagrożeniu epidemicznym dla populacji, albo leku, środka spożywczego specjalnego przeznaczenia żywieniowego stosowanego w ramach programu lekowego;
2) ryczałtowej – leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego:
a) wymagającego, zgodnie z aktualną wiedzą medyczną, stosowania dłużej niż 30 dni oraz którego miesięczny koszt stosowania dla świadczeniobiorcy przy odpłatności 30% limitu finansowania przekraczałby 5% minimalnego wynagrodzenia za pracę, ogłaszanego w obwieszczeniu Prezesa Rady Ministrów wydanym na podstawie art. 2 ust. 4 ustawy z dnia 10 października 2002 r. o minimalnym wynagrodzeniu za pracę, albo
b) zakwalifikowanego na podstawie art. 72 lub jego odpowiednika, albo
c) wymagającego, zgodnie z aktualną wiedzą medyczną, stosowania nie dłużej niż 30 dni oraz którego koszt stosowania dla świadczeniobiorcy przy odpłatności 50% limitu finansowania przekraczałby 30% minimalnego wynagrodzenia za pracę, ogłaszanego w obwieszczeniu Prezesa Rady Ministrów wydanym na podstawie art. 2 ust. 4 ustawy z dnia 10 października 2002 r. o minimalnym wynagrodzeniu za pracę;
3) 50% – leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, który wymaga, zgodnie z aktualną wiedzą medyczną, stosowania nie dłużej niż 30 dni;
4) 30% – leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, który nie został zakwalifikowany do poziomów odpłatności określonych w pkt 1–3.
2. Kwalifikacji do odpowiedniej odpłatności dokonuje się przy założeniu stosowania jednej DDD dobowo. W przypadku braku DDD kwalifikacji dokonuje się w oparciu o koszt miesięcznej terapii.
Art. 15. 1. Minister właściwy do spraw zdrowia ustala grupy leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych, w ramach których wyznacza się podstawę limitu. Grup limitowych nie tworzy się w odniesieniu do leków, środków spożywczych specjalnego przeznaczenia żywieniowego, o których mowa w art. 6 ust. 1 pkt 4.
2. Do grupy limitowej kwalifikuje się lek posiadający tę samą nazwę międzynarodową albo inne nazwy międzynarodowe, ale podobne działanie terapeutyczne i zbliżony mechanizm działania oraz środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny, przy zastosowaniu następujących kryteriów:
1) tych samych wskazań lub przeznaczeń, w których są refundowane;
2) podobnej skuteczności.
3. Po zasięgnięciu opinii Rady Przejrzystości, opierającej się w szczególności na porównaniu wielkości kosztów uzyskania podobnego efektu zdrowotnego lub dodatkowego efektu zdrowotnego, dopuszcza się tworzenie:
1) odrębnej grupy limitowej, w przypadku gdy droga podania leku lub jego postać farmaceutyczna w istotny sposób ma wpływ na efekt zdrowotny lub dodatkowy efekt zdrowotny;
2) wspólnej grupy limitowej, w przypadku gdy podobny efekt zdrowotny lub podobny dodatkowy efekt zdrowotny uzyskiwany jest pomimo odmiennych mechanizmów działania leków;
3) odrębnej grupy limitowej dla środków spożywczych specjalnego przeznaczenia żywieniowego, jeżeli zawartość składników odżywczych w istotny sposób wpływa na efekt zdrowotny lub dodatkowy efekt zdrowotny.
4. Podstawę limitu w danej grupie limitowej leków stanowi najwyższa spośród najniższych cen hurtowych za DDD leku, który dopełnia 15% obrotu ilościowego, liczonego według DDD, zrealizowanego w tej grupie limitowej w miesiącu poprzedzającym o 3 miesiące ogłoszenie obwieszczenia, o którym mowa w art. 37.
5. Podstawę limitu w przypadku:
1) środka spożywczego specjalnego przeznaczenia żywieniowego – stanowi najniższy koszt 30 dniowego stosowania według cen hurtowych;
2) wyrobu medycznego – stanowi najwyższa spośród najniższych cen hurtowych za jednostkę tego wyrobu medycznego, który dopełnia 15% obrotu ilościowego zrealizowanego w tej grupie limitowej w miesiącu poprzedzającym o 3 miesiące ogłoszenie obwieszczenia, o którym mowa w art. 37.
6. Jeżeli cena detaliczna jest niższa niż limit finansowania, limit finansowania ulega obniżeniu do wysokości ceny detalicznej tego leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego.
7. W przypadku wydania decyzji o objęciu refundacją pierwszego odpowiednika refundowanego w danym wskazaniu podstawą limitu w grupie limitowej jest cena hurtowa za DDD tego odpowiednika. W przypadku objęcia refundacją kolejnych odpowiedników podstawa limitu nie może być wyższa niż cena hurtowa za DDD pierwszego odpowiednika.
8. Jeżeli informacje o obrocie ilościowym, o którym mowa w ust. 4 i 5, nie są dostępne, wykorzystuje się informacje najbardziej aktualne.
9. Wysokość limitu finansowania za opakowanie jednostkowe jest równa iloczynowi kosztu DDD podstawy limitu i liczby DDD w opakowaniu jednostkowym, z uwzględnieniem urzędowej marży detalicznej. W przypadku gdy DDD nie jest określone do wyliczenia limitu finansowania przyjmuje się koszt terapii dziennej i ilość terapii dziennej w danym opakowaniu.
10. W przypadku środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego wysokość limitu finansowania jest równa iloczynowi kosztu jednostki podstawy limitu i ilości jednostek w danym opakowaniu.
11. Podstawę limitu w danej grupie limitowej leków, o których mowa w art. 6 ust. 1 pkt 2 i 3 stanowi najwyższa spośród najniższych cen hurtowych za DDD leku, który według deklaracji złożonej we wniosku o objęcie refundacją dopełnia 110% obrotu ilościowego, liczonego według DDD, zrealizowanego w tej grupie limitowej w roku poprzedzającym rok ustalenia podstawy albo 100% szacowanego zapotrzebowania w przypadku leku, dla którego zostanie utworzona nowa grupa limitowa.
12. Wysokość limitu finansowania leków, o których mowa w art. 6 ust. 1 pkt 2 i 3, świadczeniodawcom jest równa iloczynowi kosztu DDD podstawy limitu i liczby DDD podanych świadczeniobiorcom w ramach realizacji umowy o udzielanie świadczeń opieki zdrowotnej.
13. Przepisy ust. 11 i 12 stosuje się odpowiednio w przypadku:
1) leków, dla których DDD nie zostało określone,
2) środków spożywczych specjalnego przeznaczenia żywieniowego
– o których mowa w art. 6 ust. 1 pkt 2 i 3.
14. W przypadku, gdy DDD jest niższe od najczęściej stosowanej dobowo dawki leku (PDD) podstawę limitu minister właściwy do spraw zdrowia może wyznaczyć na podstawie PDD.
Art. 16. W przypadku, gdy w wyniku wydania decyzji administracyjnej o objęciu refundacją leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, zachodzi konieczność utworzenia nowej grupy limitowej obejmującej również leki, środki spożywcze specjalnego przeznaczenia żywieniowego, wyroby medyczne zakwalifikowane uprzednio do innej grupy limitowej, minister właściwy do spraw zdrowia wydaje z urzędu decyzje administracyjne, zmieniające określenie grupy limitowej, o której mowa w art. 11 ust. 2 pkt 8.
Rozdział 4
Komisja Ekonomiczna
Art. 17. 1. Przy ministrze właściwym do spraw zdrowia tworzy się Komisję Ekonomiczną, zwaną dalej „Komisją”.
2.8) W skład Komisji wchodzi:
1) czternastu przedstawicieli ministra właściwego do spraw zdrowia;
2) sześciu przedstawicieli Prezesa Funduszu.
3. Członkiem Komisji może zostać osoba:
1) która:
a) korzysta z pełni praw publicznych,
b) nie była skazana prawomocnym wyrokiem za umyślne przestępstwo lub umyślne przestępstwo skarbowe,
c) posiada wiedzę i doświadczenie, które dają rękojmię skutecznego prowadzenia negocjacji;
2) wobec której nie zachodzą okoliczności określone w art. 20 ust. 1 i art. 21.
4. Członków Komisji powołuje i odwołuje minister właściwy do spraw zdrowia.
Art. 18. 1. Do zadań Komisji należy prowadzenie negocjacji z wnioskodawcą w zakresie:
1) ustalenia urzędowej ceny zbytu;
2) poziomu odpłatności;
3) wskazań, w których lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny ma być refundowany;
4) instrumentów dzielenia ryzyka, o których mowa w art. 11 ust. 5.
2. Do zadań Komisji należy również:
1) monitorowanie realizacji całkowitego budżetu na refundację;
2) prowadzenie działań mających na celu racjonalizację wydatków związanych z refundacją oraz przedstawianie ministrowi właściwemu do spraw zdrowia propozycji w tym zakresie;
3) monitorowanie realizacji zobowiązania, o którym mowa w art. 25 pkt 4;
4) realizacja innych zadań zleconych przez ministra właściwego do spraw zdrowia.
3. Komisja na podstawie dokumentu stanowiącego wynik negocjacji, sporządzonego w postaci elektronicznej, podpisanego przez strony negocjacji, podejmuje uchwałę w drodze głosowania elektronicznego za pomocą Systemu Obsługi List Refundacyjnych, o którym mowa w art. 30a ustawy z dnia 28 kwietnia 2011 r. o systemie informacji w ochronie zdrowia, zwanego dalej „SOLR”, i przekazuje ją niezwłocznie ministrowi właściwemu do spraw zdrowia.
Art. 19. 1. Rozpatrując wnioski, o których mowa w art. 24 ust. 1, Komisja prowadzi negocjacje w składzie pięcioosobowym, zwanym dalej „zespołem negocjacyjnym”, z tym że w każdym składzie powinien znaleźć się przedstawiciel Prezesa Funduszu.
2. Negocjacje prowadzi się biorąc pod uwagę następujące kryteria:
1) rekomendację Prezesa Agencji, o której mowa w art. 35 ust. 6, w szczególności wyników analizy stosunku kosztów do uzyskanych efektów zdrowotnych,
2) maksymalną i minimalną cenę zbytu netto, uzyskaną na terytorium Rzeczypospolitej Polskiej w okresie roku przed złożeniem wniosku, o którym mowa w art. 24 ust. 1, dla danej wielkości opakowania i dawki, będącej przedmiotem tego wniosku, jeżeli dotyczy,
3) maksymalną i minimalną cenę zbytu netto, uzyskaną w poszczególnych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA), w ramach finansowania ze środków publicznych tych państw, w okresie roku przed złożeniem wniosku, o którym mowa w art. 24 ust. 1, przeliczoną w złotych polskich po średnim kursie Narodowego Banku Polskiego z miesiąca poprzedzającego miesiąc złożenia wniosku; w przypadku gdy przedmiot wniosku nie jest finansowany ze środków publicznych w danych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA), uwzględnia się odpowiednio ceny uzyskane na wolnym rynku,
4) informację o rabatach, upustach lub porozumieniach cenowych w innych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA),
5) koszt terapii przy zastosowaniu wnioskowanego leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego w porównaniu z innymi możliwymi do zastosowania w danym stanie klinicznym technologiami medycznymi, które mogą zostać zastąpione przez ten lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny,
6) wpływ na budżet podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych,
7) wysokość progu kosztu uzyskania dodatkowego roku życia skorygowanego o jego jakość, ustalonego w wysokości trzykrotności Produktu Krajowego Brutto na jednego mieszkańca, o którym mowa w art. 6 ust. 1 ustawy z dnia 26 października 2000 r. o sposobie obliczania wartości rocznego produktu krajowego brutto, a w przypadku braku możliwości wyznaczenia tego kosztu – koszt uzyskania dodatkowego roku życia
– uwzględniając potrzebę równoważenia interesów świadczeniobiorców i przedsiębiorców zajmujących się wytwarzaniem lub obrotem lekami, środkami spożywczymi specjalnego przeznaczenia żywieniowego, wyrobami medycznymi, możliwości płatnicze podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych oraz działalność naukowo-badawczą i inwestycyjną wnioskodawcy w zakresie związanym z ochroną zdrowia na terytorium Rzeczypospolitej Polskiej oraz w innych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA).
3. Wynikiem negocjacji jest dokument sporządzony w postaci elektronicznej w trakcie negocjacji podpisany przez przewodniczącego zespołu negocjacyjnego oraz wnioskodawcę za pomocą podpisu zaufanego, podpisu osobistego lub kwalifikowanym podpisem elektronicznym, przekazywany następnie Komisji w celu podjęcia uchwały.
Art. 20. 1. Członkowie Komisji, ich małżonkowie, zstępni i wstępni w linii prostej oraz osoby, z którymi członkowie Komisji pozostają we wspólnym pożyciu nie mogą:
1) być członkami organów spółek handlowych lub przedstawicielami przedsiębiorców prowadzących działalność gospodarczą w zakresie wytwarzania lub obrotu lekiem, środkiem spożywczym specjalnego przeznaczenia żywieniowego, wyrobem medycznym;
2) być członkami organów spółek handlowych lub przedstawicielami przedsiębiorców prowadzących działalność gospodarczą w zakresie doradztwa związanego z refundacją leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych;
3) być członkami organów spółdzielni, stowarzyszeń lub fundacji prowadzących działalność, o której mowa w pkt 1 i 2;
4) posiadać akcji lub udziałów w spółkach handlowych prowadzących działalność, o której mowa w pkt 1 i 2, oraz udziałów w spółdzielniach prowadzących działalność, o której mowa w pkt 1 i 2;
5) prowadzić działalności gospodarczej w zakresie, o którym mowa w pkt 1 i 2;
6) wykonywać zajęć zarobkowych na podstawie stosunku pracy, umowy o świadczenie usług zarządczych, umowy zlecenia, umowy o dzieło lub innej umowy o podobnym charakterze zawartej z podmiotami, o których mowa w pkt 1–3.
2. Członkowie Komisji składają ministrowi właściwemu do spraw zdrowia oświadczenie o niezachodzeniu okoliczności określonych w ust. 1, pod rygorem odpowiedzialności karnej za składanie fałszywych oświadczeń z art. 233 § 1 i 6 ustawy z dnia 6 czerwca 1997 r. – Kodeks karny (Dz. U. z 2020 r. poz. 1444 i 1517), zwane dalej „deklaracją o braku konfliktu interesów”, przed powołaniem oraz przed każdym posiedzeniem Komisji.
3. Zaistnienie okoliczności, o których mowa w ust. 1, stanowi podstawę do odwołania członka ze składu Komisji.
4. W przypadku zaistnienia okoliczności, o których mowa w ust. 1 pkt 4, niezależnych od członka Komisji, członek Komisji niezwłocznie informuje ministra właściwego do spraw zdrowia o tym fakcie. Minister właściwy do spraw zdrowia zawiesza członka w pracach Komisji, wyznaczając mu termin usunięcia zaistniałych okoliczności. Po bezskutecznym upływie tego terminu, minister właściwy do spraw zdrowia odwołuje członka Komisji.
5. Deklaracja o braku konfliktu interesów zawiera:
1) imię i nazwisko osoby składającej oświadczenie;
2) imię i nazwisko: małżonka, wstępnych, zstępnych w linii prostej oraz osób, z którymi członkowie Komisji pozostają we wspólnym pożyciu;
3) oświadczenie o niezachodzeniu okoliczności, o których mowa w ust. 1.
6. Deklaracje o braku konfliktu interesów weryfikuje Centralne Biuro Antykorupcyjne.
Art. 21. 1. Nie można być jednocześnie członkiem Komisji i Rady Przejrzystości.
2. Funkcji członka Komisji albo Rady Przejrzystości nie można łączyć z funkcją Prezesa Agencji i jego zastępcy.
Art. 22. 1. Działalność Komisji jest finansowana z budżetu państwa ze środków pozostających w dyspozycji ministra właściwego do spraw zdrowia.
2. Członkom Komisji przysługuje wynagrodzenie za udział w posiedzeniach w wysokości nieprzekraczającej 3500 zł za udział w każdym posiedzeniu Komisji, jednak nie więcej niż 10 500 zł miesięcznie.
3. Członkom Komisji przysługuje zwrot kosztów podróży na zasadach określonych w przepisach dotyczących zasad ustalania oraz wysokości należności przysługujących pracownikowi zatrudnionemu w państwowej lub samorządowej jednostce budżetowej z tytułu podróży służbowej na terenie kraju.
Art. 23. 1. Minister właściwy do spraw zdrowia określi, w drodze rozporządzenia:
1) wzór deklaracji o braku konfliktu interesów, mając na uwadze wymagania, o których mowa w art. 20 ust. 5;
2) wysokość wynagrodzenia członków Komisji, biorąc pod uwagę zakres działania Komisji oraz specyfikę wykonywanych zadań.
2. Minister właściwy do spraw zdrowia określi w drodze zarządzenia:
1) regulamin Komisji określający jej organizację, sposób i tryb działania, a także sposób wyłaniania i odwoływania przewodniczącego oraz członków Komisji;
2) tryb wyłaniania członków Komisji na poszczególne posiedzenia w sprawie prowadzenia negocjacji;
3) sposób obsługi organizacyjno-technicznej Komisji.
Rozdział 5
Tryb podejmowania decyzji w sprawie refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego i wyrobów medycznych
Art. 24. 1. Wnioskodawca może złożyć do ministra właściwego do spraw zdrowia wniosek o:
1) objęcie refundacją i ustalenie urzędowej ceny zbytu leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego;
1a)9) objęcie refundacją i ustalenie urzędowej ceny zbytu technologii lekowej o wysokiej wartości klinicznej;
1b)9) objęcie refundacją i ustalenie urzędowej ceny zbytu technologii lekowej o wysokim poziomie innowacyjności;
2) podwyższenie urzędowej ceny zbytu leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego objętego refundacją;
3) obniżenie urzędowej ceny zbytu leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego objętego refundacją;
4) ustalenie albo zmianę urzędowej ceny zbytu leku, środka spożywczego specjalnego przeznaczenia żywieniowego, o którym mowa w art. 6 ust. 1 pkt 4;
5) skrócenie okresu obowiązywania decyzji, o której mowa w art. 11 ust. 1 albo ust. 6.
2. Do wniosków, o których mowa w ust. 1, dołącza się także:
1) informację aktualną na dzień złożenia wniosku dotyczącą refundacji leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego we wszystkich państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA) wraz z określeniem poziomu refundacji, jej warunków i ograniczeń, w tym szczegółowych informacji dotyczących zawartych instrumentów dzielenia ryzyka, albo informację o nieistnieniu takich ograniczeń lub niezawarciu takich instrumentów – informację tę potwierdza się właściwymi dokumentami przetłumaczonymi przysięgle na język polski;
2) aktualną na dzień złożenia wniosku: Charakterystykę Produktu Leczniczego albo oznakowanie środka spożywczego specjalnego przeznaczenia żywieniowego, albo instrukcję stosowania wyrobu medycznego, jeżeli dotyczy;
3) aktualny odpis z rejestru, do którego wnioskodawca jest wpisany, lub równoważny mu dokument wystawiony poza granicami Rzeczypospolitej Polskiej, wydany nie wcześniej niż 3 miesiące przed dniem złożenia wniosku; w przypadku wnioskodawców zagranicznych należy dodatkowo dołączyć tłumaczenie przysięgłe odpowiedniego dokumentu na język polski;
4) upoważnienie do reprezentowania wnioskodawcy, jeżeli dotyczy;
5) umowę zawartą pomiędzy podmiotem odpowiedzialnym a przedstawicielem podmiotu odpowiedzialnego, w rozumieniu przepisów ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne, jeżeli dotyczy.
3. Wnioskodawca składa odrębny wniosek dla każdej dawki, wielkości opakowania, kategorii dostępności refundacyjnej, o której mowa w art. 6 ust. 1, lub poziomu odpłatności leku, środka spożywczego specjalnego przeznaczenia żywieniowego oraz wyrobu medycznego.
4. W przypadku gdy analizy, o których mowa w art. 26 pkt 1 lit. h oraz i lub pkt 2 lit. h–j, są właściwe dla więcej niż jednego wniosku, dopuszcza się złożenie tych analiz jako wspólnych załączników do składanych wniosków.
5. W przypadku wnioskowania o objęcie refundacją dodatkowego wskazania dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego albo dodatkowego zastosowania wyrobu medycznego wnioskodawca składa wniosek, o którym mowa w ust. 1 pkt 1.
6. Wnioski wraz z załącznikami oraz inne wnioski, pisma ministra właściwego do spraw zdrowia oraz pisma strony składane w postępowaniu w zakresie wydania decyzji administracyjnej w sprawie refundacji leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego składa się w postaci elektronicznej za pomocą SOLR.
6a. Wnioski, o których mowa w ust. 1, oraz dokumenty, o których mowa w ust. 2, opatruje się podpisem zaufanym, podpisem osobistym lub kwalifikowanym podpisem elektronicznym.
6b. Z wnioskodawcami, o których mowa w ust. 1, minister właściwy do spraw zdrowia komunikuje się za pomocą SOLR.
6c. W przypadku braku dostępu do SOLR na skutek awarii systemu lub działania siły wyższej, termin na dokonanie czynności dotyczących postępowania w sprawie refundacji leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego uznaje się za zachowany pod warunkiem dokonania w wyznaczonym terminie czynności w postaci papierowej. Dokumentacja złożona w postaci papierowej, po uzyskaniu dostępu do SOLR, jest wprowadzana przez ministra właściwego do spraw zdrowia do systemu w terminie trzech dni roboczych od dnia przywrócenia funkcjonalności systemu.
6d. W uzasadnionych przypadkach, gdy wystąpi brak dostępu do SOLR na skutek awarii systemu lub działania siły wyższej, jest możliwe dokonanie czynności w zakresie wydania decyzji administracyjnej w sprawie refundacji leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego bez pośrednictwa SOLR. Przepis ust. 6c w zakresie wprowadzania do systemu dokumentacji stosuje się odpowiednio.
7. Minister właściwy do spraw zdrowia określi, w drodze rozporządzenia:
1) (uchylony)
2)10) minimalne wymagania, jakie muszą spełniać analizy, o których mowa w art. 25 pkt 14 lit. c i art. 25a pkt 14 oraz art. 26 pkt 2 lit. h–j, biorąc pod uwagę potrzebę zapewnienia niezbędnej wiarygodności i precyzji tych analiz, koniecznej do podjęcia na ich podstawie adekwatnych decyzji o objęciu refundacją.
Art. 25. Wniosek, o którym mowa w art. 24 ust. 1 pkt 1, zawiera:
1) oznaczenie (firmę) wnioskodawcy, adres siedziby albo miejsca wykonywania działalności gospodarczej, imię i nazwisko, telefon, telefaks, adres poczty elektronicznej i adres korespondencyjny osoby upoważnionej do jego reprezentowania w sprawie tego wniosku;
2) określenie przedmiotu wniosku;
3) dowód dostępności w obrocie leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, w chwili składania wniosku;
4) zobowiązanie do zapewnienia ciągłości dostaw wraz z określeniem rocznej wielkości dostaw podanej w ujęciu miesięcznym, w przypadku objęcia refundacją;
5) dane identyfikujące lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny w danej wielkości i dawce, jeżeli dotyczy:
a) nazwę, jego postać, rodzaj, drogę podania albo sposób zastosowania oraz rodzaj opakowania,
b) numer pozwolenia oraz kopię decyzji o dopuszczeniu do obrotu leku albo kopię powiadomienia o wprowadzeniu do obrotu środka spożywczego specjalnego przeznaczenia żywieniowego albo kopię powiadomienia lub zgłoszenia wyrobu medycznego,
c) numer GTIN zgodny z systemem GS1 lub inny kod jednoznacznie identyfikujący wyrób medyczny lub środek spożywczy specjalnego przeznaczenia żywieniowego;
6) wnioskowane warunki objęcia refundacją, w szczególności:
a) wskazania, w których lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny ma być refundowany,
b) proponowaną cenę zbytu netto,
c) kategorię dostępności refundacyjnej, o której mowa w art. 6 ust. 1,
d) poziom odpłatności,
e) instrumenty dzielenia ryzyka, o których mowa w art. 11 ust. 5,
f) okres obowiązywania decyzji o objęciu refundacją,
g) projekt opisu programu lekowego, jeżeli dotyczy, zawierający:
– nazwę programu,
– cel programu,
– opis problemu medycznego,
– opis programu obejmujący: kryteria włączenia do programu, dawkowanie i sposób podawania, monitorowanie programu, w tym monitorowanie leczenia i sposób przekazywania informacji sprawozdawczo-rozliczeniowych, a także kryteria wyłączenia z programu;
7) wskazanie maksymalnej i minimalnej ceny zbytu netto, uzyskanej na terytorium Rzeczypospolitej Polskiej w okresie roku przed złożeniem wniosku dla wnioskowanej wielkości opakowania i dawki;
8) wskazanie maksymalnej i minimalnej ceny zbytu netto, uzyskanej w poszczególnych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA) w ramach finansowania ze środków publicznych tych państw w okresie roku przed złożeniem wniosku, przeliczone w złotych polskich po średnim kursie Narodowego Banku Polskiego z miesiąca poprzedzającego miesiąc złożenia wniosku; w przypadku gdy przedmiot wniosku nie jest finansowany ze środków publicznych w danym państwie, uwzględnia się odpowiednio ceny uzyskane na wolnym rynku; w przypadku wnioskodawcy będącego importerem równoległym wskazanie ceny zbytu netto leku z państwa, z którego jest sprowadzany;
9) dzienny koszt terapii dla leku, odrębnie dla każdego wskazania określonego w pkt 6 lit. a;
10) średni koszt standardowej terapii dla leku, odrębnie dla każdego wskazania określonego w pkt 6 lit. a;
11) czas trwania standardowej terapii dla leku oraz środka spożywczego specjalnego przeznaczenia żywieniowego, odrębnie dla każdego wskazania określonego w pkt 6 lit. a;
12) informacje dotyczące terminu wygaśnięcia ochrony patentowej, w tym także dodatkowego świadectwa ochronnego, jeżeli dotyczy;
13) informacje dotyczące upływu okresu wyłączności danych oraz wyłączności rynkowej, jeżeli dotyczy;
14) uzasadnienie wniosku zawierające:
a) dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, który ma co najmniej jeden odpowiednik refundowany w danym wskazaniu – analizę wpływu na budżet podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych,
b) (uchylona)
c) dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, który nie ma odpowiednika refundowanego w danym wskazaniu:
– analizę kliniczną, sporządzoną na podstawie przeglądu systematycznego w porównaniu z innymi możliwymi do zastosowania w danym stanie klinicznym procedurami medycznymi we wnioskowanym wskazaniu, w tym, o ile występują, finansowanymi ze środków publicznych,
– analizę ekonomiczną z perspektywy podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych oraz świadczeniobiorcy,
– analizę wpływu na budżet podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych,
– analizę racjonalizacyjną, przedkładaną w przypadku gdy analiza wpływu na budżet podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych wykazuje wzrost kosztów refundacji; analiza ta powinna przedstawiać rozwiązania dotyczące refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych, których objęcie refundacją spowoduje uwolnienie środków publicznych w wielkości odpowiadającej co najmniej wzrostowi kosztów wynikającemu z analizy wpływu na budżet,
d) informacje dotyczące działalności naukowo-badawczej i inwestycyjnej wnioskodawcy w zakresie związanym z ochroną zdrowia na terytorium Rzeczypospolitej Polskiej oraz w innych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA);
15) dowód uiszczenia opłaty, o której mowa w art. 32 i art. 35 ust. 3, jeżeli dotyczy.
Art. 25a.11) Wniosek, o którym mowa w art. 24 ust. 1 pkt 1a, zawiera:
1) oznaczenie (firmę) wnioskodawcy, adres siedziby albo miejsca wykonywania działalności gospodarczej, imię i nazwisko, telefon, adres poczty elektronicznej i adres korespondencyjny osoby upoważnionej do jego reprezentowania w sprawie tego wniosku;
2) określenie przedmiotu wniosku;
3) dowód dostępności w obrocie w chwili składania wniosku, a w przypadku produktu leczniczego terapii zaawansowanej – zobowiązanie do zapewnienia gotowości technologicznej do jego wytworzenia na dzień składania wniosku;
4) zobowiązanie do zapewnienia ciągłości dostaw wraz z określeniem rocznej wielkości dostaw podanej w ujęciu miesięcznym, w przypadku objęcia refundacją;
5) dane identyfikujące lek w danej wielkości i dawce, jeżeli dotyczy:
a) nazwę, jego postać, rodzaj, drogę podania albo sposób zastosowania oraz rodzaj opakowania,
b) numer pozwolenia oraz kopię decyzji o dopuszczeniu do obrotu,
c) numer GTIN zgodny z systemem GS1;
6) wnioskowane warunki objęcia refundacją, w szczególności:
a) wskazania, w których lek ma być refundowany,
b) proponowaną cenę zbytu netto,
c) poziom odpłatności,
d) instrumenty dzielenia ryzyka, o których mowa w art. 11 ust. 5,
e) projekt opisu programu lekowego zawierający:
– nazwę programu,
– cel programu,
– opis problemu medycznego,
– opis programu obejmujący: kryteria włączenia do programu, dawkowanie i sposób podawania, monitorowanie programu, w tym monitorowanie leczenia i sposób przekazywania informacji sprawozdawczo-rozliczeniowych, a także kryteria wyłączenia z programu;
7) wskazanie maksymalnej i minimalnej ceny zbytu netto, uzyskanej na terytorium Rzeczypospolitej Polskiej w okresie roku przed złożeniem wniosku dla wnioskowanej wielkości opakowania i dawki;
8) wskazanie maksymalnej i minimalnej ceny zbytu netto, uzyskanej w poszczególnych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA) w ramach finansowania ze środków publicznych tych państw w okresie roku przed złożeniem wniosku, przeliczone w złotych polskich po średnim kursie Narodowego Banku Polskiego z miesiąca poprzedzającego miesiąc złożenia wniosku; w przypadku gdy przedmiot wniosku nie jest finansowany ze środków publicznych w danym państwie, uwzględnia się odpowiednio ceny uzyskane na wolnym rynku; w przypadku wnioskodawcy będącego importerem równoległym wskazanie ceny zbytu netto leku z państwa, z którego jest sprowadzany;
9) dzienny koszt terapii dla leku, odrębnie dla każdego wskazania określonego w pkt 6 lit. a;
10) średni koszt standardowej terapii dla leku, odrębnie dla każdego wskazania określonego w pkt 6 lit. a;
11) czas trwania standardowej terapii dla leku, odrębnie dla każdego wskazania określonego w pkt 6 lit. a;
12) informacje dotyczące terminu wygaśnięcia ochrony patentowej, w tym także dodatkowego świadectwa ochronnego, jeżeli dotyczy;
13) informacje dotyczące upływu okresu wyłączności danych oraz wyłączności rynkowej, jeżeli dotyczy;
14) uzasadnienie wniosku zawierające:
a) analizę kliniczną, sporządzoną na podstawie przeglądu systematycznego w porównaniu z innymi możliwymi do zastosowania w danym stanie klinicznym procedurami medycznymi,
b) analizę ekonomiczną z perspektywy podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych oraz świadczeniobiorcy,
c) analizę wpływu na budżet podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych,
d) informacje dotyczące działalności naukowo-badawczej i inwestycyjnej wnioskodawcy w zakresie związanym z ochroną zdrowia na terytorium Rzeczypospolitej Polskiej oraz w innych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA);
15) dowód uiszczenia opłaty, o której mowa w art. 32 i art. 35 ust. 3, jeżeli dotyczy.
Art. 25b.11) Wniosek, o którym mowa w art. 24 ust. 1 pkt 1b, zawiera:
1) oznaczenie (firmę) wnioskodawcy, adres siedziby albo miejsca wykonywania działalności gospodarczej, imię i nazwisko, telefon, adres poczty elektronicznej i adres korespondencyjny osoby upoważnionej do jego reprezentowania w sprawie tego wniosku;
2) określenie przedmiotu wniosku;
3) dowód dostępności w obrocie w chwili składania wniosku, a w przypadku produktu leczniczego terapii zaawansowanej zobowiązanie do zapewnienia gotowości technologicznej do jego wytworzenia na dzień składania wniosku;
4) zobowiązanie do zapewnienia ciągłości dostaw wraz z określeniem rocznej wielkości dostaw podanej w ujęciu miesięcznym, w przypadku objęcia refundacją;
5) dane identyfikujące lek w danej wielkości i dawce, jeżeli dotyczy:
a) nazwę, jego postać, rodzaj, drogę podania albo sposób zastosowania oraz rodzaj opakowania,
b) numer pozwolenia oraz kopię decyzji o dopuszczeniu do obrotu,
c) numer GTIN zgodny z systemem GS1;
6) wnioskowane warunki objęcia refundacją, w szczególności:
a) wskazania, w których lek ma być refundowany,
b) proponowaną cenę zbytu netto,
c) poziom odpłatności,
d) instrumenty dzielenia ryzyka, o których mowa w art. 11 ust. 5;
7) wskazanie maksymalnej i minimalnej ceny zbytu netto, uzyskanej na terytorium Rzeczypospolitej Polskiej w okresie roku przed złożeniem wniosku dla wnioskowanej wielkości opakowania i dawki;
8) wskazanie maksymalnej i minimalnej ceny zbytu netto, uzyskanej w poszczególnych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA) w ramach finansowania ze środków publicznych tych państw w okresie roku przed złożeniem wniosku, przeliczone w złotych polskich po średnim kursie Narodowego Banku Polskiego z miesiąca poprzedzającego miesiąc złożenia wniosku; w przypadku gdy przedmiot wniosku nie jest finansowany ze środków publicznych w danym państwie, uwzględnia się odpowiednio ceny uzyskane na wolnym rynku; w przypadku wnioskodawcy będącego importerem równoległym wskazanie ceny zbytu netto leku z państwa, z którego jest sprowadzany;
9) dzienny koszt terapii dla leku, odrębnie dla każdego wskazania określonego w pkt 6 lit. a;
10) średni koszt standardowej terapii dla leku, odrębnie dla każdego wskazania określonego w pkt 6 lit. a;
11) czas trwania standardowej terapii dla leku;
12) informacje dotyczące terminu wygaśnięcia ochrony patentowej, w tym także dodatkowego świadectwa ochronnego, jeżeli dotyczy;
13) informacje dotyczące upływu okresu wyłączności danych oraz wyłączności rynkowej, jeżeli dotyczy;
14) analizę wpływu na budżet podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych.
Art. 25c.11) 1. W przypadku wniosków, o których mowa w art. 24 ust. 1 pkt 1, 1a i 1b, które dotyczą leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego znajdującego się w wykazie, o którym mowa w art. 37 ust. 1, w danym wskazaniu, wnioskodawca ma obowiązek złożyć je najpóźniej na 180 dni przed wygaśnięciem dotychczasowych decyzji.
2. Do wniosków, o których mowa w art. 24 ust. 1 pkt 1, składanych jako kontynuacja decyzji wydanych na podstawie wniosków, o których mowa w art. 24 ust. 1 pkt 1a i 1b, przepisów art. 30 ust. 2 nie stosuje się.
Art. 26. Wniosek, o którym mowa w art. 24 ust. 1 pkt 2, zawiera, jeżeli dany lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny:
1) ma odpowiednik refundowany w danym wskazaniu:
a) oznaczenie (firmę) wnioskodawcy, adres siedziby albo miejsca wykonywania działalności gospodarczej, imię i nazwisko, telefon, telefaks, adres poczty elektronicznej i adres korespondencyjny osoby upoważnionej do jego reprezentowania w sprawie tego wniosku,
b) określenie przedmiotu wniosku,
ba) numer decyzji, której urzędowa cena zbytu ma ulec zmianie,
c) proponowaną cenę zbytu netto,
d) dane identyfikujące lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny w danej wielkości i dawce, jeżeli dotyczy:
– nazwę, jego postać, rodzaj, drogę podania albo sposób zastosowania oraz rodzaj opakowania,
– numer pozwolenia oraz kopię decyzji o dopuszczeniu do obrotu leku albo kopię powiadomienia o wprowadzeniu do obrotu środka spożywczego specjalnego przeznaczenia żywieniowego albo kopię powiadomienia lub zgłoszenia wyrobu medycznego,
– numer GTIN zgodny z systemem GS1 lub inny kod jednoznacznie identyfikujący wyrób medyczny lub środek spożywczy specjalnego przeznaczenia żywieniowego,
e) wskazanie minimalnej ceny zbytu netto, uzyskanej na terytorium Rzeczypospolitej Polskiej w okresie roku przed złożeniem wniosku dla wnioskowanej wielkości opakowania i dawki,
f) wskazanie maksymalnej i minimalnej ceny zbytu netto, uzyskanej w poszczególnych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA) w ramach finansowania ze środków publicznych tych państw w okresie roku przed złożeniem wniosku, przeliczone w złotych polskich po średnim kursie Narodowego Banku Polskiego z miesiąca poprzedzającego miesiąc złożenia wniosku; w przypadku gdy przedmiot wniosku nie jest finansowany ze środków publicznych w danym państwie, uwzględnia się odpowiednio ceny uzyskane na wolnym rynku; w przypadku wnioskodawcy będącego importerem równoległym wskazanie ceny zbytu netto leku z państwa, z którego jest sprowadzany,
g) informacje dotyczące działalności naukowo-badawczej i inwestycyjnej wnioskodawcy w zakresie związanym z ochroną zdrowia na terytorium Rzeczypospolitej Polskiej oraz w innych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA),
h) analizę wpływu na budżet podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych,
i) analizę racjonalizacyjną przedkładaną w przypadku gdy analiza wpływu na budżet podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych wykazuje wzrost kosztów refundacji; analiza ta powinna przedstawiać rozwiązania dotyczące refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych, których wprowadzenie spowoduje uwolnienie środków publicznych w wielkości odpowiadającej co najmniej wzrostowi kosztów wynikającemu z analizy wpływu na budżet,
j) dzienny koszt terapii dla leku, odrębnie dla każdego wskazania objętego refundacją,
k) średni koszt standardowej terapii dla leku, odrębnie dla każdego wskazania objętego refundacją,
l) czas trwania standardowej terapii dla leku oraz środka spożywczego specjalnego przeznaczenia żywieniowego, odrębnie dla każdego wskazania objętego refundacją,
m) dowód uiszczenia opłaty, o której mowa w art. 32 i art. 35 ust. 3, jeżeli dotyczy;
2) nie ma odpowiednika refundowanego w danym wskazaniu:
a) oznaczenie (firmę) wnioskodawcy, adres siedziby albo miejsca wykonywania działalności gospodarczej, imię i nazwisko, telefon, telefaks, adres poczty elektronicznej i adres korespondencyjny osoby upoważnionej do jego reprezentowania w sprawie tego wniosku,
b) określenie przedmiotu wniosku,
ba) numer decyzji, której urzędowa cena zbytu ma ulec zmianie,
c) proponowaną cenę zbytu netto,
d) dane identyfikujące lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny w danej wielkości i dawce, jeżeli dotyczy:
– nazwę, jego postać, rodzaj, drogę podania albo sposób zastosowania oraz rodzaj opakowania,
– numer pozwolenia oraz kopię decyzji o dopuszczeniu do obrotu leku albo kopię powiadomienia o wprowadzeniu do obrotu środka spożywczego specjalnego przeznaczenia żywieniowego albo kopię powiadomienia lub zgłoszenia wyrobu medycznego,
– numer GTIN zgodny z systemem GS1 lub inny kod jednoznacznie identyfikujący wyrób medyczny lub środek spożywczy specjalnego przeznaczenia żywieniowego,
e) wskazanie minimalnej ceny zbytu netto, uzyskanej na terytorium Rzeczypospolitej Polskiej w okresie roku przed złożeniem wniosku dla wnioskowanej wielkości opakowania i dawki,
f) wskazanie maksymalnej i minimalnej ceny zbytu netto, uzyskanej w poszczególnych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA), w ramach finansowania ze środków publicznych tych państw w okresie roku przed złożeniem wniosku, przeliczone w złotych polskich po średnim kursie Narodowego Banku Polskiego z miesiąca poprzedzającego miesiąc złożenia wniosku; w przypadku gdy przedmiot wniosku nie jest finansowany ze środków publicznych w danym państwie, uwzględnia się odpowiednio ceny uzyskane na wolnym rynku; w przypadku wnioskodawcy będącego importerem równoległym wskazanie ceny zbytu netto leku z państwa, z którego jest sprowadzany,
g) informacje dotyczące działalności naukowo-badawczej i inwestycyjnej wnioskodawcy w zakresie związanym z ochroną zdrowia na terytorium Rzeczypospolitej Polskiej oraz w innych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA),
h) analizę kliniczną i ekonomiczną, jeżeli w uzasadnieniu wniosku są podane argumenty związane z efektem zdrowotnym, dodatkowym efektem zdrowotnym lub kosztami ich uzyskania,
i) analizę wpływu na budżet podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych,
j) analizę racjonalizacyjną przedkładaną w przypadku gdy analiza wpływu na budżet podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych wykazuje wzrost kosztów refundacji; analiza ta powinna przedstawiać rozwiązania dotyczące refundacji leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, których wprowadzenie spowoduje uwolnienie środków publicznych w wielkości odpowiadającej co najmniej wzrostowi kosztów wynikającemu z analizy wpływu na budżet,
k) dzienny koszt terapii dla leku, odrębnie dla każdego wskazania objętego refundacją,
l) średni koszt standardowej terapii dla leku, odrębnie dla każdego wskazania objętego refundacją,
m) czas trwania standardowej terapii dla leku oraz środka spożywczego specjalnego przeznaczenia żywieniowego, odrębnie dla każdego wskazania objętego refundacją,
n) dowód uiszczenia opłaty, o której mowa w art. 32 i art. 35 ust. 3, jeżeli dotyczy.
Art. 27. Wniosek, o którym mowa w art. 24 ust. 1 pkt 3, zawiera:
1) oznaczenie (firmę) wnioskodawcy, adres siedziby albo miejsca wykonywania działalności gospodarczej, imię i nazwisko, telefon, telefaks, adres poczty elektronicznej i adres korespondencyjny osoby upoważnionej do jego reprezentowania w sprawie tego wniosku;
2) określenie przedmiotu wniosku;
3) proponowaną cenę zbytu netto;
4) dane identyfikujące lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny w danej wielkości i dawce, jeżeli dotyczy:
a) nazwę, jego postać, rodzaj, drogę podania albo sposób zastosowania oraz rodzaj opakowania,
b) numer pozwolenia oraz kopię decyzji o dopuszczeniu do obrotu leku albo kopię powiadomienia o wprowadzeniu do obrotu środka spożywczego specjalnego przeznaczenia żywieniowego, albo kopię powiadomienia lub zgłoszenia wyrobu medycznego,
ba) numer decyzji, której urzędowa cena zbytu ma ulec zmianie,
c) numer GTIN zgodny z systemem GS1 lub inny kod jednoznacznie identyfikujący wyrób medyczny lub środek spożywczy specjalnego przeznaczenia żywieniowego.
5) (uchylony)
6) (uchylony)
7) (uchylony)
Art. 28. Wniosek, o którym mowa w art. 24 ust. 1 pkt 4, zawiera:
1) oznaczenie (firmę) wnioskodawcy, adres siedziby albo miejsca wykonywania działalności gospodarczej, imię i nazwisko, telefon, telefaks, adres poczty elektronicznej i adres korespondencyjny osoby upoważnionej do jego reprezentowania w sprawie tego wniosku;
2) określenie przedmiotu wniosku;
3) proponowaną cenę zbytu netto;
4) dane identyfikujące lek, środek spożywczy specjalnego przeznaczenia żywieniowego w danej wielkości i dawce, jeżeli dotyczy:
a) nazwę, jego postać, drogę podania oraz rodzaj opakowania,
b) numer pozwolenia oraz kopię decyzji o dopuszczeniu do obrotu,
c) numer GTIN zgodny z systemem GS1 lub inny kod jednoznacznie identyfikujący wyrób medyczny lub środek spożywczy specjalnego przeznaczenia żywieniowego;
5) wskazanie maksymalnej i minimalnej ceny zbytu netto, uzyskanej na terytorium Rzeczypospolitej Polskiej w okresie roku przed złożeniem wniosku dla wnioskowanej wielkości opakowania i dawki;
6) wskazanie maksymalnej i minimalnej ceny zbytu netto, uzyskanej w poszczególnych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA) w ramach finansowania ze środków publicznych tych państw w okresie roku przed złożeniem wniosku, przeliczone w złotych polskich po średnim kursie Narodowego Banku Polskiego z miesiąca poprzedzającego miesiąc złożenia wniosku; w przypadku gdy przedmiot wniosku nie jest finansowany ze środków publicznych w danym państwie, uwzględnia się odpowiednio ceny uzyskane na wolnym rynku; w przypadku wnioskodawcy będącego importerem równoległym wskazanie ceny zbytu netto leku z państwa, z którego jest sprowadzany;
7) uzasadnienie wniosku zawierające:
a) analizę wpływu na budżet podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych,
b) analizę racjonalizacyjną przedkładaną w przypadku gdy analiza wpływu na budżet podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych wykazuje wzrost kosztów refundacji; analiza ta powinna przedstawiać rozwiązania dotyczące refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych, których objęcie refundacją spowoduje uwolnienie środków publicznych w wielkości odpowiadającej co najmniej wzrostowi kosztów wynikającemu z analizy wpływu na budżet,
c) informacje dotyczące działalności naukowo-badawczej i inwestycyjnej wnioskodawcy w zakresie związanym z ochroną zdrowia na terytorium Rzeczypospolitej Polskiej oraz w innych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA);
8) dowód uiszczenia opłaty, o której mowa w art. 32, jeżeli dotyczy.
Art. 29. Wniosek, o którym mowa w art. 24 ust. 1 pkt 5, zawiera:
1) oznaczenie (firmę) wnioskodawcy, adres siedziby albo miejsca wykonywania działalności gospodarczej, imię i nazwisko, telefon, telefaks, adres poczty elektronicznej i adres korespondencyjny osoby upoważnionej do jego reprezentowania w sprawie tego wniosku;
2) określenie przedmiotu wniosku;
3) numer decyzji ulegającej skróceniu;
4) uzasadnienie wniosku;
5) analizę wpływu na budżet podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych;
6) analizę wpływu na wysokość odpłatności i dopłat świadczeniobiorców.
Art. 30. 1. Wymagania, o których mowa w art. 24 ust. 2 pkt 1, art. 25 pkt 12 i 13, art. 26 pkt 1 lit. g oraz pkt 2 lit. g, art. 28 pkt 7 lit. c, nie dotyczą wniosków, o których mowa w art. 24 ust. 1, składanych przez wnioskodawcę będącego importerem równoległym.
2. Wymagania, o których mowa w art. 25 pkt 14, nie dotyczą wniosków, o których mowa w art. 24 ust. 1 pkt 1, w odniesieniu do leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, który w dniu złożenia tego wniosku był zawarty w wykazie, o którym mowa w art. 37 ust. 1, w danym wskazaniu. Do wniosków tych nie stosuje się przepisów art. 12 pkt 2, art. 13 ust. 1 pkt 2 i ust. 3 oraz art. 35.
Art. 31. 1. Wnioski, o których mowa w art. 24 ust. 1, są rozpatrywane według kolejności ich wpływu.
2. W pierwszej kolejności, rozpatrywane są wnioski, o których mowa w art. 24 ust. 1 pkt 3.
3. W przypadku, gdy wniosek, o którym mowa w art. 24 ust. 1, nie zawiera wymaganych danych, minister właściwy do spraw zdrowia niezwłocznie informuje wnioskodawcę o konieczności jego uzupełnienia, zgodnie z przepisami ustawy z dnia 14 czerwca 1960 r. – Kodeks postępowania administracyjnego (Dz. U. z 2020 r. poz. 256, 695, 1298 i 2320 oraz z 2021 r. poz. 54 i 187).
4.12) Wniosek, o którym mowa w art. 24 ust. 1 pkt 1 i 1a, albo wniosek o ponowne rozpatrzenie sprawy dotyczący tego wniosku, rozpatruje się w terminie 180 dni, z tym że w przypadku konieczności uzupełnienia danych niezbędnych do rozpatrzenia wniosku, bieg tego terminu ulega zawieszeniu do dnia otrzymania uzupełnienia danych albo do dnia upływu terminu uzupełnienia wniosku.
4a.13) Wniosek, o którym mowa w art. 24 ust. 1 pkt 1b, albo wniosek o ponowne rozpatrzenie sprawy dotyczący tego wniosku, rozpatruje się w terminie 60 dni, z tym że w przypadku konieczności uzupełnienia danych niezbędnych do rozpatrzenia wniosku, bieg tego terminu ulega zawieszeniu do dnia otrzymania uzupełnienia danych albo do dnia upływu terminu uzupełnienia wniosku.
5. Wniosek, o którym mowa w art. 24 ust. 1 pkt 2, albo wniosek o ponowne rozpatrzenie sprawy dotyczący tego wniosku, rozpatruje się w terminie 90 dni, z tym że w przypadku konieczności uzupełnienia danych niezbędnych do rozpatrzenia wniosku, bieg tego terminu ulega zawieszeniu do dnia otrzymania uzupełnienia danych albo do dnia upływu terminu uzupełnienia wniosku.
6. Wniosek, o którym mowa w art. 24 ust. 1 pkt 4, albo wniosek o ponowne rozpatrzenie sprawy dotyczący tego wniosku, rozpatruje się w terminie 90 dni, z tym że w przypadku konieczności uzupełnienia danych niezbędnych do rozpatrzenia wniosku, bieg tego terminu ulega zawieszeniu do dnia otrzymania uzupełnienia danych albo do dnia upływu terminu uzupełnienia wniosku.
7. Wniosek, o którym mowa w art. 24 ust. 1 pkt 3, albo wniosek o ponowne rozpatrzenie sprawy dotyczący tego wniosku, rozpatruje się w terminie 30 dni, z tym że w przypadku konieczności uzupełnienia danych niezbędnych do rozpatrzenia wniosku, bieg tego terminu ulega zawieszeniu do dnia otrzymania uzupełnienia danych albo do dnia upływu terminu uzupełnienia wniosku.
8. W przypadku złożenia wniosków, o których mowa w art. 24 ust. 1 pkt 2, w liczbie przekraczającej o więcej niż 10% przeciętną liczbę wniosków, termin ich rozpatrzenia może być jednorazowo przedłużony o 60 dni. W takim przypadku minister właściwy do spraw zdrowia niezwłocznie informuje wnioskodawcę o przedłużeniu terminu, o którym mowa w ust. 5. Podstawą ustalenia przeciętnej liczby wniosków jest średnia liczba wniosków będących podstawą ustalenia trzech poprzednich wykazów, o których mowa w art. 37.
9. Jeżeli wniosek, o którym mowa w art. 24 ust. 1 pkt 2 albo 3, nie zostanie rozpatrzony w terminie, o którym mowa odpowiednio w ust. 5 albo 7 z uwzględnieniem ust. 8, to w decyzji ustala się cenę określoną we wniosku.
10. W przypadku wniosku, o którym mowa w art. 24 ust. 1 pkt 1, w zakresie dotyczącym ustalenia kategorii dostępności refundacyjnej, o której mowa w art. 6 ust. 1 pkt 2, termin, o którym mowa w ust. 4, ulega zawieszeniu do czasu uzgodnienia treści programu lekowego pomiędzy wnioskodawcą a ministrem właściwym do spraw zdrowia.
11. Uzgadnianie treści programu lekowego nie może trwać dłużej niż 60 dni. W przypadku nieuzgodnienia treści programu lekowego, minister właściwy do spraw zdrowia wydaje decyzję administracyjną o odmowie objęcia refundacją.
12. Wnioskodawca może przed złożeniem wniosku zwrócić się do ministra właściwego do spraw zdrowia o wydanie wstępnej opinii dotyczącej projektu programu lekowego. Do wydania wstępnej opinii nie stosuje się przepisów ustawy z dnia 14 czerwca 1960 r. – Kodeks postępowania administracyjnego.
Art. 32. 1.14) Za złożenie wniosku, o którym mowa w art. 24 ust. 1 pkt 1, 1a, 1b, 2, 4 i 5, oraz za jego uzupełnienie, o którym mowa w art. 31 ust. 3, pobiera się opłaty wnoszone na rachunek urzędu obsługującego ministra właściwego do spraw zdrowia.
2. Opłaty, o których mowa w ust. 1, stanowią dochód budżetu państwa i każda z nich nie może być wyższa niż 10 000 zł.
3. Minister właściwy do spraw zdrowia określi, w drodze rozporządzenia, wysokość opłat, o których mowa w ust. 1, mając na uwadze nakład pracy i poziom kosztów związanych z rozpatrywaniem wniosków, o których mowa w art. 24 ust. 1.
Art. 32a. 1. Wnioskodawca składa do ministra właściwego do spraw zdrowia wniosek o założenie konta w SOLR umożliwiającego za pomocą tego systemu:
1) składanie wniosków w postaci elektronicznej;
2) komunikowanie się z ministrem właściwym do spraw zdrowia.
2. Wniosek o założenie konta w SOLR zawiera oznaczenie (firmę) wnioskodawcy, adres siedziby albo miejsca wykonywania działalności gospodarczej, a także imię i nazwisko, telefon, telefaks, adres poczty elektronicznej i adres korespondencyjny osoby upoważnionej do jego reprezentowania w sprawie tego wniosku.
3. Do wniosku o założenie konta w SOLR dołącza się:
1) aktualny odpis z rejestru, do którego wnioskujący o założenie konta jest wpisany, lub równoważny mu dokument wystawiony poza granicami Rzeczypospolitej Polskiej, wydany nie wcześniej niż 3 miesiące przed dniem złożenia wniosku; w przypadku wnioskodawców zagranicznych należy dodatkowo dołączyć tłumaczenie odpowiedniego dokumentu na język polski sporządzone i poświadczone przez tłumacza przysięgłego albo sprawdzone i poświadczone przez tłumacza przysięgłego, wykonującego zawód tłumacza przysięgłego na warunkach określonych w ustawie z dnia 25 listopada 2004 r. o zawodzie tłumacza przysięgłego (Dz. U. z 2019 r. poz. 1326), lub przez tłumacza przysięgłego mającego siedzibę na terytorium państwa członkowskiego;
2) upoważnienie do reprezentowania wnioskodawcy, jeżeli dotyczy;
3) dowód uiszczenia opłaty za założenie konta.
4. Wniosek o założenie konta w SOLR wraz z załącznikami składa się w postaci papierowej i elektronicznej.
5. Opłatę za złożenie wniosku w wysokości 500 zł wnosi się na rachunek bankowy urzędu obsługującego ministra właściwego do spraw zdrowia.
6. Opłata za złożenie wniosku stanowi dochód budżetu państwa.
7. Po rozpatrzeniu wniosku o założenie konta w SOLR, minister właściwy do spraw zdrowia zakłada wnioskodawcy konto (login i hasło), które służy do administrowania udostępnioną wnioskodawcy częścią SOLR. Login i hasło przesyła się w terminie 21 dni od dnia otrzymania wniosku na wskazany we wniosku adres poczty elektronicznej.
8. Wniosek o założenie konta w SOLR złożony w postaci elektronicznej opatruje się podpisem zaufanym, podpisem osobistym lub kwalifikowanym podpisem elektronicznym.
Art. 33. 1. Minister właściwy do spraw zdrowia uchyla decyzję administracyjną o objęciu refundacją leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, w przypadku:
1) stwierdzenia braku deklarowanej skuteczności terapeutycznej;
2) stwierdzenia ryzyka stosowania niewspółmiernego do efektu terapeutycznego;
3) podważenia wiarygodności i precyzji oszacowań kryteriów, o których mowa w art. 12 pkt 3–10;
4) gdy zobowiązanie, o którym mowa w art. 25 pkt 4, nie zostanie dotrzymane w zakresie dotyczącym zapewnienia ciągłości dostaw lub rocznej wielkości dostaw, i nastąpi niezaspokojenie potrzeb świadczeniobiorców.
2. W przypadkach, o których mowa w ust. 1 pkt 1–3, minister właściwy do spraw zdrowia uchyla decyzję administracyjną o objęciu refundacją leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego po zasięgnięciu opinii Rady Przejrzystości.
3. Ostateczna decyzja uchylająca decyzję administracyjną o objęciu refundacją stanowi podstawę aktualizacji wykazów, o których mowa w art. 37.
Art. 34. 1. W przypadku gdy zobowiązanie, o którym mowa w art. 25 pkt 4, w zakresie dotyczącym rocznej wielkości dostaw lub ciągłości dostaw, nie zostanie dotrzymane i nastąpi niezaspokojenie potrzeb świadczeniobiorców, wnioskodawca, który otrzymał decyzję administracyjną o objęciu refundacją jest obowiązany do zwrotu do Funduszu kwoty stanowiącej iloczyn liczby niedostarczonych jednostkowych opakowań leku, środka spożywczego specjalnego przeznaczenia żywieniowego albo jednostkowych wyrobów medycznych i ich urzędowej ceny zbytu netto, chyba że niewykonywanie tego zobowiązania jest następstwem działania siły wyższej albo potrzeby świadczeniobiorców zostały zaspokojone przez jego odpowiednik.
2. Przez niedotrzymanie zobowiązania dotyczącego ciągłości dostaw, o którym mowa w ust. 1, rozumie się brak obrotu produktem objętym refundacją stwierdzony na podstawie raportów, o których mowa w art. 78 ust. 1 pkt 6 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne lub informacji, o których mowa w art. 190 ust. 2 ustawy o świadczeniach.
3. Przez niedotrzymanie zobowiązania dotyczącego wielkości rocznych dostaw, o którym mowa w ust. 1, rozumie się niewprowadzenie w ciągu roku kalendarzowego do obrotu zadeklarowanej we wniosku o objęcie refundacją ilości leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego.
4. Kwotę, o której mowa w ust. 1, oblicza Fundusz na podstawie danych, o których mowa w art. 102 ust. 5 pkt 31 ustawy o świadczeniach.
5. Zestawienie kwot, o których mowa w ust. 4, Prezes Funduszu niezwłocznie przekazuje ministrowi właściwemu do spraw zdrowia.
6. Kwotę, o której mowa w ust. 1, ustala w drodze decyzji administracyjnej minister właściwy do spraw zdrowia i podlega ona uiszczeniu w terminie 30 dni od dnia, w którym decyzja stała się ostateczna.
Art. 35. 1.15) Wniosek, o którym mowa w art. 24 ust. 1 pkt 1, dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, który nie ma odpowiednika refundowanego w danym wskazaniu, wraz z analizami, o których mowa w art. 25 pkt 14 lit. c, oraz wniosek, o którym mowa w art. 24 ust. 1 pkt 1a, dla leku, który nie ma odpowiednika refundowanego w danym wskazaniu wraz z analizami, o których mowa w art. 25a pkt 14, a także wniosek, o którym mowa w art. 24 ust. 1 pkt 2, dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, który nie ma odpowiednika refundowanego w danym wskazaniu, jeżeli w uzasadnieniu wniosku są podane argumenty związane z efektem zdrowotnym, dodatkowym efektem zdrowotnym lub kosztami ich uzyskania wraz z analizami, o których mowa w art. 26 pkt 2 lit. h oraz i, minister właściwy do spraw zdrowia niezwłocznie przekazuje Prezesowi Agencji za pomocą SOLR, w celu przygotowania:
1) analizy weryfikacyjnej Agencji;
2) stanowiska Rady Przejrzystości;
3) rekomendacji Prezesa Agencji.
2. W przypadku stwierdzenia, że wniosek nie spełnia wymagań określonych w przepisach wydanych na podstawie art. 24 ust. 7 pkt 2, Prezes Agencji wzywa wnioskodawcę do uzupełnienia analiz za pomocą SOLR, wyznaczając mu 21 dni na uzupełnienie dokumentacji. Bieg terminów, o których mowa w art. 31 ust. 4 i 5, ulega zawieszeniu.
3. Analiza weryfikacyjna Agencji podlega opłacie. Opłatę wnosi się na rachunek bankowy Agencji. Opłata wynosi nie więcej niż 150 000 zł.
4.16) Prezes Agencji niezwłocznie przekazuje analizę weryfikacyjną Agencji w sprawie oceny leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego Radzie Przejrzystości oraz wnioskodawcy, a następnie publikuje ją w Biuletynie Informacji Publicznej Agencji wraz z analizami wnioskodawcy, o których mowa w art. 25 pkt 14 lit. c, art. 25a pkt 14 oraz art. 26 pkt 2 lit. h oraz i. Do tych analiz można zgłaszać uwagi w terminie 7 dni od dnia opublikowania.
5. Analiza weryfikacyjna Agencji zawiera w szczególności:
1)17) ocenę analiz, o których mowa w art. 25 pkt 14 lit. c albo art. 25a pkt 14 albo art. 26 pkt 2 lit. h oraz i;
2) przedstawienie rekomendacji refundacyjnych odnośnie wnioskowanego leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego z innych państw wraz z analizą ich uzasadnień i szczegółowych warunków objęcia refundacją;
3) warunki objęcia refundacją leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego w innych państwach z analizą szczegółowych warunków objęcia refundacją;
4) wyznaczenie wartości progowej ceny zbytu netto, przy której stosunek kosztów do uzyskiwanych efektów zdrowotnych nie jest większy od progu kosztu uzyskania dodatkowego roku życia skorygowanego o jakość, o którym mowa w art. 12 pkt 13 i art. 19 ust. 2 pkt 7, a w przypadku braku możliwości wyznaczenia tego kosztu – kosztu uzyskania dodatkowego roku życia.
6. Prezes Agencji, na podstawie stanowiska Rady Przejrzystości w sprawie oceny leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, przygotowuje rekomendację w zakresie:
1) objęcia refundacją danego leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego albo
2) niezasadności objęcia refundacją danego leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego.
7. Rekomendacja Prezesa Agencji zawiera w szczególności:
1) rozstrzygnięcie, czy lek, środek spożywczy specjalnego przeznaczenia żywieniowego oraz wyrób medyczny powinien być finansowany ze środków publicznych;
2) określenie szczegółowych warunków objęcia refundacją leku, środka spożywczego specjalnego przeznaczenia żywieniowego oraz wyrobu medycznego w zakresie:
a) wskazań, w których lek, środek spożywczy specjalnego przeznaczenia żywieniowego oraz wyrób medyczny ma być objęty refundacją,
b) sugerowanego poziomu odpłatności, o którym mowa w art. 14,
c) sugestie co do włączenia do istniejącej lub utworzenia nowej grupy limitowej, o której mowa w art. 15,
d) uwagi i propozycje do opisu programu lekowego, jeżeli dotyczy,
e) propozycje instrumentów dzielenia ryzyka, o których mowa w art. 11 ust. 5;
3) uzasadnienie zawierające:
a) wskazanie dowodów naukowych, na podstawie których została wydana rekomendacja, w tym dotyczących:
– skuteczności klinicznej i praktycznej,
– bezpieczeństwa stosowania,
– stosunku kosztów do uzyskiwanych efektów zdrowotnych dotychczas refundowanych leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych, w porównaniu z wnioskowanym,
– relacji korzyści zdrowotnych do ryzyka stosowania,
b) wskazanie istnienia alternatywnej technologii medycznej oraz jej efektywności klinicznej i bezpieczeństwa stosowania,
c) omówienie wpływu na wydatki podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych i świadczeniobiorców,
d) wskazanie i omówienie rekomendacji klinicznych oraz dotyczących finansowania ze środków publicznych danego leku, środka spożywczego specjalnego przeznaczenia żywieniowego w innych krajach,
e) wskazanie wartości progowej ceny zbytu netto, przy której stosunek kosztów do uzyskiwanych efektów zdrowotnych nie jest większy od progu kosztu uzyskania dodatkowego roku życia skorygowanego o jakość, o którym mowa w art. 12 pkt 13 i art. 19 ust. 2 pkt 7, a w przypadku braku możliwości wyznaczenia tego kosztu – kosztu uzyskania dodatkowego roku życia,
f) wskazanie czy zachodzą okoliczności, o których mowa w art. 13 ust. 3 oraz maksymalnego poziomu ceny ustalonego zgodnie z art. 13 ust. 4.
8. Prezes Agencji przekazuje ministrowi właściwemu do spraw zdrowia rekomendację za pomocą SOLR, w terminie nie dłuższym niż 60 dni od dnia otrzymania dokumentów określonych w ust. 1.
9. Minister właściwy do spraw zdrowia przekazuje Komisji, za pomocą SOLR, wniosek, o którym mowa w ust. 1, wraz z analizą weryfikacyjną Agencji, stanowiskiem Rady Przejrzystości, rekomendacją Prezesa Agencji oraz innymi dokumentami, na podstawie których przygotowana została rekomendacja, celem przeprowadzenia negocjacji warunków objęcia refundacją.
10. Minister właściwy do spraw zdrowia określi, w drodze rozporządzenia:
1) sposób i procedury przygotowania analizy weryfikacyjnej Agencji uwzględniając wiedzę z zakresu oceny technologii medycznych;
2) wysokość opłat, o których mowa w ust. 3, mając na uwadze przedmiot analizy oraz koszty przygotowania analizy weryfikacyjnej Agencji.
Art. 36.18) 1. Wnioski, o których mowa w art. 24 ust. 1, minister właściwy do spraw zdrowia przekazuje Komisji za pomocą SOLR, celem przeprowadzenia negocjacji.
2. W przypadku wniosków, o których mowa w art. 24 ust. 1 pkt 1b, Komisja zaprasza wnioskodawcę na negocjacje w terminie nie dłuższym niż miesiąc od dnia przekazania wniosku, o którym mowa w ust. 1.
3. W toku negocjacji wniosków, o których mowa w art. 24 ust. 1 pkt 1b, określane są klinicznie istotne punkty końcowe oraz ustalane są mechanizmy podziału ryzyka oparte o wyniki kliniczne.
4. W przypadku wniosków, o których mowa w art. 24 ust. 1 pkt 1a i 1b, negocjacje nie mogą trwać dłużej niż 30 dni, licząc od pierwszego dnia negocjacji. Negocjacje mogą być podzielone maksymalnie na trzy tury. W przypadku podzielenia negocjacji na tury, łączny czas trwania tur negocjacji nie może przekroczyć 30 dni, licząc od pierwszego dnia negocjacji.
5. W przypadku nieosiągnięcia porozumienia w terminie, o którym mowa w ust. 4, w szczególnie uzasadnionych przypadkach Komisja może podjąć uchwałę o skierowaniu wniosku na jedne dodatkowe negocjacje. Dodatkowe negocjacje odbywają się w terminie 10 dni od dnia podjęcia uchwały.
6. W przypadku wniosków, o których mowa w art. 24 ust. 1 pkt 1a i 1b, w braku porozumienia z wnioskodawcą Komisja podejmuje uchwałę negatywną. Wynik negocjacji wraz z jego przebiegiem, z wyjątkiem informacji stanowiących tajemnicę przedsiębiorstwa, jest zamieszczany w Biuletynie Informacji Publicznej ministra właściwego do spraw zdrowia.
Art. 37. 1. Minister właściwy do spraw zdrowia ogłasza, w drodze obwieszczenia, wykazy refundowanych:
1) leków,
2) środków spożywczych specjalnego przeznaczenia żywieniowego,
3) wyrobów medycznych
– w stosunku do których wydano ostateczne decyzje administracyjne o objęciu refundacją albo ostateczne decyzje zmieniające, o których mowa w art. 16.
2. Obwieszczenie, o którym mowa w ust. 1, zawiera:
1) dane identyfikujące lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny;
2) kategorię dostępności refundacyjnej;
3) poziom odpłatności;
4) urzędową cenę zbytu;
5) cenę detaliczną;
6) wysokość limitu finansowania dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, o którym mowa w art. 6 ust. 1 pkt 1 albo informacyjną wysokość limitu finansowania dla leków, środków spożywczych specjalnego przeznaczenia żywieniowego, o których mowa w art. 6 ust. 1 pkt 2 i 3 dostosowaną do wielkości opakowania jednostkowego;
7) wysokość dopłaty świadczeniobiorcy;
8) grupę limitową;
9) termin wejścia w życie decyzji, o której mowa w art. 11 oraz okres jej obowiązywania.
2a. Leki, środki spożywcze specjalnego przeznaczenia żywieniowego oraz wyroby medyczne przysługujące świadczeniobiorcom, o których mowa w art. 43a ust. 1 ustawy o świadczeniach, minister właściwy do spraw zdrowia ogłasza w obwieszczeniu, o którym mowa w ust. 1.
2b.19) Leki przysługujące świadczeniobiorcom, o których mowa w art. 43b ust. 1 ustawy o świadczeniach, minister właściwy do spraw zdrowia ogłasza w obwieszczeniu, o którym mowa w ust. 1.
3. W przypadku kategorii, o której mowa w art. 6 ust. 1 pkt 2, opis programu lekowego stanowi załącznik do obwieszczenia, o którym mowa w ust. 1.
4. Minister właściwy do spraw zdrowia ogłasza, w drodze obwieszczenia, wykazy:
1) leków,
2) środków spożywczych specjalnego przeznaczenia żywieniowego
– o których mowa w art. 6 ust. 1 pkt 4, w stosunku do których wydano ostateczną decyzję administracyjną o ustaleniu urzędowej ceny zbytu.
5. Obwieszczenie, o którym mowa w ust. 4, zawiera:
1) dane identyfikujące lek, środek spożywczy specjalnego przeznaczenia żywieniowego;
2) urzędową cenę zbytu.
6. Obwieszczenia, o których mowa w ust. 1 i 4, są ogłaszane raz na 2 miesiące w dzienniku urzędowym ministra właściwego do spraw zdrowia co najmniej na 7 dni przed dniem, na który ustala się wykazy, o których mowa w ust. 1 i 4.
7. Minister właściwy do spraw zdrowia przynajmniej raz w roku przekazuje Komisji Europejskiej obwieszczenia, o których mowa w ust. 1 i 4, oraz wykaz leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych, co do których wydano decyzję o zmianie decyzji o objęciu refundacją w zakresie podwyższenia urzędowej ceny zbytu, wraz z informacją o tych cenach.
8. Minister właściwy do spraw zdrowia przekazuje do systemu informacji w ochronie zdrowia, o którym mowa w ustawie z dnia 28 kwietnia 2011 r. o systemie informacji w ochronie zdrowia, dane objęte obwieszczeniem, o którym mowa w ust. 1, w terminie nie krótszym niż 10 dni przed dniem, na który ustala się wykaz, o którym mowa w ust. 1.
Art. 37a.20) W przypadku leku stosowanego w ramach programu lekowego, jako technologia lekowa o wysokiej wartości klinicznej oraz technologia lekowa o wysokim poziomie innowacyjności, dla którego:
1) uchylono decyzję administracyjną o objęciu refundacją lub
2) nie wydano kolejnej decyzji o objęciu refundacją
– wnioskodawca zapewnia bezpłatnie kontynuację leczenia świadczeniobiorcom, którzy rozpoczęli terapię przed dniem uchylenia albo wygaśnięcia decyzji.
Art. 38. 1. Świadczeniobiorcom przysługuje, na zasadach określonych w ustawie, zaopatrzenie w wyroby medyczne, na zlecenie osoby uprawnionej, oraz ich naprawa.
2. Udział środków publicznych w cenie wyrobu medycznego nie może być niższy niż kwota stanowiąca 50% jego limitu finansowania ze środków publicznych, określonego w przepisach wydanych na podstawie ust. 4.
3. Limit finansowania ze środków publicznych określony dla naprawy wyrobu medycznego może być wykorzystany przez świadczeniobiorcę do dokonania naprawy tego wyrobu w ustalonym dla niego okresie użytkowania. W przypadku dokonania naprawy i wykorzystaniu części lub całości tego limitu okres użytkowania wyrobu medycznego ulega wydłużeniu proporcjonalnie do wykorzystanej części limitu naprawy, z zaokrągleniem w dół do pełnego miesiąca.
4. Minister właściwy do spraw zdrowia określi, w drodze rozporządzenia, wykaz wyrobów medycznych wydawanych na zlecenie:
1) osoby uprawnionej,
2) pielęgniarki i położnej
– z określeniem limitów ich finansowania ze środków publicznych i wysokości udziału własnego świadczeniobiorcy w tym limicie i kryteria ich przyznawania,
3) okresy użytkowania oraz limity cen ich napraw
– uwzględniając skuteczność i bezpieczeństwo ich stosowania, sposób ich wytwarzania, oraz możliwości płatnicze podmiotu zobowiązanego do finansowania świadczeń opieki zdrowotnej ze środków publicznych.
4a.21) Zlecenia na zaopatrzenie i zlecenia naprawy są wystawiane w postaci elektronicznej, przy czym jedno zlecenie może dotyczyć wyrobu medycznego określonego tą samą grupą i liczbą porządkową, a w przypadku soczewek okularowych korekcyjnych – tą samą grupą, które zostały określone w przepisach wydanych na podstawie ust. 4.
4b. (uchylony)
4c.22) W przypadku braku dostępu do serwisów internetowych lub usług informatycznych Funduszu, o których mowa w przepisach wydanych na podstawie art. 137 ust. 2 ustawy o świadczeniach, a także w przypadku braku możliwości podpisania zlecenia w sposób, o którym mowa w ust. 4d, zlecenie wystawia się w postaci papierowej.
4d.22) Zlecenie w postaci elektronicznej wystawia się w formie dokumentu elektronicznego podpisywanego kwalifikowanym podpisem elektronicznym, podpisem zaufanym, podpisem osobistym albo z wykorzystaniem sposobu potwierdzania pochodzenia oraz integralności danych dostępnego w systemie teleinformatycznym udostępnionym bezpłatnie przez Zakład Ubezpieczeń Społecznych lub Fundusz.
5. Zlecenie na zaopatrzenie zawiera w szczególności:
1) dane świadczeniobiorcy:
a) imię albo imiona i nazwisko,
b) (uchylona)
c) numer PESEL, a w przypadku jego braku – datę urodzenia, płeć oraz serię i numer paszportu albo numer innego dokumentu stwierdzającego tożsamość,
d) informacje o uprawnieniach dodatkowych;
2) dane podmiotu, w ramach którego wystawiono zlecenie;
3) dane osoby uprawnionej do wystawienia zlecenia;
4) dane świadczeniodawcy realizującego zlecenie;
5) określenie wyrobu medycznego będącego przedmiotem zaopatrzenia wraz z uzasadnieniem obejmującym jednostkowe dane medyczne świadczeniobiorcy;
6) dodatkowe wskazania;
7) potwierdzenie uprawnienia do zaopatrzenia wnioskowanym wyrobem medycznym;
8) potwierdzenie wydania wyrobu medycznego u świadczeniodawcy, w tym dane wydanego wyrobu medycznego;
9) dane osoby odbierającej wyrób medyczny:
a) imię albo imiona i nazwisko,
b) (uchylona)
c) numer PESEL, a w przypadku jego braku – serię i numer paszportu albo numer innego dokumentu stwierdzającego tożsamość.
5a. (uchylony)
5b. (uchylony)
5c. (uchylony)
5d. (uchylony)
5e. (uchylony)
6. Zlecenie naprawy zawiera w szczególności:
1) dane świadczeniobiorcy:
a) imię albo imiona i nazwisko,
b) (uchylona)
c) numer PESEL, a w przypadku jego braku – datę urodzenia, płeć oraz serię i numer paszportu albo numer innego dokumentu potwierdzającego tożsamość;
2) określenie wyrobu medycznego będącego przedmiotem naprawy wraz z uzasadnieniem obejmującym jednostkowe dane medyczne świadczeniobiorcy;
3) dane świadczeniodawcy realizującego zlecenie;
4) potwierdzenie uprawnienia do naprawy wyrobu medycznego;
5) potwierdzenie naprawy wyrobu medycznego u świadczeniodawcy, w tym dane naprawionego wyrobu medycznego;
6) dane osoby odbierającej naprawiony wyrób medyczny:
a) imię albo imiona i nazwisko,
b) (uchylona)
c) numer PESEL, a w przypadku jego braku – serię i numer paszportu albo numer innego dokumentu stwierdzającego tożsamość.
6a. (uchylony)
6b. (uchylony)
6c.23) Zlecenie na zaopatrzenie i zlecenie naprawy w postaci papierowej wystawia się zgodnie ze wzorem określonym w przepisach wydanych na podstawie:
1) ust. 7;
2) ust. 7a, jeżeli został określony, a potwierdzenie posiadania prawa do świadczeń opieki zdrowotnej i weryfikacja zlecenia następują za pośrednictwem serwisów internetowych lub usług informatycznych Funduszu.
6d.23) Zlecenie na zaopatrzenie i zlecenie naprawy w postaci papierowej wystawiane zgodnie ze wzorem uproszczonym zawiera co najmniej numer PESEL świadczeniobiorcy, a w przypadku jego braku – datę urodzenia, płeć oraz serię i numer paszportu albo serię i numer innego dokumentu potwierdzającego tożsamość. Zlecenie na zaopatrzenie i zlecenie naprawy w postaci elektronicznej może także zawierać uproszczony zakres danych, o którym mowa w zdaniu pierwszym.
7.24) Minister właściwy do spraw zdrowia określi, w drodze rozporządzenia, szczegółowy zakres informacji zawartych w zleceniu, wzór zlecenia na zaopatrzenie w postaci papierowej oraz wzór zlecenia naprawy w postaci papierowej, uwzględniając konieczność zapewnienia prawidłowego wystawiania zleceń oraz prawidłowej ich realizacji.
7a. Minister właściwy do spraw zdrowia może określić, w drodze rozporządzenia, uproszczone wzory zlecenia na zaopatrzenie oraz uproszczone wzory zlecenia naprawy, uwzględniając specyfikę poszczególnych wyrobów medycznych oraz minimalny zakres danych zapewniający prawidłową realizację zleceń.
8. Podmiot realizujący zaopatrzenie w zakresie wyrobów medycznych jest obowiązany, w ramach kontroli, o której mowa w ustawie o świadczeniach, udostępnić podmiotowi zobowiązanemu do finansowania świadczeń ze środków publicznych, w terminie określonym przez ten podmiot, informacje o treści każdej umowy, a także inne dokumenty oraz uzgodnienia w jakiejkolwiek formie, pomiędzy podmiotem a dostawcą, których celem jest nabycie wyrobów medycznych.
9. Do wyrobów medycznych, o których mowa w ust. 1, nie stosuje się przepisów art. 3–11, art. 12 pkt 1–3, 7, 8 i 10–13, oraz art. 13–37.
10. W celu potwierdzenia zrealizowania zaopatrzenia w zakresie wyrobów medycznych, Fundusz może zwrócić się do świadczeniobiorcy o informację dotyczącą udzielonego mu świadczenia przez świadczeniodawcę.
Art. 38a. (uchylony)
Art. 38b. (uchylony)
Art. 38c. 1. Zlecenia mogą być wystawiane po uprzednim osobistym badaniu fizykalnym świadczeniobiorcy lub badaniu za pośrednictwem systemów teleinformatycznych lub systemów łączności, a w przypadku zaopatrzenia w wyroby medyczne przysługujące comiesięcznie – także na podstawie dokumentacji medycznej świadczeniobiorcy.
2. Fundusz dokonuje:
1) potwierdzenia posiadania prawa do świadczeń opieki zdrowotnej przez świadczeniobiorcę na etapie wystawiania zlecenia oraz na etapie jego przyjęcia do realizacji;
2) weryfikacji zlecenia na etapie wystawienia zlecenia.
3. Weryfikacja zlecenia i potwierdzenie posiadania prawa do świadczeń opieki zdrowotnej, o których mowa w ust. 2, odbywają się za pośrednictwem serwisów internetowych lub usług informatycznych Funduszu, o których mowa w przepisach wydanych na podstawie art. 137 ust. 2 ustawy o świadczeniach.
4. W przypadku braku dostępu do serwisów internetowych lub usług informatycznych Funduszu, o których mowa w przepisach wydanych na podstawie art. 137 ust. 2 ustawy o świadczeniach, weryfikacja zlecenia i potwierdzenie posiadania prawa do świadczeń opieki zdrowotnej na etapie wystawiania zlecenia są dokonywane w siedzibie wybranego przez świadczeniobiorcę oddziału wojewódzkiego Funduszu.
5. Weryfikacja zlecenia oznacza dokonanie:
1) sprawdzenia prawidłowości i kompletności danych zawartych w zleceniu;
2) ustalenia limitu finansowania wyrobu medycznego wskazanego w zleceniu;
3) ustalenia okresu, w którym zlecenie może zostać zrealizowane;
4) sprawdzenia innych danych, jeżeli mają wpływ na treść zlecenia;
5) nadania zleceniu indywidualnego, niepowtarzalnego numeru.
6. Weryfikacja zlecenia jest uznana za pozytywną w przypadku, gdy nie zostaną zgłoszone zastrzeżenia do weryfikowanego zlecenia lub zlecenie zostanie opatrzone informacją wskazującą na jego poprawność oraz zostanie ustalony limit finansowania ze środków publicznych wyrobu medycznego wskazanego w zleceniu.
6a.25) W przypadku wystawienia zlecenia w postaci elektronicznej świadczeniodawca przekazuje świadczeniobiorcy informację o wystawionym zleceniu zawierającą następujące dane:
1) identyfikator składający się z maksymalnie 20 znaków generowany w momencie zapisu zlecenia przez system serwisów internetowych lub usług informatycznych Funduszu, o których mowa w przepisach wydanych na podstawie art. 137 ust. 2 ustawy o świadczeniach, umożliwiający dostęp do zlecenia, zwany dalej „identyfikatorem zlecenia”;
2) numer składający się z czterech cyfr generowany w momencie zapisu zlecenia przez system serwisów internetowych lub usług informatycznych Funduszu, o których mowa w przepisach wydanych na podstawie art. 137 ust. 2 ustawy o świadczeniach, umożliwiający dostęp do zlecenia w połączeniu z identyfikatorem zlecenia, o którym mowa w pkt 1, zwany dalej „kodem dostępu”;
3) datę wystawienia zlecenia;
4) imię i nazwisko świadczeniobiorcy;
5) imię i nazwisko osoby wystawiającej zlecenie;
6) numer prawa wykonywania zawodu osoby wystawiającej zlecenie;
7) numer telefonu do bezpośredniego kontaktu z osobą wystawiającą zlecenie;
8) określenie wyrobu medycznego będącego przedmiotem zaopatrzenia.
6b.25) Informację, o której mowa w ust. 6a, świadczeniobiorca otrzymuje:
1) na wskazany w systemie informacji w ochronie zdrowia adres poczty elektronicznej, jeżeli dotyczy;
2) na wskazany w systemie informacji w ochronie zdrowia numer telefonu, w postaci wiadomości zawierającej co najmniej identyfikator zlecenia oraz kod dostępu – na żądanie pacjenta wyrażone w Internetowym Koncie Pacjenta, o którym mowa w art. 7a ust. 1 ustawy z dnia 28 kwietnia 2011 r. o systemie informacji w ochronie zdrowia;
3) w postaci wydruku – w przypadku braku w systemie informacji w ochronie zdrowia danych, o których mowa w pkt 1 i 2, oraz na żądanie pacjenta, albo w innej uzgodnionej postaci zawierającej co najmniej identyfikator zlecenia i kod dostępu oraz określenie wyrobu medycznego będącego przedmiotem zaopatrzenia.
7.26) Realizacja zlecenia w postaci papierowej rozpoczyna się z dniem przyjęcia przez świadczeniodawcę zlecenia do realizacji, a kończy z dniem wydania wyrobu medycznego. W przypadku zlecenia w postaci elektronicznej za dzień przyjęcia przez świadczeniodawcę zlecenia do realizacji rozumie się dzień, w którym udostępniono świadczeniodawcy identyfikator zlecenia oraz kod dostępu.27)
8. O przyjęciu zlecenia do realizacji świadczeniodawca informuje Fundusz za pośrednictwem serwisów internetowych lub usług informatycznych Funduszu, o których mowa w przepisach wydanych na podstawie art. 137 ust. 2 ustawy o świadczeniach, a w przypadku braku dostępu do nich – niezwłocznie po usunięciu tej przeszkody.
9. Przyjęcie do realizacji zlecenia może nastąpić wyłącznie w przypadku pozytywnej weryfikacji zlecenia, o której mowa w ust. 6.
10. Świadczeniodawca, który przyjął do realizacji zlecenie, jest obowiązany do sprawdzenia:
1) braku upływu okresu, w którym zlecenie może zostać zrealizowane;
2) wieku świadczeniobiorcy, jeżeli ma wpływ na limit finansowania ustalony zgodnie z ust. 6.
3) (uchylony)
4) (uchylony)
11. Świadczeniodawca w toku czynności, o której mowa w ust. 10 pkt 2, jest obowiązany do dokonania zmiany ustalonego limitu finansowania ze środków publicznych wyrobu medycznego wskazanego w zleceniu, która doprowadzi do zapewnienia zgodności tego limitu ze stanem prawnym i faktycznym na dzień przyjęcia zlecenia do realizacji. Zmiana ta jest dokonywana przez świadczeniodawcę za pośrednictwem serwisów internetowych lub usług informatycznych Funduszu, o których mowa w przepisach wydanych na podstawie art. 137 ust. 2 ustawy o świadczeniach, a w przypadku braku dostępu do nich – przez świadczeniodawcę samodzielnie.
12. Jeżeli świadczeniodawcy realizującemu zlecenie zostanie przedstawiony dokument potwierdzający uprawnienia dodatkowe świadczeniobiorcy, przysługujące mu w dniu przyjęcia zlecenia do realizacji, zlecenie realizuje się z uwzględnieniem tych uprawnień. Upływ wskazanego na zleceniu terminu ważności dokumentu potwierdzającego uprawnienia dodatkowe powoduje realizację zlecenia bez uwzględnienia tych uprawnień.
13. Jeżeli limit finansowania ze środków publicznych wyrobu medycznego lub sposób realizacji zależą od uprawnień dodatkowych świadczeniobiorcy, zlecenie może zostać zrealizowane na warunkach je uwzględniających, do dnia upływu wskazanego na zleceniu terminu ważności dokumentu potwierdzającego te uprawnienia lub do dnia porodu, jednak nie później niż do dnia upływu terminu określonego w art. 38d ust. 1 albo 3.
14. (uchylony)
15. Do potwierdzenia prawa do świadczeń stosuje się odpowiednio art. 50 ustawy o świadczeniach.
16. W przypadku świadczeniobiorców małoletnich oraz innych osób nieposiadających pełnej zdolności do czynności prawnych lub innych osób niemogących wyrazić swojej woli z powodu stanu zdrowia oświadczenie, o którym mowa w art. 50 ust. 6 ustawy o świadczeniach, składa ich przedstawiciel ustawowy, opiekun prawny, pełnomocnik albo opiekun faktyczny w rozumieniu ustawy z dnia 6 listopada 2008 r. o prawach pacjenta i Rzeczniku Praw Pacjenta (Dz. U. z 2020 r. poz. 849), podając imię i nazwisko, numer PESEL oraz wskazanie dokumentu, na podstawie którego świadczeniodawca potwierdził tożsamość osoby składającej oświadczenie, a w przypadku osób nieposiadających numeru PESEL – dane, o których mowa w art. 188 ust. 4 pkt 9 ustawy o świadczeniach.
17. W przypadku działania przez pełnomocnika pełnomocnictwo albo jego kopię dołącza się do realizowanego zlecenia.
18. Do weryfikacji zlecenia i potwierdzania posiadania prawa do świadczeń opieki zdrowotnej, o których mowa w ust. 2, nie stosuje się przepisów ustawy z dnia 14 czerwca 1960 r. – Kodeks postępowania administracyjnego.
Art. 38d. 1. Zlecenia na zaopatrzenie w wyroby medyczne są wystawiane na okres nie dłuższy niż 12 kolejnych miesięcy kalendarzowych od dnia wystawienia.
2. Zlecenia na zaopatrzenie w wyroby medyczne, z wyłączeniem zleceń na wyroby medyczne przysługujące comiesięcznie, w tym ich kontynuacji, mogą zostać wystawione ze wskazaniem daty, po której mogą zostać zrealizowane, jednakże nie wcześniej niż na 30 dni przed upływem okresu użytkowania poprzednio wydanego wyrobu medycznego tożsamego ze wskazanym w zleceniu. Realizacja zlecenia może nastąpić po upływie okresu użytkowania poprzednio wydanego wyrobu medycznego tożsamego ze wskazanym w zleceniu.
3. Zlecenia na zaopatrzenie w wyroby medyczne przysługujące comiesięcznie, w tym ich kontynuacja, są wystawiane na okres nie dłuższy niż 6 kolejnych miesięcy kalendarzowych od dnia ich wystawienia. W przypadku gdy weryfikacja zlecenia odbyła się za pośrednictwem serwisów internetowych lub usług informatycznych Funduszu, o których mowa w przepisach wydanych na podstawie art. 137 ust. 2 ustawy o świadczeniach, stosuje się ust. 1.
4. Zlecenia na zaopatrzenie w wyroby medyczne przysługujące comiesięcznie, w tym ich kontynuacja, wystawione na więcej niż jeden miesiąc kalendarzowy mogą być realizowane częściami obejmującymi okresy nie krótsze niż miesiąc i nie dłuższe niż 6 miesięcy.
5. Zlecenia na zaopatrzenie w wyroby medyczne przysługujące comiesięcznie, w tym ich kontynuacja, są realizowane wyłącznie w miesiącach, na które zostały wystawione, z wyłączeniem miesięcy, które upłynęły.
6. W przypadku gdy zlecenie przyjęte do realizacji nie może zostać zrealizowane, świadczeniodawca zwraca, o ile to możliwe, zlecenie świadczeniobiorcy albo osobie działającej w jego imieniu lub na jego rzecz.
7. Świadczeniodawca jest obowiązany do niezwłocznego poinformowania Funduszu, za pośrednictwem serwisów internetowych lub usług informatycznych Funduszu, o których mowa w przepisach wydanych na podstawie art. 137 ust. 2 ustawy o świadczeniach, a w przypadku braku dostępu do nich – niezwłocznie po usunięciu tej przeszkody, o zamiarze dokonania zwrotu zlecenia.
8. Zlecenie może zostać anulowane przez Fundusz:
1) na wniosek świadczeniobiorcy, którego dotyczy, albo na wniosek osoby działającej w jego imieniu i na jego rzecz, jeżeli nie zostało przyjęte do realizacji;
2) z urzędu, jeżeli na taki sam wyrób medyczny i takie same warunki realizacji zostało przyjęte do realizacji kolejne zlecenie, a zlecenie bezpośrednio poprzedzające wystawione na taki sam wyrób medyczny i na takie same warunki realizacji nie zostało przyjęte do realizacji;
3) z urzędu, jeżeli świadczeniodawca w przypadku, o którym mowa w ust. 6, nie dokonał zwrotu zlecenia świadczeniobiorcy albo osobie działającej w jego imieniu lub na jego rzecz lub nie dopełnił czynności, o której mowa w ust. 7.
9. Zlecenie może zostać anulowane przez osobę uprawnioną, na wniosek świadczeniobiorcy, jeżeli nie zostało przyjęte do realizacji.
10. O anulowaniu zlecenia z urzędu i jego przyczynie Fundusz niezwłocznie informuje świadczeniobiorcę.
11. Do anulowania zlecenia nie stosuje się przepisów ustawy z dnia 14 czerwca 1960 r. – Kodeks postępowania administracyjnego.
12.28) Po zakończeniu realizacji zlecenia świadczeniodawca realizujący zlecenie w postaci papierowej przechowuje zlecenie wraz z dokumentacją potwierdzającą dokonanie jego realizacji przez 5 lat od dnia zakończenia realizacji zlecenia.
12a.29) Po zakończeniu realizacji, zlecenia w postaci elektronicznej przechowywane są przez serwisy internetowe lub usługi informatyczne Funduszu przez okres co najmniej 5 lat od dnia zakończenia realizacji zlecenia.
13. Przechowywanie i udostępnianie zlecenia wraz z dokumentacją, o których mowa w ust. 12, przez świadczeniodawcę, realizującego zlecenie odbywa się zgodnie z przepisami rozporządzenia Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r. w sprawie ochrony osób fizycznych w związku z przetwarzaniem danych osobowych i w sprawie swobodnego przepływu takich danych oraz uchylenia dyrektywy 95/46/WE (ogólne rozporządzenie o ochronie danych) (Dz. Urz. UE L 119 z 04.05.2016, str. 1, z późn. zm.30)).
14. (uchylony)31)
Art. 39. 1. Lek nieposiadający pozwolenia na dopuszczenie do obrotu lub niedostępny w obrocie na terytorium Rzeczypospolitej Polskiej i sprowadzany z zagranicy na warunkach i w trybie określonych w art. 4 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne oraz środek spożywczy specjalnego przeznaczenia żywieniowego, o którym mowa w art. 29a ustawy z dnia 25 sierpnia 2006 r. o bezpieczeństwie żywności i żywienia, mogą być wydawane po wniesieniu przez świadczeniobiorcę opłaty ryczałtowej, o której mowa w art. 6 ust. 2 pkt 2, za opakowanie jednostkowe, pod warunkiem wydania zgody na ich refundację przez ministra właściwego do spraw zdrowia.
2. Minister właściwy do spraw zdrowia rozpatruje wniosek o refundację produktów, o których mowa w ust. 1, w terminie nie dłuższym niż 30 dni od dnia wystąpienia o ich refundację przez świadczeniobiorcę.
3. W celu zbadania zasadności wydawania zgody na refundację, o której mowa w ust. 1, dla danego leku lub środka spożywczego specjalnego przeznaczenia żywieniowego, minister właściwy do spraw zdrowia może wystąpić do Prezesa Agencji o wydanie rekomendacji w sprawie zasadności refundacji tego leku lub środka spożywczego specjalnego przeznaczenia żywieniowego w określonym wskazaniu. Przepisy art. 31g i art. 31h ustawy o świadczeniach stosuje się odpowiednio.
3a. W przypadku wystąpienia ministra właściwego do spraw zdrowia do Prezesa Agencji o wydanie rekomendacji, o której mowa w ust. 3, bieg terminu na rozpatrzenie sprawy ulega zawieszeniu do dnia otrzymania przez ministra właściwego do spraw zdrowia tej rekomendacji.
3b. Rekomendacja, o której mowa w ust. 3, jest ważna przez okres 3 lat i ma zastosowanie również do innych leków zawierających tę samą substancję czynną oraz zbliżoną postać farmaceutyczną, a także do środków spożywczych specjalnego przeznaczenia żywieniowego o składzie identycznym z ocenianym środkiem.
3c. Minister właściwy do spraw zdrowia, rozpatrując wniosek, o którym mowa w ust. 1, bierze pod uwagę kryteria, o których mowa w art. 12 pkt 3–6 i pkt 8–10, rekomendację Prezesa Agencji, o której mowa w ust. 3, jeżeli została wydana oraz inne opinie, a w szczególności opinie konsultantów krajowych lub wojewódzkich, uzyskane w trakcie rozpatrywania wniosku, o którym mowa w ust. 1.
3d. W przypadku leku posiadającego dopuszczenie do obrotu na terytorium Rzeczypospolitej Polskiej a niedostępnego w obrocie na terytorium Rzeczypospolitej Polskiej zgoda, o której mowa w ust. 1, może być wydawana na okres nie dłuższy niż jeden rok, licząc od dnia wpłynięcia pierwszego wniosku dla danego leku lub środka spożywczego specjalnego przeznaczenia żywieniowego. Powyższe nie dotyczy sytuacji kontynuacji leczenia finansowanego dotychczas ze środków publicznych danym lekiem lub środkiem spożywczym specjalnego przeznaczenia żywieniowego w określonym wskazaniu u danego pacjenta.
3e. Minister właściwy do spraw zdrowia odmawia wydania zgody, o której mowa ust. 1, w odniesieniu do leku lub środka spożywczego specjalnego przeznaczenia żywieniowego w danym wskazaniu, w przypadku gdy:
1) z rekomendacji, o której mowa w ust. 3, wynika, że nie jest zasadne ich finansowanie ze środków publicznych w tym wskazaniu;
2) została wydana rekomendacja, o której mowa w art. 35 ust. 6 pkt 2, w odniesieniu do substancji czynnej zawartej w tym leku albo w odniesieniu do tego środka spożywczego specjalnego przeznaczenia żywieniowego w tym wskazaniu;
3) została wydana decyzja o odmowie objęcia refundacją i ustalenia urzędowej ceny zbytu, o której mowa w art. 11, w odniesieniu do substancji czynnej zawartej w tym leku albo w odniesieniu do tego środka spożywczego specjalnego przeznaczenia żywieniowego w tym wskazaniu;
4) upłynął okres, o którym mowa w ust. 3d;
5) wniosek dotyczy leku, dla którego można zastosować procedurę opisaną w art. 4b ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne.
3f. Odmowa wydania zgody, o której mowa w ust. 3e, nie dotyczy sytuacji kontynuacji leczenia finansowanego dotychczas ze środków publicznych danym lekiem lub środkiem spożywczym specjalnego przeznaczenia żywieniowego w określonym wskazaniu u danego pacjenta.
3g. W przypadku gdy do ministra właściwego do spraw zdrowia wpłynie więcej niż 10 wniosków o wyrażenie zgody na refundację leku zawierającego określoną substancję czynną lub środka spożywczego specjalnego przeznaczenia żywieniowego o określonym składzie w danym wskazaniu uzyskanie rekomendacji, o której mowa w ust. 3, jest obowiązkowe.
4. Minister właściwy do spraw zdrowia, uwzględniając rekomendację, o której mowa w art. 31h ust. 3 ustawy o świadczeniach, może umieścić produkty, o których mowa w ust. 1, w wykazie, o którym mowa w ust. 5.
5. Minister właściwy do spraw zdrowia może określić, w drodze rozporządzenia, wykaz leków i środków spożywczych specjalnego przeznaczenia żywieniowego, które nie mogą być refundowane w trybie, o którym mowa w ust. 1, mając na uwadze rekomendację Prezesa Agencji oraz zapewnienie bezpieczeństwa zdrowotnego pacjentów.
Art. 40. 1. Jeżeli jest to niezbędne dla ratowania zdrowia i życia świadczeniobiorców, minister właściwy do spraw zdrowia, po zasięgnięciu opinii Rady Przejrzystości oraz konsultanta krajowego w odpowiedniej dziedzinie medycyny, może wydać z urzędu, przy uwzględnieniu:
1) kryteriów, o których mowa w art. 12 pkt 4–6, 9, 10, 12 i 13,
2) stosunku kosztów do uzyskiwanych efektów zdrowotnych
– decyzję administracyjną o objęciu refundacją leku przy danych klinicznych, w zakresie wskazań do stosowania lub dawkowania, lub sposobu podawania odmiennych niż określone w Charakterystyce Produktu Leczniczego w rozumieniu ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne.
2. Opinię, o której mowa w ust. 1, Rada Przejrzystości wydaje w terminie 14 dni biorąc pod uwagę w szczególności istotność stanu klinicznego, w którym ma być stosowany lek.
3. Opinie, o których mowa w ust. 1, są wydawane w odniesieniu do substancji czynnej w określonym wskazaniu i są ważne przez okres 3 lat.
4. W terminie 30 dni przed upływem terminu obowiązywania poprzedniej opinii, o której mowa w ust. 1, Rada Przejrzystości oraz konsultant krajowy w odpowiedniej dziedzinie medycyny wydają kolejną opinię w odniesieniu do danej substancji czynnej w określonym wskazaniu, chyba że:
1) minister właściwy do spraw zdrowia przekaże Prezesowi Agencji lub konsultantowi krajowemu w odpowiedniej dziedzinie medycyny informację o zamiarze odstąpienia od refundacji w tym wskazaniu lub
2) dane wskazanie zostanie ujęte w Charakterystyce Produktu Leczniczego.
5. Prezes Agencji publikuje w Biuletynie Informacji Publicznej Agencji opinię Rady Przejrzystości, o której mowa w ust. 1, wraz z określeniem terminu jej ważności łącznie z materiałami, na podstawie których została wydana.
6. Minister właściwy do spraw zdrowia publikuje w Biuletynie Informacji Publicznej opinię konsultanta krajowego w odpowiedniej dziedzinie medycyny, o której mowa w ust. 1, wraz z określeniem terminu jej ważności.
Art. 40a.32) 1. Minister właściwy do spraw zdrowia może wydać decyzję o objęciu refundacją i ustaleniu urzędowej ceny zbytu dla technologii lekowej o wysokim poziomie innowacyjności, w przypadku gdy wnioskodawca nie złożył dotychczas wniosku o objęcie refundacją i ustalenie urzędowej ceny zbytu dla danego leku w tym wskazaniu.
2. Ustalenie poziomu innowacyjności technologii lekowych stosowanych w onkologii lub chorobach rzadkich oraz ustalenie danych gromadzonych w rejestrze medycznym, w tym między innymi wskaźników oceny efektywności terapii i oczekiwanych korzyści zdrowotnych dokonywane jest przez Agencję w formie wykazu technologii lekowej o wysokim poziomie innowacyjności nie rzadziej niż raz do roku. Agencja określa populację docelową oraz szczegółowe warunki stosowania technologii lekowych o wysokim poziomie innowacyjności.
3. Agencja przekazuje ministrowi właściwemu do spraw zdrowia i publikuje w Biuletynie Informacji Publicznej wykaz, o którym mowa w ust. 2.
4. Agencja ustala poziom innowacyjności oraz zasady tworzenia wykazu, o którym mowa w ust. 2, uwzględniając wiedzę z zakresu oceny technologii medycznych, w szczególności oczekiwane efekty zdrowotne, biorąc pod uwagę między innymi siłę interwencji, jakość danych naukowych, niezaspokojoną potrzebę zdrowotną, wielkość populacji docelowej oraz priorytety zdrowotne.
5. Minister właściwy do spraw zdrowia, po zasięgnięciu opinii Rady Przejrzystości, konsultantów krajowych z danej dziedziny medycyny oraz Rzecznika Praw Pacjenta, publikuje na swojej stronie internetowej oraz w Biuletynie Informacji Publicznej listę technologii o wysokim poziomie innowacyjności na podstawie wykazu technologii lekowej o wysokim poziomie innowacyjności przekazanego przez Agencję. Minister właściwy do spraw zdrowia informuje podmioty odpowiedzialne, których technologie lekowe znajdują się na tej liście, o możliwości złożenia wniosku, o którym mowa w art. 24 ust. 1 pkt 1b.
6. Objęte refundacją technologie lekowe o wysokim poziomie innowacyjności podlegają w warunkach rzeczywistych opieki zdrowotnej porównaniu przez Agencję z alternatywnymi sposobami postępowania medycznego pod względem skuteczności i działań niepożądanych w oparciu o analizy danych otrzymane od podmiotu zobowiązanego do finansowania świadczeń opieki zdrowotnej ze środków publicznych.
7. Na 90 dni przed zakończeniem okresu refundacji technologii lekowej o wysokim poziomie innowacyjności Agencja publikuje raport z oceny efektywności objętych refundacją technologii lekowych o wysokim poziomie innowacyjności oraz jakości leczenia w oparciu o dane z rejestrów medycznych.
8. Ustalenie technologii lekowych o wysokiej wartości klinicznej oraz ustalenie danych gromadzonych w rejestrze medycznym, w tym wskaźników oceny efektywności terapii i oczekiwanych korzyści zdrowotnych, jest dokonywane przez Agencję jednorazowo w formie wykazu technologii lekowej o wysokiej wartości klinicznej. Do wykazu stosuje się odpowiednio przepisy ust. 3–5.
Rozdział 6
Apteki i osoby uprawnione
Art. 41. 1. W celu realizacji świadczeń, o których mowa w art. 15 ust. 2 pkt 14, 17 i 18 ustawy o świadczeniach, podmiot prowadzący aptekę zawiera umowę z Funduszem na wydawanie refundowanego leku, środka spożywczego specjalnego przeznaczenia żywieniowego oraz wyrobu medycznego na receptę, zwaną dalej „umową na realizację recept”.
2. Umowa na realizację recept określa w szczególności:
1) imię i nazwisko osoby będącej kierownikiem apteki;
2) wskazanie adresu prowadzenia apteki;
3) zobowiązanie do stosowania limitów, cen oraz odpłatności i dopłat świadczeniobiorcy w wysokości określonej w obwieszczeniu, o którym mowa w art. 37;
4) kary umowne;
5) warunki jej wypowiedzenia albo rozwiązania.
3. Umowa na realizację recept jest zawierana odrębnie dla każdej apteki na czas nieokreślony. Umowa podpisywana jest również przez kierownika apteki.
4. W celu zawarcia umowy na realizację recept podmiot prowadzący aptekę przedstawia następujące dokumenty:
1) kopię zezwolenia na prowadzenie apteki;
2) kopie dokumentów uprawniających kierownika apteki do pełnienia tej funkcji;
3) aktualną ewidencję osób zatrudnionych w aptece wraz z numerami dokumentów uprawniających do wykonywania zawodu;
4) numer rachunku bankowego podmiotu prowadzącego aptekę.
4a. W celu obsługi umów na realizację recept, Fundusz jest uprawniony do przetwarzania danych osobowych osób, o których mowa w ust. 4 pkt 3.
5. Fundusz nie może odmówić zawarcia umowy na realizację recept, z zastrzeżeniem ust. 7. Do zawierania umowy nie stosuje się przepisów o zamówieniach publicznych.
6. Fundusz rozwiązuje umowę na realizację recept ze skutkiem natychmiastowym w przypadku:
1) uniemożliwiania czynności kontrolnych;
2) niewykonania w terminie zaleceń pokontrolnych.
7. Fundusz nie zawiera kolejnej umowy przez okres:
1) jednego roku w przypadku pierwszego rozwiązania umowy, o którym mowa w ust. 6;
2) trzech lat w przypadku drugiego rozwiązania umowy, o którym mowa w ust. 6.
8. Minister właściwy do spraw zdrowia określi, w drodze rozporządzenia, ogólne warunki umów na realizację recept oraz ramowy wzór umowy na realizację recept, kierując się koniecznością zapewnienia właściwej ich realizacji.
Art. 42. 1. Podmiotowi prowadzącemu aptekę, który zawarł umowę na realizację recept, przysługuje zażalenie na czynności dyrektora wojewódzkiego oddziału Funduszu dotyczące realizacji umowy.
2. Zażalenie, o którym mowa w ust. 1, składa się wraz z uzasadnieniem za pośrednictwem właściwego miejscowo oddziału wojewódzkiego Funduszu w terminie 14 dni od dnia dokonania czynności przez dyrektora oddziału wojewódzkiego Funduszu.
3. Zażalenie, o którym mowa w ust. 1, rozpatruje, w terminie 14 dni od dnia jego otrzymania, Prezes Funduszu.
4. Prezes Funduszu, uwzględniając zażalenie w części lub w całości, nakłada na dyrektora oddziału wojewódzkiego Funduszu obowiązek usunięcia stwierdzonych nieprawidłowości, w szczególności przez uchylenie czynności, której dotyczy zażalenie, i zawiadamia podmiot prowadzący aptekę w terminie 7 dni od uwzględnienia zażalenia. Stanowisko Prezesa Funduszu jest ostateczne.
5. (uchylony)
6. (uchylony)
7. (uchylony)
Art. 43. 1. Apteka w celu realizacji świadczeń objętych umową na realizację recept ma obowiązek:
1) zapewnić świadczeniobiorcy dostępność leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych, objętych wykazami o których mowa w art. 37;
2) gromadzić i przekazywać Funduszowi, rzetelne i zgodne ze stanem faktycznym na dzień przekazania, informacje zawarte w treści poszczególnych zrealizowanych recept na refundowane leki, środki spożywcze specjalnego przeznaczenia żywieniowego, wyroby medyczne;
3) udostępniać do kontroli prowadzonej przez podmiot zobowiązany do finansowania świadczeń ze środków publicznych dokumentację, którą apteka jest obowiązana prowadzić w związku z realizacją umowy, i udzielać wyjaśnień w zakresie związanym z realizacją recept podlegających refundacji;
4) udostępnić do kontroli podmiotowi zobowiązanemu do finansowania świadczeń opieki zdrowotnej ze środków publicznych, w terminie określonym przez ten podmiot, informacje o treści każdej umowy, w tym także uzgodnienia dokonanego w jakiejkolwiek formie, pomiędzy apteką a hurtownią farmaceutyczną, których celem jest nabycie leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych;
5) zamieścić, w widocznym i łatwo dostępnym miejscu, informację o zawarciu umowy na realizację recept oraz informację, o której mowa w art. 44 ust. 1;
6) zwrotu refundacji ceny leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego łącznie z odsetkami ustawowymi za opóźnienie liczonymi od dnia, w którym wypłacono refundację do dnia jej zwrotu, w terminie 14 dni od dnia otrzymania wezwania do zapłaty, jeżeli w wyniku weryfikacji lub kontroli informacji, o których mowa w pkt 2, lub kontroli, o której mowa w pkt 3 i 4, zostanie stwierdzone, że realizacja recepty nastąpiła z naruszeniem przepisów ustawy, przepisów o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych, przepisów ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne oraz przepisów o zawodach lekarza i lekarza dentysty;
7) przechowywać recepty na refundowane leki, środki spożywcze specjalnego przeznaczenia żywieniowego, wyroby medyczne wraz z otaksowaniem przez okres 5 lat, liczonych od zakończenia roku kalendarzowego, w którym nastąpiła refundacja.
2. W razie stwierdzenia w trakcie czynności kontrolnych nieprawidłowości innych niż naruszenie obowiązków, o których mowa w ust. 1, podmiot zobowiązany do finansowania świadczeń ze środków publicznych niezwłocznie powiadamia o tym fakcie wojewódzkiego inspektora farmaceutycznego.
3. W przypadku stwierdzenia w wyniku kontroli, o której mowa w ust. 1 pkt 4, naruszenia przepisów art. 49, podmiot zobowiązany do finansowania świadczeń ze środków publicznych niezwłocznie powiadamia o tym fakcie ministra właściwego do spraw zdrowia oraz wojewódzkiego inspektora farmaceutycznego.
Art. 44. 1. Osoba wydająca leki, środki spożywcze specjalnego przeznaczenia żywieniowego, wyroby medyczne objęte refundacją ma obowiązek poinformować świadczeniobiorcę o możliwości nabycia leku objętego refundacją, innego niż lek przepisany na recepcie, o tej samej nazwie międzynarodowej, dawce, postaci farmaceutycznej, która nie powoduje powstania różnic terapeutycznych, i o tym samym wskazaniu terapeutycznym, którego cena detaliczna nie przekracza limitu finansowania ze środków publicznych oraz ceny detalicznej leku przepisanego na recepcie. Apteka ma obowiązek zapewnić dostępność tego leku.
2. Osoba wydająca leki, środki spożywcze specjalnego przeznaczenia żywieniowego oraz wyroby medyczne objęte refundacją ma obowiązek, na żądanie świadczeniobiorcy, wydać lek, o którym mowa w ust. 1, którego cena detaliczna jest niższa niż cena leku przepisanego na recepcie.
2a. Osoba wydająca leki, środki spożywcze specjalnego przeznaczenia żywieniowego oraz wyroby medyczne objęte refundacją ma obowiązek, na żądanie świadczeniobiorcy, po uprzednim spełnieniu obowiązku, o którym mowa w ust. 1, wydać lek inny niż lek przepisany na recepcie, o tej samej nazwie międzynarodowej, dawce, postaci farmaceutycznej, która nie powoduje powstania różnic terapeutycznych, i o tym samym wskazaniu terapeutycznym, którego cena detaliczna jest równa lub wyższa od ceny leku przepisanego na recepcie.
2b. Osoba wydająca leki, środki spożywcze specjalnego przeznaczenia żywieniowego oraz wyroby medyczne objęte refundacją może na żądanie świadczeniobiorcy, po uprzednim spełnieniu obowiązku, o którym mowa w ust. 1, wydać lek nieobjęty refundacją, inny niż lek przepisany na recepcie, o tej samej nazwie międzynarodowej, dawce oraz o postaci farmaceutycznej, która nie powoduje powstania różnic terapeutycznych, za 100% odpłatnością.
2c. Osoba wydająca leki, środki spożywcze specjalnego przeznaczenia żywieniowego oraz wyroby medyczne objęte refundacją może wydać lek w opakowaniu zawierającym różną – o maksymalnie 10%, liczbę dawek niż określona na recepcie.
2d. Przepisy ust. 2–2c nie dotyczą sytuacji, w której osoba uprawniona umieściła odpowiedni wpis w recepcie – w przypadku recepty w postaci elektronicznej, lub adnotację na druku recepty – w przypadku recepty w postaci papierowej, wskazując na niemożność dokonania zamiany przepisanego leku.
3. Przepisy ust. 1–2d stosuje się odpowiednio do środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych.
Art. 44a. 1. W przypadku recepty wystawionej dla świadczeniobiorcy, który ukończył 75. rok życia, przez osoby wskazane w art. 43a ust. 1 i 1a ustawy o świadczeniach, osoba wydająca leki, środki spożywcze specjalnego przeznaczenia żywieniowego oraz wyroby medyczne, oprócz obowiązków wynikających z art. 44, ma obowiązek poinformować świadczeniobiorcę o możliwości nabycia leku innego niż lek przepisany na recepcie, o tej samej nazwie międzynarodowej, dawce, postaci farmaceutycznej, która nie powoduje powstania różnic terapeutycznych, i o tym samym wskazaniu terapeutycznym, objętego wykazem, o którym mowa w art. 37 ust. 1, w części dotyczącej bezpłatnego zaopatrzenia świadczeniobiorców po ukończeniu 75. roku życia oraz ma obowiązek na żądanie świadczeniobiorcy wydać ten lek.
2. W przypadku zbiegu uprawnień, o których mowa w art. 43–45 ustawy o świadczeniach oraz w art. 7a ust. 1 pkt 2 ustawy z dnia 19 czerwca 1997 r. o zakazie stosowania wyrobów zawierających azbest (Dz. U. z 2020 r. poz. 1680), osoba wydająca leki, środki spożywcze specjalnego przeznaczenia żywieniowego oraz wyroby medyczne ma obowiązek wydać lek lub środek spożywczy specjalnego przeznaczenia żywieniowego z najniższą wysokością dopłaty.
3. Przepis ust. 1 nie dotyczy sytuacji, w której osoba uprawniona umieściła odpowiedni wpis w recepcie – w przypadku recepty w postaci elektronicznej, lub adnotację na druku recepty – w przypadku recepty w postaci papierowej, wskazując na niemożność dokonania zamiany przepisanego leku.
4. Przepisy art. 44 ust. 1–2d stosuje się odpowiednio.
Art. 44b.33) 1. W przypadku recepty wystawionej dla świadczeniobiorcy w okresie ciąży przez osoby wskazane w art. 43b ust. 3 ustawy o świadczeniach, osoba wydająca leki, oprócz obowiązków wynikających z art. 44, ma obowiązek poinformować świadczeniobiorcę o możliwości nabycia leku innego niż lek przepisany na recepcie, o tej samej nazwie międzynarodowej, dawce, postaci farmaceutycznej, która nie powoduje powstania różnic terapeutycznych, i o tym samym wskazaniu terapeutycznym, objętego wykazem, o którym mowa w art. 37 ust. 1, w części dotyczącej bezpłatnego zaopatrzenia świadczeniobiorców w okresie ciąży oraz ma obowiązek na żądanie świadczeniobiorcy wydać ten lek.
2. Przepis ust. 1 nie dotyczy sytuacji, w której osoba uprawniona umieściła odpowiedni wpis w recepcie – w przypadku recepty w postaci elektronicznej, lub adnotację na druku recepty – w przypadku recepty w postaci papierowej, wskazując na niemożność dokonania zamiany przepisanego leku.
3. Przepisy art. 44 ust. 1–2d stosuje się odpowiednio.
Art. 45. 1. Apteki gromadzą informacje zawierające dane o obrocie lekami, środkami spożywczymi specjalnego przeznaczenia żywieniowego, wyrobami medycznymi objętymi refundacją, wynikające ze zrealizowanych recept wystawionych przez osobę uprawnioną.
2. Dane są gromadzone i przechowywane w formie elektronicznej oraz przekazywane w formie komunikatów elektronicznych, oddziałowi wojewódzkiemu Funduszu, właściwemu ze względu na siedzibę apteki. Komunikaty te są przekazywane w formacie zgodnym ze wzorem zamieszczonym w Biuletynie Informacji Publicznej ministra właściwego do spraw zdrowia.
2a. W komunikatach elektronicznych zamieszcza się także dane wynikające z realizacji recept w przypadku, o którym mowa w art. 96 ust. 1d ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne.
3. Przekazywanie komunikatów elektronicznych obejmuje następujące fazy:
1) przygotowanie komunikatu przez aptekę, sprawdzenie jego kompletności i poprawności oraz jego terminowe przekazanie;
2) weryfikację komunikatu przez Fundusz oraz przygotowanie i przekazanie komunikatu zwrotnego zawierającego wynik wstępnej analizy poprawności danych oraz projektu zestawienia zbiorczego;
3) poprawianie lub usuwanie przez aptekę, w drodze korekty, błędów albo innych nieprawidłowości wykazanych w komunikacie zwrotnym i ponowne przekazanie komunikatu elektronicznego.
3a. Za błędy albo inne nieprawidłowości wykazane w komunikatach elektronicznych nie uznaje się przypadków zgłoszenia Funduszowi realizacji przez aptekę recepty w postaci elektronicznej na podstawie fałszywego oświadczenia, o którym mowa w art. 96 ust. 1a ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne.
4. Zatwierdzenie przez aptekę projektu zestawienia zbiorczego powoduje udostępnienie aptece komunikatu elektronicznego zawierającego uzgodnione zestawienie zbiorcze i zamyka dany okres rozliczeniowy oraz uniemożliwia aptece składanie do niego korekt w trybie określonym w ust. 3.
5. Apteki przekazują do właściwego oddziału wojewódzkiego Funduszu uzgodnione zestawienie zbiorcze w postaci papierowej lub elektronicznej, stanowiące podstawę refundacji.
6. Apteki przekazują dane w następujących terminach:
1) za okres od 1 do 15 dnia danego miesiąca – do pięciu dni roboczych od dnia zakończenia okresu rozliczeniowego;
2) za okres od 16 dnia do końca miesiąca – do pięciu dni roboczych od dnia zakończenia okresu rozliczeniowego.
7. Oddział wojewódzki Funduszu przeprowadza czynności, o których mowa w ust. 3 pkt 2, w terminie 5 dni roboczych od dnia otrzymania danych, o których mowa w ust. 3 pkt 1.
8. Czynność, o której mowa w ust. 3 pkt 3, apteka wykonuje jednorazowo w terminie 5 dni roboczych od otrzymania danych, o których mowa w ust. 3 pkt 2, po czym oddział wojewódzki Funduszu ponownie przeprowadza czynności, o których mowa w ust. 3 pkt 2, w terminie 5 dni roboczych od dnia otrzymania poprawionych danych.
9. Nieprzekazanie przez aptekę danych sporządzonych zgodnie z ust. 8, traktowane jest jako zatwierdzenie przez aptekę projektu zestawienia zbiorczego, powoduje udostępnienie aptece komunikatu elektronicznego zawierającego uzgodnione zestawienie zbiorcze, zamyka dany okres rozliczeniowy oraz uniemożliwia aptece składanie do niego korekt w trybie określonym w ust. 3.
10. Za datę złożenia uzgodnionego zestawienia zbiorczego w postaci papierowej lub elektronicznej przyjmuje się datę wpływu do właściwego oddziału wojewódzkiego Funduszu.
11. Złożenie przez aptekę korekty do zamkniętego okresu rozliczeniowego jest możliwe jedynie po pozytywnym rozpatrzeniu umotywowanego wniosku apteki przez dyrektora oddziału wojewódzkiego Funduszu.
12. Korekty do zamkniętego okresu rozliczeniowego apteka może składać w terminie 3 miesięcy od daty jego zamknięcia, nie później jednak niż do 15 marca roku następnego, z zastrzeżeniem ust. 9.
13. Fundusz może prowadzić analizy uzgodnionych zestawień zbiorczych po zamknięciu okresu rozliczeniowego, co może skutkować wezwaniem do złożenia przez aptekę korekty.
13a. Oddziały wojewódzkie Funduszu mogą dokonywać weryfikacji danych przekazywanych przez apteki Funduszowi, przez ich porównanie z danymi objętymi wpisem do Krajowego Rejestru Zezwoleń Na Prowadzenie Aptek Ogólnodostępnych, Punktów Aptecznych oraz Rejestru Udzielonych Zezwoleń na Prowadzenie Aptek Szpitalnych i Zakładowych, w szczególności w zakresie danych dotyczących kierowników aptek.
14. (uchylony)
Art. 45a. Zakres gromadzonych przez apteki i przekazywanych oddziałowi wojewódzkiemu Funduszu informacji zawierających dane o obrocie lekami, środkami spożywczymi specjalnego przeznaczenia żywieniowego, wyrobami medycznymi objętymi refundacją, wynikające ze zrealizowanych recept wystawionych przez osobę uprawnioną, określony dla każdego wydanego opakowania lub części opakowania leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, obejmuje:
1) dane dotyczące apteki:
a) identyfikator apteki nadany przez oddział wojewódzki Funduszu,
b) numer REGON 9-cyfrowy,
c) kod umowy na realizację recept nadany przez oddział wojewódzki Funduszu;
2) dane dotyczące wystawienia recepty:
a) kod typu recepty przyjmujący wartość:
– 7 – dla recept na leki lub środki spożywcze specjalnego przeznaczenia żywieniowego sprowadzane z zagranicy dla indywidualnego pacjenta albo
– 8 – dla recept oznaczonych symbolem „Rp”, albo
– 9 – dla recept na środki odurzające, substancje psychotropowe lub inne produkty lecznicze, o kategorii dostępności określonej w art. 23a ust. 1 pkt 4 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne, oznaczonych symbolem „Rpw”, albo
– 2 – dla recept wystawionych na kuponach dołączanych do dokumentu potwierdzającego uprawnienia do świadczeń opieki zdrowotnej,
b) numer recepty lub numer kuponu dołączanego do dokumentu potwierdzającego uprawnienia do świadczeń opieki zdrowotnej,
c) datę wystawienia recepty,
d) datę, od której można realizować receptę, jeżeli dotyczy,
e) wskaźnik dotyczący recepty przyjmujący wartość:
– 0 – w przypadku gdy na recepcie nie występuje adnotacja „pro auctore” albo „pro familiae” lub inne równoważne albo
– 1 – w przypadku gdy na recepcie występuje adnotacja „pro auctore” albo „pro familiae” lub inne równoważne;
3) dane dotyczące miejsca wystawienia recepty:
a) w przypadku gdy recepta została wystawiona w postaci elektronicznej w komórce organizacyjnej podmiotu leczniczego – numer REGON i I część systemu resortowych kodów identyfikacyjnych identyfikującą podmiot leczniczy oraz VII część systemu resortowych kodów identyfikacyjnych identyfikującą komórkę organizacyjną zakładu leczniczego w podmiocie leczniczym,
b) w przypadku gdy recepta została wystawiona w postaci elektronicznej w jednostce organizacyjnej podmiotu leczniczego – numer REGON i I część systemu resortowych kodów identyfikacyjnych identyfikującą podmiot leczniczy oraz V część systemu resortowych kodów identyfikacyjnych identyfikującą jednostkę organizacyjną zakładu leczniczego w strukturze organizacyjnej podmiotu leczniczego,
c) w przypadku gdy recepta została wystawiona w postaci elektronicznej w ramach praktyk zawodowych – numer REGON oraz kod identyfikacyjny miejsca udzielania świadczeń w ramach praktyki zawodowej,
d) w przypadku gdy recepta została wystawiona w postaci papierowej – numer REGON 9-cyfrowy,
e) oznaczenie wskazujące na wystawienie recepty przez osobę uprawnioną w trybie pro auctore, pro familiae;
4) dane dotyczące świadczeniobiorcy:
a) typ identyfikatora pacjenta, przyjmujący wartość:
– P – w przypadku pacjenta albo
– O – w przypadku przedstawiciela ustawowego lub opiekuna faktycznego,
b) rodzaj numeru służącego do identyfikacji pacjenta albo jego przedstawiciela ustawowego lub opiekuna faktycznego, przyjmujący wartość:
– 2 – w przypadku osoby uprawnionej do świadczeń opieki zdrowotnej na podstawie przepisów o koordynacji posiadającej poświadczenie wydane przez oddział wojewódzki Funduszu albo
– 3 – w przypadku osoby uprawnionej do świadczeń opieki zdrowotnej na podstawie przepisów o koordynacji jeden z dokumentów przenośnych: DA1, S2, S3, albo
– 4 – w przypadku osoby uprawnionej do świadczeń opieki zdrowotnej na podstawie przepisów o koordynacji posiadającej Europejską Kartę Ubezpieczenia Zdrowotnego lub Certyfikat Tymczasowo Zastępujący Europejską Kartę Ubezpieczenia Zdrowotnego lub dokument SED S045, albo
– 5 – w przypadku numeru PESEL, albo
– 6 – w przypadku osoby spoza Unii Europejskiej objętej ubezpieczeniem zdrowotnym w Rzeczypospolitej Polskiej, nieposiadającej numeru PESEL, albo
– 7 – w przypadku osób posiadających Kartę Polaka – numer Karty Polaka,
c) numer identyfikujący pacjenta przyjmujący wartości:
– 2 – dla numeru poświadczenia, o którym mowa w art. 52 ust. 2 pkt 9 ustawy o świadczeniach, wydanego przez oddział wojewódzki Funduszu albo
– 3 – dla numeru na dokumencie przenośnym: DA1, S2, S3, albo
– 4 – dla numeru Europejskiej Karty Ubezpieczenia Zdrowotnego lub Certyfikatu Tymczasowo Zastępującego Europejską Kartę Ubezpieczenia Zdrowotnego lub dokument SED S045, albo
– 5 – dla numeru PESEL, albo
– 6 – dla numeru paszportu lub innego dokumentu ze zdjęciem potwierdzającego tożsamość – w przypadku cudzoziemca objętego ubezpieczeniem zdrowotnym w Rzeczypospolitej Polskiej nieposiadającego numeru PESEL, albo
– 7 – dla numeru Karty Polaka – w przypadku osób posiadających Kartę Polaka,
d) datę urodzenia pacjenta – w przypadku pacjenta nieposiadającego numeru PESEL,
e) kod uprawnienia dodatkowego pacjenta określony symbolem „AZ”, „IB”, „IW”, „PO”, „WP” albo „ZK” albo kod uprawnienia do świadczeń opieki zdrowotnej finansowanych ze środków publicznych określony symbolem „BW”, „CN”, „DN” albo „IN”, a w przypadku braku uprawnienia symbol „X”,
f) kod uprawnienia dodatkowego pacjenta określony symbolem „S”, a w przypadku braku uprawnienia dodatkowego symbol „X”,
g)34) kod uprawnienia dodatkowego pacjenta określony symbolem „C”, a w przypadku braku uprawnienia dodatkowego symbol „X”;
5) dane dotyczące osoby uprawnionej wystawiającej receptę:
a) numer prawa wykonywania zawodu,
b) sposób ordynacji, jeżeli dotyczy;
6) dane dotyczące realizacji recepty:
a) identyfikator realizacji recepty,
b) datę i godzinę przyjęcia recepty do realizacji,
c) datę i godzinę wykonania leku recepturowego, jeżeli dotyczy,
d) datę i godzinę realizacji recepty,
e) sposób udostępnienia danych niezbędnych do realizacji recepty, o którym mowa w art. 96 ust. 1–1d ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne;
7) dane dotyczące osoby realizującej receptę:
a) typ identyfikatora osoby realizującej receptę,
b) identyfikator osoby wydającej, która zrealizowała receptę,
c) identyfikator osoby wykonującej lek recepturowy, jeżeli dotyczy;
8) dane dotyczące wydanego leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego:
a) rodzaj identyfikatora leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego przyjmujący wartość:
– 0 – dla leku,
– 1 – dla leku recepturowego,
– 2 – dla środka spożywczego specjalnego przeznaczenia żywieniowego,
– 3 – dla wyrobu medycznego,
b) rodzaj identyfikatora dla składowych kosztowych leku recepturowego przyjmujący wartość:
– 0 – dla leku gotowego,
– 1 – dla surowca farmaceutycznego,
– 2 – dla opakowania bezpośredniego,
c) numer GTIN zgodny z systemem GS1 leku lub inny kod jednoznacznie identyfikujący wyrób medyczny lub środek spożywczy specjalnego przeznaczenia żywieniowego; w przypadku leku recepturowego – numer kodowy leku gotowego, surowca farmaceutycznego, opakowania bezpośredniego przyjmujący wartość:
– 1 – dla proszków dzielonych – do 20 sztuk,
– 2 – dla proszków niedzielonych (prostych i złożonych) – do 80 gramów,
– 3 – dla czopków, globulek oraz pręcików – do 12 sztuk,
– 4 – dla roztworów, mikstur, zawiesin oraz emulsji do użytku wewnętrznego – do 250 gramów,
– 5 – dla płynnych leków do stosowania zewnętrznego (jeżeli zawierają spirytus, ilość spirytusu w przeliczeniu na spirytus 95% nie może przekroczyć 100 gramów) – do 500 gramów,
– 6 – dla maści, kremów, mazideł, past oraz żeli – do 100 gramów,
– 7 – dla kropli do użytku wewnętrznego i zewnętrznego – do 40 gramów,
– 8 – dla mieszanek ziołowych – do 100 gramów,
– 9 – dla pigułek – do 30 sztuk,
– 10 – dla klein – do 500 gramów,
– 11 – dla kropli do oczu, uszu i nosa oraz maści do oczu, uszu i nosa, sporządzanych w warunkach aseptycznych – do 10 gramów,
d) wskaźnik dotyczący leku przyjmujący wartość:
– 1 – w przypadku gdy przy leku występuje adnotacja „nie zamieniać” lub „NZ”,
– 0 – w przypadku braku adnotacji, o której mowa w tiret pierwszym,
e) liczbę wydanych opakowań leku, w tym leku recepturowego, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego,
f) cenę detaliczną brutto leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego,
g) cenę hurtową brutto leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego, a w przypadku leku recepturowego – cenę hurtową brutto leku gotowego, surowca farmaceutycznego, opakowania bezpośredniego,
h) wartość wydanych opakowań leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego, a w przypadku leku recepturowego – wartość użytego leku gotowego, surowca farmaceutycznego, opakowania bezpośredniego oraz koszt wykonania leku recepturowego (taksa laborum), wraz z identyfikatorem kosztu wykonania leku recepturowego (taksy laborum) przyjmującym wartość:
– 1 – w przypadku sporządzenia leku recepturowego w warunkach nieaseptycznych,
– 2 – w przypadku sporządzenia leku recepturowego w warunkach aseptycznych,
i) kod odpłatności za lek, środek spożywczy specjalnego przeznaczenia żywieniowego lub wyrób medyczny przyjmujący wartość:
–35) 0 – dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego wydanego bezpłatnie, w przypadku gdy realizacja recepty nastąpiła na podstawie uprawnienia innego niż uprawnienie, o którym mowa w art. 43a ust. 1 i 1a albo art. 43b ust. 1 ustawy o świadczeniach,
– 10 – dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego wydanego bezpłatnie do wysokości limitu finansowania,
–36) 20 – dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego wydanego bezpłatnie na podstawie uprawnienia, o którym mowa w art. 43a ust. 1 i 1a albo art. 43b ust. 1 ustawy o świadczeniach, świadczeniobiorcy uprawnionemu również na podstawie art. 43 ust. 1 albo art. 45 ust. 1 pkt 1–3 ustawy o świadczeniach,
– 11 – dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego wydanego za odpłatnością ryczałtową,
–37) 21 – dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego wydawanego za odpłatnością ryczałtową, wydanego bezpłatnie na podstawie uprawnienia, o którym mowa w art. 43a ust. 1 i 1a albo art. 43b ust. 1 ustawy o świadczeniach,
– 12 – dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego wydanego za odpłatnością w wysokości 30% limitu finansowania,
–38) 22 – dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego wydawanego za odpłatnością w wysokości 30% limitu finansowania, wydanego bezpłatnie na podstawie uprawnienia, o którym mowa w art. 43a ust. 1 i 1a albo art. 43b ust. 1 ustawy o świadczeniach,
– 13 – dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego wydanego za odpłatnością w wysokości 50% limitu finansowania,
–39) 23 – dla leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego wydawanego za odpłatnością w wysokości 50% limitu finansowania, wydanego bezpłatnie na podstawie uprawnienia, o którym mowa w art. 43a ust. 1 i 1a albo art. 43b ust. 1 ustawy o świadczeniach,
j) informację, czy wydano odpowiednik, przyjmującą wartość:
– T – w przypadku gdy apteka wydała odpowiednik,
– N – w przypadku gdy apteka wydała lek, środek spożywczy specjalnego przeznaczenia żywieniowego lub wyrób medyczny, zgodnie z ordynacją,
k) numer GTIN zgodny z systemem GS1 odpowiednika leku lub inny kod jednoznacznie identyfikujący wyrób medyczny lub środek spożywczy specjalnego przeznaczenia żywieniowego,
l) kwotę podlegającą refundacji,
m) informację o wysokości dopłaty świadczeniobiorcy;
9) dane dotyczące płatnika:
a) (uchylona)40)
b) symbol instytucji właściwej dla osoby uprawnionej do świadczeń opieki zdrowotnej na podstawie przepisów o koordynacji.
Art. 45b. 1. Apteka otrzymuje od oddziału wojewódzkiego Funduszu:
1) komunikat zwrotny,
2) projekt zestawienia zbiorczego recept na leki, środki spożywcze specjalnego przeznaczenia żywieniowego lub wyroby medyczne objęte refundacją na podstawie zaakceptowanych recept, zwany dalej „projektem zestawienia zbiorczego”
– o których mowa w art. 45 ust. 3 pkt 2, w formacie zgodnym ze wzorami zamieszczonymi w Biuletynie Informacji Publicznej ministra właściwego do spraw zdrowia.
2. Na podstawie komunikatu zwrotnego oraz projektu zestawienia zbiorczego apteka dokonuje:
1) zatwierdzenia i przekazuje do oddziału wojewódzkiego Funduszu żądanie rozliczenia zaakceptowanych recept na podstawie otrzymanego projektu zestawienia zbiorczego – w przypadku braku konieczności dokonania korekt, o których mowa w art. 45 ust. 3 pkt 3;
2) czynności, o których mowa w art. 45 ust. 3 pkt 3, w przypadku wskazania przez oddział wojewódzki Funduszu błędów albo innych nieprawidłowości w komunikacie zwrotnym;
3) zatwierdzenia projektu zestawienia zbiorczego, nieuwzględniającego zakwestionowanych recept, przez przekazanie żądania rozliczenia zaakceptowanych recept na podstawie otrzymanego projektu zestawienia zbiorczego.
3. Zatwierdzenie, o którym mowa w ust. 2 pkt 1 i 3, skutkuje udostępnieniem aptece uzgodnionego zestawienia zbiorczego, o którym mowa w art. 45 ust. 4, w formacie zgodnym ze wzorem zamieszczonym w Biuletynie Informacji Publicznej ministra właściwego do spraw zdrowia.
Art. 46. 1. Podmiot prowadzący aptekę, który zawarł umowę na realizację recept, po przedstawieniu właściwemu oddziałowi wojewódzkiemu Funduszu zestawienia, o którym mowa w art. 45 ust. 5, nie częściej niż co 14 dni, otrzymuje refundację ustalonego limitu finansowania leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego.
2. Refundacja nie może przekraczać ustalonego limitu finansowania, z zastrzeżeniem art. 43a–46 ustawy o świadczeniach.
3. Właściwy oddział wojewódzki Funduszu dokonuje refundacji nie później niż 15 dni od dnia otrzymania zestawienia, o którym mowa w art. 45 ust. 5.
4. W przypadku gdy złożone do Funduszu zestawienie jest niezgodne z komunikatem, o którym mowa w art. 45 ust. 4, Fundusz zwraca je aptece w terminie 7 dni od daty złożenia.
5. Zestawienie, o którym mowa w ust. 4, nie stanowi podstawy do dokonania przez Fundusz refundacji.
6. W przypadku przekroczenia przez Fundusz terminu, o którym mowa w ust. 3, aptece przysługują odsetki ustawowe za opóźnienie.
7. W przypadku stwierdzenia w wyniku analizy, o której mowa w art. 45 ust. 13, nienależnego obciążenia refundacją, Funduszowi przysługuje zwrot nienależnie wypłaconej refundacji wraz z odsetkami ustawowymi za opóźnienie liczonymi od dnia jej przekazania do dnia jej zwrotu.
8. Fundusz przekazuje dane, o których mowa w art. 45, wynikające ze zrealizowanych recept podlegających refundacji z budżetu państwa właściwym ministrom w terminie 30 dni od dnia ich otrzymania.
Art. 47. 1. Apteka jest obowiązana udostępnić, na żądanie Funduszu, do kontroli recepty wystawione w postaci papierowej wraz z ich otaksowaniem i przekazać niezbędne dane, o których mowa w art. 45 ust. 1, a także dokumentację, którą apteka jest obowiązana prowadzić i posiadać na podstawie odrębnych przepisów, i informacje, o których mowa w art. 43 ust. 1 pkt 2–4.
2. (uchylony)
3. Wydanie recept, o których mowa w ust. 1, wraz z otaksowaniem może nastąpić nie wcześniej niż po zamknięciu okresu rozliczeniowego, o którym mowa w art. 45 ust. 9, i na czas niezbędny do przeprowadzenia kontroli.
3a. Do kontroli stosuje się przepisy działu IIIA ustawy o świadczeniach.
4. (uchylony)
5. (uchylony)
6. (uchylony)
7. (uchylony)
8. (uchylony)
9. (uchylony)
10. (uchylony)
11. (uchylony)
12. (uchylony)
13. (uchylony)
14. (uchylony)
15. (uchylony)
16. (uchylony)
17. (uchylony)
Art. 47a. Podmiot prowadzący aptekę lub punkt apteczny, który rozwiąże umowę z oddziałem wojewódzkim Funduszu oraz zakończy prowadzenie działalności, jest obowiązany do powiadamiania tego oddziału, przez okres 5 lat od dnia zakończenia prowadzenia działalności, o aktualnych danych adresowych osoby reprezentującej dany podmiot lub danych osoby upoważnionej do wydania recept w razie nieobecności osoby reprezentującej ten podmiot, w celu umożliwienia Funduszowi dostępu do recept zrealizowanych przez zlikwidowaną aptekę lub punkt apteczny, w terminie 7 dni od dnia, w którym dane te uległy zmianie.
Art. 48. 1. Realizacja świadczeń, o których mowa w art. 15 ust. 2 pkt 14, 17 i 18 ustawy o świadczeniach, przysługuje świadczeniobiorcy na podstawie recepty wystawionej przez osobę uprawnioną, o której mowa w art. 2 pkt 14. Realizacja świadczeń, o których mowa w art. 15 ust. 2 pkt 9 ustawy o świadczeniach, przysługuje świadczeniobiorcy na podstawie zlecenia wystawionego przez osobę uprawnioną, o której mowa w art. 2 pkt 14.
2. (uchylony)
2a. Recepty w postaci papierowej na refundowane leki, środki spożywcze specjalnego przeznaczenia żywieniowego oraz wyroby medyczne opatrzone są unikalnymi numerami identyfikującymi recepty, nadawanymi przez dyrektora oddziału wojewódzkiego Funduszu.
3. (uchylony)
4. (uchylony)
5. W przypadku prawomocnego skazania za przestępstwo określone w art. 54 ust. 2, 3 lub 5 ustawy lub art. 228–230, art. 286 lub art. 296a ustawy z dnia 6 czerwca 1997 r. – Kodeks karny, osoba uprawniona traci prawo wystawiania recept na leki, środki spożywcze specjalnego przeznaczenia żywieniowego oraz wyroby medyczne refundowane na okres:
1) jednego roku – w przypadku pierwszego skazania;
2) trzech lat – w przypadku kolejnego skazania.
6. (uchylony)
7. Osoba uprawniona, z wyłączeniem lekarza ubezpieczenia zdrowotnego, felczera ubezpieczenia zdrowotnego, w rozumieniu ustawy o świadczeniach, pielęgniarki ubezpieczenia zdrowotnego i położnej ubezpieczenia zdrowotnego, w rozumieniu ustawy o świadczeniach, o których mowa w art. 15a ust. 1 i 2 ustawy z dnia 15 lipca 2011 r. o zawodach pielęgniarki i położnej, oraz podmiot wykonujący działalność leczniczą, w ramach którego wystawiono receptę na co najmniej jeden refundowany lek, środek spożywczy specjalnego przeznaczenia żywieniowego oraz wyrób medyczny lub zlecenie na wyrób medyczny, są obowiązani poddać się kontroli przeprowadzanej lub zlecanej przez Fundusz w zakresie dokumentacji medycznej dotyczącej zasadności i prawidłowości wystawiania recept na refundowane leki, środki spożywcze specjalnego przeznaczenia żywieniowego oraz wyroby medyczne i zleceń na wyroby medyczne. Do kontroli stosuje się przepisy działu IIIA ustawy o świadczeniach.
7a. Osoba uprawniona z wyłączeniem lekarza ubezpieczenia zdrowotnego, felczera ubezpieczenia zdrowotnego, w rozumieniu ustawy o świadczeniach, pielęgniarki ubezpieczenia zdrowotnego i położnej ubezpieczenia zdrowotnego, w rozumieniu ustawy o świadczeniach, o których mowa w art. 15a ust. 1 i 2 ustawy z dnia 15 lipca 2011 r. o zawodach pielęgniarki i położnej, jest obowiązana do zwrotu Funduszowi kwoty stanowiącej równowartość kwoty refundacji wraz z odsetkami ustawowymi liczonymi od dnia dokonania refundacji, o której mowa w art. 46 ust. 1, w przypadku:
1) wypisania recepty w okresie pozbawienia prawa wystawiania recept, o którym mowa w ust. 5;
2) wypisania recepty nieuzasadnionej udokumentowanymi względami medycznymi;
3) wypisania recepty niezgodnej z uprawnieniami świadczeniobiorcy albo osoby uprawnionej;
4) wypisania recepty niezgodnej ze wskazaniami zawartymi w obwieszczeniach, o których mowa w art. 37 ust. 1 lub 4.
7b. Osoba uprawniona, z wyłączeniem lekarza ubezpieczenia zdrowotnego, felczera ubezpieczenia zdrowotnego, w rozumieniu ustawy o świadczeniach, pielęgniarki ubezpieczenia zdrowotnego i położnej ubezpieczenia zdrowotnego, w rozumieniu ustawy o świadczeniach, o których mowa w art. 15a ust. 1 i 2 ustawy z dnia 15 lipca 2011 r. o zawodach pielęgniarki i położnej, jest obowiązana do zwrotu Funduszowi kwoty stanowiącej równowartość limitu finansowania wyrobu medycznego wraz z odsetkami ustawowymi liczonymi od dnia dokonania finansowania, o którym mowa w przepisach wydanych na podstawie art. 38 ust. 4, w przypadku:
1) wypisania zlecenia w okresie pozbawienia prawa wystawiania recept, o którym mowa w ust. 5;
2) wypisania zlecenia nieuzasadnionego udokumentowanymi względami medycznymi;
3) wypisania zlecenia niezgodnego z kryteriami przyznawania zawartymi w przepisach, o których mowa w art. 38 ust. 4.
7c. W przypadku dokonania przez świadczeniodawcę zmiany ustalonego limitu finansowania ze środków publicznych wyrobu medycznego wskazanego w zleceniu, niezgodnej ze stanem prawnym i faktycznym na dzień przyjęcia do realizacji zlecenia i pobrania od świadczeniobiorcy należności zgodnie z tak zmienionym limitem, świadczeniodawca, który zrealizował zlecenie, jest obowiązany do zwrotu Funduszowi kwoty stanowiącej różnicę między limitem przez niego ustalonym a limitem finansowania wyrobu medycznego, o którym mowa w przepisach wydanych na podstawie art. 38 ust. 4, wraz z odsetkami ustawowymi liczonymi od dnia dokonania finansowania.
7d. W przypadku zaniechania przez świadczeniodawcę dokonania zmiany ustalonego limitu finansowania ze środków publicznych wyrobu medycznego wskazanego w zleceniu, zgodnie ze stanem prawnym i faktycznym na dzień przyjęcia do realizacji zlecenia i pobrania od świadczeniobiorcy należności niezgodnie z poprawnie ustalonym limitem, świadczeniodawca, który zrealizował zlecenie, jest obowiązany do zwrotu Funduszowi kwoty stanowiącej różnicę między niezmienionym odpowiednio limitem a limitem finansowania wyrobu medycznego, o którym mowa w przepisach wydanych na podstawie art. 38 ust. 4, wraz z odsetkami ustawowymi liczonymi od dnia dokonania finansowania.
8. (uchylony)
9. (uchylony)
10. (uchylony)
11. (uchylony)
Art. 49. 1. Zakazuje się przedsiębiorcy zajmującemu się wytwarzaniem lub obrotem lekami, środkami spożywczymi specjalnego przeznaczenia żywieniowego, wyrobami medycznymi podlegającymi refundacji:
1) uzależniania zawarcia umowy dotyczącej tych leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych lub uzależniania treści tej umowy od przyjęcia lub spełnienia przez:
a) innego przedsiębiorcę zajmującego się wytwarzaniem lub obrotem lekami, środkami spożywczymi specjalnego przeznaczenia żywieniowego, wyrobami medycznymi podlegającymi refundacji,
b) podmiot prowadzący aptekę,
c) kierownika apteki,
d) osobę wydającą leki, środki spożywcze specjalnego przeznaczenia żywieniowego, wyroby medyczne objęte refundacją
– świadczenia niezwiązanego z przedmiotem tej umowy, w tym korzyści majątkowej lub osobistej, o której mowa w ust. 3;
2) stosowania wobec podmiotów wymienionych w pkt 1 niejednolitych warunków umów.
2. Umowy sprzeczne z ust. 1 są w tym zakresie nieważne.
3. Zakazuje się:
1) przedsiębiorcy zajmującemu się wytwarzaniem lub obrotem lekami, środkami spożywczymi specjalnego przeznaczenia żywieniowego, wyrobami medycznymi podlegającymi refundacji,
2) podmiotowi prowadzącemu aptekę, kierownikowi apteki lub osobie wydającej leki, środki spożywcze specjalnego przeznaczenia żywieniowego, wyroby medyczne objęte refundacją, w związku z realizacją recept na refundowane leki, środki spożywcze specjalnego przeznaczenia żywieniowego, wyroby medyczne
– sprzedaży uwarunkowanej, upustów, rabatów, bonifikat, pakietów i programów lojalnościowych, darowizn, nagród, wycieczek, gier losowych, zakładów wzajemnych, wszelkich form użyczeń, transakcji wiązanych, wszelkiego rodzaju talonów i bonów, a także udzielania innych niewymienionych z nazwy korzyści majątkowych lub osobistych dla świadczeniobiorców oraz osób uprawnionych.
4. Przepisy ust. 1–3 stosuje się do podmiotów realizujących zaopatrzenie na zlecenie w zakresie wyrobów medycznych oraz dostawców tych wyrobów.
5. Jeżeli w decyzji o objęciu refundacją leku, środka specjalnego przeznaczenia żywieniowego lub wyrobu medycznego, ustalano instrumenty dzielenia ryzyka, o których mowa w art. 11 ust. 2 pkt 7, które stanowią którąkolwiek z korzyści majątkowych lub osobistych, o których mowa w ust. 3, przepisów ust. 1–3 nie stosuje się w zakresie tych instrumentów.
Rozdział 7
Kary administracyjne
Art. 50. 1. Karze pieniężnej podlega, kto wbrew przepisom:
1) art. 6 stosuje inne odpłatności i dopłaty za leki, środki spożywcze specjalnego przeznaczenia żywieniowego lub wyroby medyczne;
2) art. 7 stosuje inne niż urzędowe marże hurtowe lub marże detaliczne na leki, środki spożywcze specjalnego przeznaczenia żywieniowego lub wyroby medyczne;
3) art. 8 stosuje inne niż ustalone w decyzji administracyjnej o objęciu refundacją ceny zbytu na leki, środki spożywcze specjalnego przeznaczenia żywieniowego lub wyroby medyczne;
4) art. 49 ust. 3 udziela którejkolwiek z korzyści majątkowych lub osobistych, o których mowa w tym przepisie.
2. Karę pieniężną, o której mowa w ust. 1 pkt 1–3, wymierza się w wysokości wartości sprzedanych z naruszeniem przepisów ustawy leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych powiększonej o wartość do 5% obrotu produktami, w stosunku do których wydana została decyzja administracyjna o objęciu refundacją, osiągniętego w poprzednim roku kalendarzowym.
3. Przy ustalaniu wysokości tej wartości bierze się pod uwagę:
1) cenę zbytu netto w przypadku wnioskodawcy,
2) cenę hurtową netto w przypadku podmiotu uprawnionego do obrotu hurtowego,
3) cenę detaliczną netto w przypadku podmiotu uprawnionego do obrotu detalicznego
– otrzymanej w poprzednim roku kalendarzowym kwoty z tytułu refundacji.
4. Karę pieniężną, o której mowa w ust. 1 pkt 4 wymierza się w wysokości do 5% wartości netto obrotu produktami, w stosunku do których wydana została decyzja administracyjna o objęciu refundacją osiągniętego w poprzednim roku kalendarzowym.
5. W przypadku, gdy podmiot ukarany nie wykazuje obrotu produktami, w stosunku do których wydana została decyzja administracyjna o objęciu refundacją, karę pieniężną, o której mowa w ust. 1 pkt 4, wymierza się w wysokości stukrotnej wartości udzielonej korzyści majątkowej lub osobistej, o której mowa w art. 49 ust. 3.
Art. 51. Karze pieniężnej podlega wnioskodawca, który nie dotrzymał określonych w decyzji administracyjnej o objęciu refundacją postanowień w zakresie instrumentów dzielenia ryzyka. Kara ta wymierzana jest w kwocie stanowiącej dwukrotność wartości poniesionych przez Fundusz kosztów refundacji związanych z niedotrzymaniem postanowień decyzji.
Art. 52. 1. Karze pieniężnej podlega ten, kto wbrew przepisowi art. 49 ust. 1:
1) uzależnia zawarcie umowy dotyczącej leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych podlegających refundacji lub uzależnia treść tej umowy, od przyjęcia lub spełnienia przez:
a) innego przedsiębiorcę zajmującego się wytwarzaniem lub obrotem lekami, środkami spożywczymi specjalnego przeznaczenia żywieniowego, wyrobami medycznymi podlegającymi refundacji,
b) podmiot prowadzący aptekę,
c) kierownika apteki,
d) osobę wydającą leki, środki spożywcze specjalnego przeznaczenia żywieniowego, wyroby medyczne objęte refundacją
– świadczenia niezwiązanego z przedmiotem tej umowy, w tym którejkolwiek korzyści majątkowej lub osobistej, o której mowa w art. 49 ust. 3;
2) stosuje wobec podmiotów wymienionych w pkt 1 niejednolite warunki umów.
2. Kara pieniężna, o której mowa w ust. 1, wymierzana jest w kwocie stanowiącej równowartość 3% wartości netto obrotu produktami, w stosunku do których wydana została decyzja administracyjna o objęciu refundacją, osiągniętego w poprzednim roku kalendarzowym.
Art. 52a. 1. Karze pieniężnej podlega osoba uprawniona, z wyłączeniem lekarza ubezpieczenia zdrowotnego, felczera ubezpieczenia zdrowotnego, w rozumieniu ustawy o świadczeniach, pielęgniarki ubezpieczenia zdrowotnego i położnej ubezpieczenia zdrowotnego, w rozumieniu ustawy o świadczeniach, o których mowa w art. 15a ust. 1 i 2 ustawy z dnia 15 lipca 2011 r. o zawodach pielęgniarki i położnej, która wystawiła receptę na refundowany lek, środek spożywczy specjalnego przeznaczenia żywieniowego albo wyrób medyczny, albo podmiot wykonujący działalność leczniczą, w ramach którego wystawiono receptę na refundowany lek, środek spożywczy specjalnego przeznaczenia żywieniowego albo wyrób medyczny albo zlecenie na wyrób medyczny, w przypadku:
1) uniemożliwienia czynności, o których mowa w dziale IIIA ustawy o świadczeniach;
2) niewykonania w terminie zaleceń pokontrolnych;
3) prowadzenia dokumentacji medycznej w sposób niezgodny z przepisami prawa;
4) nieprowadzenia dokumentacji medycznej.
2. Karę pieniężną w przypadku, o którym mowa w ust. 1, wymierza się w kwocie do równowartości kwoty refundacji za okres objęty kontrolą lub za okres objęty czynnościami, o których mowa w art. 61x ustawy o świadczeniach.
3. Okres objęty kontrolą lub czynnościami, o których mowa w ust. 2, nie może być dłuższy niż 5 lat, licząc od zakończenia roku kalendarzowego, w którym nastąpiła refundacja.
Art. 53. 1. Kary pieniężne, o których mowa w art. 50 ust. 1 pkt 1–3, art. 51 i art. 52, nakłada minister właściwy do spraw zdrowia w drodze decyzji administracyjnej.
2. Karę pieniężną, o której mowa w art. 50 ust. 1 pkt 4, nakłada w drodze decyzji administracyjnej wojewódzki inspektor farmaceutyczny, na którego obszarze działania doszło do naruszenia przepisów art. 49 ust. 3.
2a. Karę pieniężną, o której mowa w art. 52a, nakłada w drodze decyzji administracyjnej Prezes Funduszu. Od decyzji Prezesa Funduszu przysługuje wniosek o ponowne rozpatrzenie sprawy.
3. Przy ustalaniu wysokości kar pieniężnych, o których mowa w ust. 1, 2 oraz art. 52a, należy uwzględnić w szczególności okres, stopień oraz okoliczności naruszenia przepisów ustawy, a także uprzednie naruszenia przepisów ustawy.
4. Kary pieniężne stanowią przychód Funduszu. Prezes Funduszu jest wierzycielem w rozumieniu ustawy z dnia 17 czerwca 1966 r. o postępowaniu egzekucyjnym w administracji (Dz. U. z 2020 r. poz. 1427, 1492 i 2320 oraz z 2021 r. poz. 11 i 41). Zażalenia na postanowienia Prezesa Funduszu rozpatruje minister właściwy do spraw zdrowia.
5. Karę pieniężną uiszcza się w terminie 7 dni od dnia, w którym decyzja stała się ostateczna na rachunek bankowy wskazany przez Prezesa Funduszu. Od kary pieniężnej nieuiszczonej w terminie nalicza się odsetki ustawowe za opóźnienie.
6. Egzekucja kary pieniężnej wraz z odsetkami, o których mowa w ust. 5, następuje w trybie przepisów o postępowaniu egzekucyjnym w administracji.
7. Kara pieniężna, o której mowa w ust. 1, 2 i 2a, ulega przedawnieniu z upływem 5 lat, licząc od dnia, w którym decyzja ustalająca karę stała się ostateczna.
Rozdział 8
Przepisy karne
Art. 54. 1. Kto, zajmując się wytwarzaniem lub obrotem lekami, środkami spożywczymi specjalnego przeznaczenia żywieniowego lub wyrobami medycznymi podlegającymi refundacji ze środków publicznych, przyjmuje korzyść majątkową lub osobistą albo jej obietnicę lub takiej korzyści żąda w zamian za zachowanie wywierające wpływ na:
1) poziom obrotu lekami, środkami spożywczymi specjalnego przeznaczenia żywieniowego lub wyrobami medycznymi podlegającymi refundacji ze środków publicznych;
2) obrót lub powstrzymanie się od obrotu konkretnym lekiem, środkiem spożywczym specjalnego przeznaczenia żywieniowego lub wyrobem medycznym podlegającym refundacji ze środków publicznych;
– podlega karze pozbawienia wolności od 6 miesięcy do 8 lat.
2. Tej samej karze podlega, kto będąc osobą uprawnioną do wystawiania recept na leki, środki spożywcze specjalnego przeznaczenia żywieniowego lub wyroby medyczne, podlegające refundacji ze środków publicznych lub zleceń, o których mowa w art. 38 ust. 1, żąda lub przyjmuje korzyść majątkową lub osobistą albo jej obietnicę w zamian za wystawienie recepty lub zlecenia lub powstrzymanie się od ich wystawienia.
3. Tej samej karze podlega, kto będąc osobą zaopatrującą świadczeniodawcę w leki, środki spożywcze specjalnego przeznaczenia żywieniowego lub wyroby medyczne albo będąc świadczeniodawcą lub osobą reprezentującą świadczeniodawcę żąda lub przyjmuje korzyść majątkową lub osobistą, w zamian za zakup leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego podlegającego refundacji ze środków publicznych.
4. Tej samej karze podlega, kto w przypadkach określonych w ust. 1–3 udziela lub obiecuje udzielić korzyści majątkowej lub osobistej.
5. W wypadku mniejszej wagi sprawca czynu określonego w ust. 1–4
– podlega karze pozbawienia wolności do lat 3.
6. Nie podlega karze sprawca przestępstwa określonego w ust. 4, jeżeli korzyść majątkowa lub osobista albo jej obietnica zostały przyjęte, a sprawca zawiadomił o tym fakcie organ powołany do ścigania przestępstw i ujawnił wszystkie istotne okoliczności przestępstwa, zanim organ ten o nim się dowiedział.
Art. 55. Odpis prawomocnego wyroku skazującego osobę uprawnioną do wystawiania recept na refundowane leki, środki spożywcze specjalnego przeznaczenia żywieniowego lub wyroby medyczne, za przestępstwo określone w art. 54 ustawy lub art. 228–230, art. 286 lub art. 296a ustawy z dnia 6 czerwca 1997 r. – Kodeks karny, sąd przesyła podmiotowi zobowiązanemu do finansowania świadczeń ze środków publicznych.
Rozdział 9
Zmiany w przepisach obowiązujących, przepisy przejściowe i końcowe
Art. 56–66. (pominięte)
Art. 67. 1. Minister właściwy do spraw zdrowia, w terminie miesiąca od dnia wejścia w życie niniejszego przepisu, wzywa podmiot odpowiedzialny, importera równoległego, w rozumieniu ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne, a także wytwórcę wyrobu medycznego lub jego autoryzowanego przedstawiciela, dystrybutora lub importera, w rozumieniu ustawy z dnia 20 maja 2010 r. o wyrobach medycznych, którego lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny jest objęty wykazami:
1) wydanymi na podstawie art. 31d ustawy, o której mowa w art. 6341), dotyczącym świadczeń gwarantowanych z zakresu:
a) programów zdrowotnych w części dotyczącej terapeutycznych programów zdrowotnych, z zastrzeżeniem art. 70,
b) leczenia szpitalnego oraz ambulatoryjnej opieki specjalistycznej w części dotyczącej leków stosowanych w chemioterapii,
2) o których mowa w art. 36 ust. 5, art. 37 ust. 2 i art. 38 ust. 6 tej ustawy
– do przeprowadzenia negocjacji w zakresie ustalenia urzędowej ceny zbytu oraz instrumentów dzielenia ryzyka, o których mowa w art. 11 ust. 5.
2. Wezwanie, o którym mowa w ust. 1, zawiera żądanie przedstawienia informacji i zobowiązań, o których mowa w art. 24 ust. 2, art. 25 pkt 4 i pkt 6 lit. e oraz art. 26 pkt 1 lit. a–f i j–l. Podmioty wskazane w ust. 1 są obowiązane przedstawić te informacje w terminie 60 dni od dnia doręczenia wezwania.
3. Podmiot, o którym mowa w ust. 1 lub w przypadku przedłożenia odpowiedniej umowy, o której mowa w art. 24 ust. 2 pkt 5, jego przedstawiciel, staje się z mocy prawa wnioskodawcą w rozumieniu niniejszej ustawy, z chwilą przekazania ministrowi właściwemu do spraw zdrowia informacji, o których mowa w ust. 2.
4. W przypadku stwierdzenia, że przedłożone przez wnioskodawcę informacje, o których mowa w ust. 2 są niepełne, minister właściwy do spraw zdrowia wzywa go do ich uzupełnienia w terminie 7 dni.
5. W przypadku nieprzedłożenia informacji, o których mowa w ust. 2 lub niedokonania ich uzupełnienia w terminie, o którym mowa w ust. 3, lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny nie zostaje umieszczony w pierwszym wykazie, o którym mowa w art. 68.
6. Informacje, o których mowa w ust. 2, w zakresie określonym w art. 26 pkt 1 lit. e–f dotyczą okresu od 1 maja 2010 r. do 30 kwietnia 2011 r.
7. Negocjacje w sprawie ustalenia urzędowej ceny zbytu dotyczą proponowanej w informacji przedstawionej przez wnioskodawcę wskazanego w ust. 3 ceny zbytu netto.
8. Urzędowa cena zbytu ustalona w wyniku negocjacji nie może być wyższa niż maksymalna cena detaliczna brutto leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego określona w wykazie, o którym mowa w art. 36 ust. 5, art. 37 ust. 2 i art. 38 ust. 6 ustawy, o której mowa w art. 6341), w brzmieniu obowiązującym przed dniem wejścia w życie niniejszej ustawy, pomniejszona o marżę hurtową w wysokości 8,91% liczoną od ceny urzędowej hurtowej oraz marżę detaliczną w wysokości:
| Cena hurtowa w złotych | Marża detaliczna liczona od ceny hurtowej |
| 0–3,60 | 40% |
| 3,61–4,80 | 1,44 zł |
| 4,81–6,50 | 30% |
| 6,51–9,75 | 1,95 zł |
| 9,76–14,00 | 20% |
| 14,01–15,55 | 2,80 zł |
| 15,56–30,00 | 18% |
| 30,01–33,75 | 5,40 zł |
| 33,76–50,00 | 16% |
| 50,01–66,67 | 8,00 zł |
| 66,68–100,00 | 12% |
| powyżej 100,00 | 12,00 zł |
9. Negocjacje przeprowadza Komisja. Do negocjacji stosuje się art. 18 ust. 3, art. 19 ust. 1 i 2 pkt 2–7, art. 20 i art. 22 oraz przepisy wykonawcze wydane na podstawie art. 23.
10. Minister właściwy do spraw zdrowia wydaje decyzję, o której mowa w art. 11 ust. 1, uwzględniając:
1) stanowisko Komisji,
2) konkurencyjność cenową
– biorąc pod uwagę równoważenie interesów świadczeniobiorców i przedsiębiorców zajmujących się wytwarzaniem lub obrotem lekami, środkami spożywczymi specjalnego przeznaczenia żywieniowego, wyrobami medycznymi, możliwości płatnicze podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych oraz działalność naukowo-badawczą i inwestycyjną wnioskodawcy w zakresie związanym z ochroną zdrowia na terytorium Rzeczypospolitej Polskiej oraz w innych państwach członkowskich Unii Europejskiej lub państwach członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA).
11. Decyzja, o której mowa w ust. 10, zawiera elementy, o których mowa w art. 11 ust. 2 pkt 1–8.
12. Decyzje, o których mowa w ust. 10, wydaje się na okres 2 lat.
Art. 68. 1. Minister właściwy do spraw zdrowia ustali pierwszy wykaz, o którym mowa w art. 37 ust. 1 na dzień 1 stycznia 2012 r.
2. Pierwszy wykaz zawiera dane, o których mowa w art. 37 ust. 2, przy czym dane, o których mowa w art. 37 ust. 2 pkt 2–7, są ustalone w sposób określony w ust. 3.
3. Lekom, środkom spożywczym specjalnego przeznaczenia żywieniowego, wyrobom medycznym objętym pierwszym wykazem:
1) nadaje się kategorię dostępności refundacyjnej, o której mowa w art. 6 ust. 1:
a) pkt 1 lit. a – w przypadku, o którym mowa w ust. 1 pkt 1,
b) pkt 1 lit. b – w przypadku, o którym mowa w ust. 1 pkt 2,
c) pkt 2 – w przypadku, o którym mowa w ust. 1 pkt 3,
d) pkt 3 – w przypadku, o którym mowa w ust. 1 pkt 4;
2) przypisuje się limity finansowania i ustala grupy limitowe, na zasadach określonych w art. 15;
3) przypisuje się odpłatności na zasadach określonych w art. 14;
4) ustala się urzędową cenę zbytu w trybie, o którym mowa w art. 67.
Art. 69. Umowy o udzielanie świadczeń opieki zdrowotnej z zakresu programów zdrowotnych w części dotyczącej terapeutycznych programów zdrowotnych oraz z zakresu leczenia szpitalnego i ambulatoryjnej opieki specjalistycznej w części dotyczącej leków stosowanych w chemioterapii, zawarte przed dniem wejścia w życie niniejszej ustawy, są realizowane po tym dniu na zasadach dotychczasowych, nie dłużej jednak niż do dnia 30 czerwca 2012 r.
Art. 70. 1. Świadczenia chemioterapii niestandardowej określone w przepisach wydanych na podstawie art. 31d ustawy, o której mowa w art. 6341) w brzmieniu obowiązującym przed dniem wejścia w życie niniejszej ustawy, realizowane przed tym dniem, są realizowane na dotychczasowych zasadach nie dłużej jednak niż do dnia 31 grudnia 2014 r.
2. W okresie 3 lat od dnia wejścia w życie niniejszej ustawy mogą być kierowane do dyrektora oddziału wojewódzkiego Narodowego Funduszu Zdrowia wnioski świadczeniodawcy dotyczące rozpoczęcia realizacji świadczeń chemioterapii niestandardowej określonych w przepisach wydanych na podstawie art. 31d ustawy, o której mowa w art. 6341) w brzmieniu obowiązującym przed dniem wejścia w życie niniejszej ustawy. Wnioski te są rozpatrywane zgodnie z dotychczasowymi zasadami. Świadczenia chemioterapii niestandardowej realizowane na podstawie tych wniosków są realizowane przez okres określony w przepisach wydanych na podstawie art. 31d ustawy, o której mowa w art. 6341) w brzmieniu obowiązującym przed dniem wejścia w życie niniejszej ustawy.
3. Do kontynuacji u świadczeniobiorcy chemioterapii niestandardowej danym lekiem w danym wskazaniu, stosuje się ust. 2 zdanie drugie i trzecie.
4. Świadczenia chemioterapii niestandardowej określone w przepisach wydanych na podstawie art. 31d ustawy, o której mowa w art. 6341) w brzmieniu obowiązującym przed dniem wejścia w życie niniejszej ustawy nie mogą być realizowane przy wykorzystaniu leku, który został dopuszczony do obrotu, zgodnie z przepisami ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne, po dniu 31 grudnia 2011 r.
5. Jeżeli podmiot odpowiedzialny złoży wniosek, o którym mowa w art. 24 ust. 1 pkt 1, dotyczący leku stosowanego w świadczeniu, o którym mowa w ust. 1, w zakresie wskazań do stosowania zgodnych z określonymi w Charakterystyce Produktu Leczniczego w rozumieniu ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne, w terminie do dnia 31 grudnia 2012 r., opłat, o których mowa w art. 32 i art. 35 ust. 3 nie pobiera się.
Art. 71. 1. Wnioski złożone po dniu 30 czerwca 2011 r. na podstawie art. 39 ustawy, o której mowa w art. 6341), w brzmieniu obowiązującym przed dniem wejścia w życie niniejszej ustawy, uzupełnia się w terminie 14 dni od dnia doręczenia wezwania ministra właściwego do spraw zdrowia, o informacje, zgodnie z art. 67 ust. 2.
2. Do wniosków tych przepis art. 67 ust. 7–12 stosuje się odpowiednio.
3. Jeżeli wniosek, o którym mowa w ust. 1 dotyczy leku, środka spożywczego specjalnego przeznaczenia żywieniowego, wyrobu medycznego, nieposiadającego swojego odpowiednika w danym wskazaniu na wykazach, o których mowa w art. 36 ust. 5, art. 37 ust. 2 i art. 38 ust. 6 ustawy, o której mowa w art. 6341), w brzmieniu obowiązującym przed dniem wejścia w życie niniejszej ustawy, przepis art. 31i, art. 39 ust. 2d, 2e pkt 1 oraz ust. 2f–2j ustawy, o której mowa w art. 6341), w brzmieniu obowiązującym przed dniem wejścia w życie niniejszej ustawy, stosuje się.
Art. 72. Leki zawarte w wykazie leków podstawowych, o którym mowa w art. 36 ust. 5 pkt 1, oraz leki, środki spożywcze specjalnego przeznaczenia żywieniowego, zawarte w wykazie, o którym mowa w art. 37 ust. 2 pkt 2 ustawy, o której mowa w art. 6341), w brzmieniu obowiązującym przed dniem wejścia w życie niniejszej ustawy wydawane za odpłatnością ryczałtową, minister właściwy do spraw zdrowia kwalifikuje do odpłatności ryczałtowej, o ile zgodnie z aktualną wiedzą medyczną stosuje się je dłużej niż 30 dni.
Art. 73. W celu obliczenia po raz pierwszy kwoty przekroczenia, o której mowa w art. 4 ust. 1, za planową kwotę refundacji w grupie limitowej w roku 2011 rozumie się wykonaną kwotę refundacji w tej grupie w roku 2011.
Art. 74. 1. Wysokość całkowitego budżetu na refundację w 2012 r. jest równa kwocie kosztów poniesionych w 2010 r. na finansowanie świadczeń gwarantowanych określonych w przepisach wydanych na podstawie:
1) art. 31d ustawy, o której mowa w art. 6341), w zakresie dotyczącym:
a) programów zdrowotnych w części dotyczącej leków stosowanych w terapeutycznych programach zdrowotnych,
b) leczenia szpitalnego oraz ambulatoryjnej opieki specjalistycznej w części dotyczącej leków stosowanych w chemioterapii;
2) art. 36 ust. 4 i 5, art. 37 ust. 2 i art. 38 ust. 6 ustawy, o której mowa w art. 6341).
2. W przypadku gdy po zatwierdzeniu sprawozdania finansowego Funduszu za 2011 r. koszty poniesione na finansowanie świadczeń gwarantowanych w 2011 r., o których mowa w ust. 1, będą inne niż ujęte w planie finansowym Funduszu na 2012 r. Prezes Funduszu dokonuje zmiany planu finansowego. Wysokość całkowitego budżetu na refundację w 2012 r. Prezes Funduszu dostosuje do wysokości kosztów poniesionych na finansowanie świadczeń gwarantowanych, o których mowa w ust. 1, w 2011 r.
3. Wysokość całkowitego budżetu na refundację w latach 2013 i 2014 jest równa kwocie poniesionych przez Fundusz wydatków związanych z finansowaniem świadczeń gwarantowanych, o których mowa w art. 15 ust. 2 pkt 14–18 ustawy, o której mowa w art. 6341), w brzmieniu nadanym niniejszą ustawą, w roku 2011, a począwszy od roku 2015 nie może być niższa od tej kwoty.
4. Plany finansowe Funduszu począwszy od roku 2013 są ustalane z uwzględnieniem ust. 3.
Art. 75. Urzędowa marża hurtowa, o której mowa w art. 7 ust. 1–3:
1) w roku 2012 – wynosi 7% urzędowej ceny zbytu;
2) w roku 2013 – wynosi 6% urzędowej ceny zbytu.
Art. 76. 1. Do rozpatrywania wniosków, o których mowa w art. 39 ustawy, o której mowa w art. 6341), w brzmieniu obowiązującym przed dniem wejścia w życie niniejszej ustawy, złożonych przed dniem wejścia w życie niniejszej ustawy, stosuje się przepisy niniejszej ustawy. Opłat, o których mowa w art. 32 ust. 1 i art. 35 ust. 3 nie pobiera się.
2. Dla wniosków, o których mowa w ust. 1, bieg terminów, o których mowa w art. 31, liczy się od dnia wejścia w życie niniejszej ustawy.
Art. 77. 1. Zlecenia ministra właściwego do spraw zdrowia, o których mowa w art. 31e ustawy, o której mowa w art. 6341), dotyczące świadczeń gwarantowanych, o których mowa w art. 15 ust. 2:
1) pkt 2 i 3 ustawy, o której mowa w art. 6341), z zakresu leczenia szpitalnego oraz ambulatoryjnej opieki specjalistycznej w części dotyczącej leków stosowanych w chemioterapii,
2) pkt 13 ustawy, o której mowa w art. 6341), z zakresu programów zdrowotnych w części dotyczącej terapeutycznych programów zdrowotnych,
3) pkt 14 ustawy, o której mowa w art. 6341), w brzmieniu obowiązującym przed dniem wejścia w życie niniejszej ustawy
– skierowane do Prezesa Agencji Oceny Technologii Medycznych przed dniem wejścia w życie niniejszej ustawy zachowują ważność i są rozpatrywane na zasadach dotychczasowych.
2. Rekomendacja Prezesa Agencji Oceny Technologii Medycznych wydana na podstawie zlecenia, o którym mowa w ust. 1, stanowi jedną z przesłanek uchylenia decyzji administracyjnej o objęciu refundacją leku, środka spożywczego specjalnego przeznaczenia żywieniowego oraz wyrobu medycznego.
Art. 78. Rada Konsultacyjna, o której mowa w art. 31s ustawy, o której mowa w art. 6341), w brzmieniu obowiązującym przed dniem wejścia życie niniejszej ustawy, działa na podstawie dotychczasowych przepisów i wykonuje zadania Rady Przejrzystości, o której mowa w art. 31s ustawy, o której mowa w art. 6341), w brzmieniu nadanym niniejszą ustawą, do czasu jej powołania, nie dłużej jednak niż przez 3 miesiące od dnia wejścia w życie niniejszej ustawy.
Art. 79. 1. Zespół do spraw Gospodarki Lekami, o którym mowa w art. 7 ustawy, o której mowa w art. 5942), działa na podstawie dotychczasowych przepisów i wykonuje zadania Komisji Ekonomicznej, o której mowa w art. 17, do czasu jej powołania, nie dłużej jednak niż przez miesiąc od dnia wejścia w życie niniejszej ustawy.
2. Członkowie Zespołu do spraw Gospodarki Lekami, o którym mowa w art. 7 ustawy, o której mowa w art. 5942), składają oświadczenia, o których mowa w art. 17, przed pierwszym posiedzeniem Zespołu, jednakże nie później niż w terminie 14 dni od dnia wejścia w życie niniejszej ustawy.
Art. 80. 1. Fundusz podejmie działania konieczne do zawarcia i niezwłocznie zawiera umowy, o których mowa w art. 41 i art. 48, z podmiotami prowadzącymi apteki oraz osobami uprawnionymi, o których mowa w art. 2 pkt 14 lit. b i c.
2. Strony umów określonych w art. 34 ust. 2 ustawy, o której mowa w art. 6341), dostosują ich treść do przepisów niniejszej ustawy w terminie do dnia 30 czerwca 2012 r.
3. Fundusz w terminie 15 dni od dnia wejścia w życie niniejszego przepisu:
1) przekaże ministrowi właściwemu do spraw zdrowia zestawienie, o którym mowa w art. 102 ust. 5 pkt 26 ustawy, o której mowa w art. 6341), w brzmieniu nadanym niniejszą ustawą,
2) poda do publicznej wiadomości informacje, o których mowa w art. 102 ust. 5 pkt 27 i 29 ustawy, o której mowa w art. 6341), w brzmieniu nadanym niniejszą ustawą
– za okres od dnia 1 stycznia 2011 r. do dnia ogłoszenia niniejszej ustawy.
4. Minister właściwy do spraw zdrowia podejmie czynności mające na celu powołanie Komisji Ekonomicznej, o której mowa w art. 17, oraz Rady Przejrzystości, o której mowa w art. 31s ustawy, o której mowa w art. 6341), w brzmieniu nadanym niniejszą ustawą.
Art. 81. Recepty wystawione przed dniem wejścia w życie niniejszej ustawy są realizowane na dotychczasowych zasadach.
Art. 82. Do kontroli wszczętych i niezakończonych przed dniem wejścia w życie niniejszej ustawy stosuje się przepisy dotychczasowe.
Art. 83. Objęcie pierwszym wykazem, o którym mowa w art. 68, produktów, które w dniu wejścia w życie niniejszej ustawy dopuszczone były do obrotu jako produkty lecznicze zgodnie z przepisami ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne, na podstawie dokumentacji, o której mowa w art. 17 ust. 3 ustawy, o której mowa w art. 6043), w brzmieniu obowiązującym przed dniem wejścia w życie niniejszej ustawy, jest równoznaczne z powiadomieniem, o którym mowa w art. 29 ustawy z dnia 25 sierpnia 2006 r. o bezpieczeństwie żywności i żywienia.
Art. 84. Rada Ministrów po upływie dwóch lat od dnia wejścia w życie niniejszej ustawy przedłoży Sejmowi Rzeczypospolitej Polskiej sprawozdanie z wykonania tej ustawy wraz z oceną skutków jej stosowania.
Art. 85. 1. Dotychczasowe przepisy wykonawcze, wydane na podstawie:
1) art. 45 ust. 3 ustawy, o której mowa w art. 5844),
2) art. 31d ustawy, o której mowa w art. 6341) utrzymane w mocy na podstawie art. 3 ust. 1 ustawy z dnia 23 lipca 2010 r. o zmianie ustawy o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych (Dz. U. poz. 1116),
3) art. 31j, art. 31s ust. 13, art. 36 ust. 5 pkt 4 i 5, art. 39 ust. 9, art. 39c, art. 159 ust. 5 i art. 190 ust. 2 ustawy, o której mowa w art. 6341)
– zachowują moc do dnia wejścia w życie przepisów wykonawczych wydanych na podstawie art. 45 ust. 5 ustawy, o której mowa w art. 5844), w brzmieniu nadanym niniejszą ustawą, art. 31d, 31j, 31s ust. 25 i art. 159 ust. 5 ustawy, o której mowa w art. 6341), w brzmieniu nadanym niniejszą ustawą, oraz art. 6 ust. 10, art. 24 ust. 7, art. 35 ust. 10 i art. 38 ust. 4, jednak nie dłużej niż przez okres 24 miesięcy od dnia wejścia w życie niniejszej ustawy.
2. Zachowane w mocy akty wykonawcze, o których mowa w ust. 1, wydane na podstawie art. 31d ustawy, o której mowa w art. 6341), mogą być zmienione przez ministra właściwego do spraw zdrowia, w drodze rozporządzenia, w granicach określonych w art. 31d ustawy, o której mowa w art. 6341), w brzmieniu nadanym niniejszą ustawą.
Art. 86. Ustawa wchodzi w życie z dniem 1 stycznia 2012 r., z wyjątkiem:
1) art. 11, art. 17–23, art. 41 ust. 1–5 i 8, art. 48 ust. 1–6, art. 63 pkt 26, art. 67, art. 68 ust. 2 i 3, art. 71, art. 74, art. 79 i art. 80, które wchodzą w życie po upływie 14 dni od dnia ogłoszenia45);
2) art. 63 pkt 13, który wchodzi w życie z dniem 1 lipca 2012 r.
1) Niniejsza ustawa dokonuje w zakresie swojej regulacji wdrożenia dyrektywy Rady 89/105/EWG z dnia 21 grudnia 1988 r. dotyczącej przejrzystości środków regulujących ustalanie cen na produkty lecznicze przeznaczone do użytku przez człowieka oraz włączenia ich w zakres krajowego systemu ubezpieczeń zdrowotnych (Dz. Urz. WE L 40 z 11.02.1989, str. 8; Dz. Urz. UE Polskie wydanie specjalne, rozdz. 5, t. 1, str. 345).
2) Zmiany tekstu jednolitego wymienionej ustawy zostały ogłoszone w Dz. U. z 2020 r. poz. 1492, 1493, 1578, 1875, 2112, 2345 i 2401 oraz z 2021 r. poz. 97 i 159.
3) Dodany przez art. 10 pkt 1 ustawy z dnia 27 listopada 2020 r. o zmianie niektórych ustaw w celu zapewnienia w okresie ogłoszenia stanu zagrożenia epidemicznego lub stanu epidemii kadr medycznych (Dz. U. poz. 2401), która weszła w życie z dniem 30 grudnia 2020 r.; wszedł w życie z dniem 1 stycznia 2021 r.
4) Zmiany tekstu jednolitego wymienionej ustawy zostały ogłoszone w Dz. U. z 2020 r. poz. 1493, 1875, 2345 i 2401 oraz z 2021 r. poz. 97 i 159.
5) Dodany przez art. 36 pkt 1 ustawy z dnia 7 października 2020 r. o Funduszu Medycznym (Dz. U. poz. 1875), która weszła w życie z dniem 26 listopada 2020 r.
6) W brzmieniu ustalonym przez art. 36 pkt 2 lit. a ustawy, o której mowa w odnośniku 5.
7) Dodany przez art. 36 pkt 2 lit. b ustawy, o której mowa w odnośniku 5.
8) W brzmieniu ustalonym przez art. 36 pkt 3 ustawy, o której mowa w odnośniku 5.
9) Dodany przez art. 36 pkt 4 lit. a ustawy, o której mowa w odnośniku 5.
10) W brzmieniu ustalonym przez art. 36 pkt 4 lit. b ustawy, o której mowa w odnośniku 5.
11) Dodany przez art. 36 pkt 5 ustawy, o której mowa w odnośniku 5.
12) W brzmieniu ustalonym przez art. 36 pkt 6 lit. a ustawy, o której mowa w odnośniku 5.
13) Dodany przez art. 36 pkt 6 lit. b ustawy, o której mowa w odnośniku 5.
14) W brzmieniu ustalonym przez art. 36 pkt 7 ustawy, o której mowa w odnośniku 5.
15) W brzmieniu ustalonym przez art. 36 pkt 8 lit. a ustawy, o której mowa w odnośniku 5.
16) W brzmieniu ustalonym przez art. 36 pkt 8 lit. b ustawy, o której mowa w odnośniku 5.
17) W brzmieniu ustalonym przez art. 36 pkt 8 lit. c ustawy, o której mowa w odnośniku 5.
18) W brzmieniu ustalonym przez art. 36 pkt 9 ustawy, o której mowa w odnośniku 5.
19) Dodany przez art. 2 pkt 1 ustawy z dnia 16 kwietnia 2020 r. o zmianie ustawy o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych oraz niektórych innych ustaw (Dz. U. poz. 945), która weszła w życie z dniem 1 lipca 2020 r.
20) Dodany przez art. 36 pkt 10 ustawy, o której mowa w odnośniku 5.
21) W brzmieniu ustalonym przez art. 10 pkt 2 lit. a ustawy, o której mowa w odnośniku 3; weszła w życie z dniem 1 stycznia 2021 r.
22) Dodany przez art. 10 pkt 2 lit. b ustawy, o której mowa w odnośniku 3; weszła w życie z dniem 1 stycznia 2021 r.
23) W brzmieniu ustalonym przez art. 10 pkt 2 lit. c ustawy, o której mowa w odnośniku 3; weszła w życie z dniem 1 stycznia 2021 r.
24) W brzmieniu ustalonym przez art. 10 pkt 2 lit. d ustawy, o której mowa w odnośniku 3; weszła w życie z dniem 1 stycznia 2021 r.
25) Dodany przez art. 10 pkt 3 lit. a ustawy, o której mowa w odnośniku 3; weszła w życie z dniem 1 stycznia 2021 r.
26) W brzmieniu ustalonym przez art. 10 pkt 3 lit. b ustawy, o której mowa w odnośniku 3; weszła w życie z dniem 1 stycznia 2021 r.
27) Zdanie drugie ze zmianą wprowadzoną przez art. 14 ustawy z dnia 21 stycznia 2021 r. o zmianie ustawy o szczególnych rozwiązaniach związanych z zapobieganiem, przeciwdziałaniem i zwalczaniem COVID-19, innych chorób zakaźnych oraz wywołanych nimi sytuacji kryzysowych oraz niektórych innych ustaw (Dz. U. poz. 159), która weszła w życie z dniem 26 stycznia 2021 r., wszedł w życie z dniem 26 stycznia 2021 r., z mocą od dnia 1 stycznia 2021 r.
28) W brzmieniu ustalonym przez art. 10 pkt 4 lit. a ustawy, o której mowa w odnośniku 3; weszła w życie z dniem 1 stycznia 2021 r.
29) Dodany przez art. 10 pkt 4 lit. b ustawy, o której mowa w odnośniku 3; weszła w życie z dniem 1 stycznia 2021 r.
30) Zmiana wymienionego rozporządzenia została ogłoszona w Dz. Urz. UE L 127 z 23.05.2018, str. 2.
31) Przez art. 10 pkt 4 lit. c ustawy, o której mowa w odnośniku 3; weszła w życie z dniem 1 stycznia 2021 r.
32) Dodany przez art. 36 pkt 11 ustawy, o której mowa w odnośniku 5.
33) Dodany przez art. 2 pkt 2 ustawy, o której mowa w odnośniku 19.
34) Dodana przez art. 2 pkt 3 lit. a ustawy, o której mowa w odnośniku 19.
35) W brzmieniu ustalonym przez art. 2 pkt 3 lit. b tiret pierwsze ustawy, o której mowa w odnośniku 19.
36) W brzmieniu ustalonym przez art. 2 pkt 3 lit. b tiret drugie ustawy, o której mowa w odnośniku 19.
37) W brzmieniu ustalonym przez art. 2 pkt 3 lit. b tiret trzecie ustawy, o której mowa w odnośniku 19.
38) W brzmieniu ustalonym przez art. 2 pkt 3 lit. b tiret czwarte ustawy, o której mowa w odnośniku 19.
39) W brzmieniu ustalonym przez art. 2 pkt 3 lit. b tiret piąte ustawy, o której mowa w odnośniku 19.
40) Przez art. 11 ustawy z dnia 14 sierpnia 2020 r. o zmianie niektórych ustaw w celu zapewnienia funkcjonowania ochrony zdrowia w związku z epidemią COVID-19 oraz po jej ustaniu (Dz. U. poz. 1493), która weszła w życie z dniem 1 września 2020 r.
41) Artykuł 63 zawiera zmiany do ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych.
42) Artykuł 59 zawiera zmiany do ustawy z dnia 5 lipca 2001 r. o cenach.
43) Artykuł 60 zawiera zmiany do ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne.
44) Artykuł 58 zawiera zmiany do ustawy z dnia 5 grudnia 1996 r. o zawodzie lekarza i lekarza dentysty.
45) Ustawa została ogłoszona w dniu 13 czerwca 2011 r.
- Data ogłoszenia: 2021-03-23
- Data wejścia w życie: 2021-03-23
- Data obowiązywania: 2022-01-01
- Dokument traci ważność: 2022-02-24
- USTAWA z dnia 20 maja 2021 r. o zmianie ustawy o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych oraz niektórych innych ustaw
- USTAWA z dnia 24 czerwca 2021 r. o zmianie ustawy o Agencji Badań Medycznych oraz niektórych innych ustaw
- USTAWA z dnia 14 października 2021 r. o zmianie ustawy – Kodeks karny oraz niektórych innych ustaw
- USTAWA z dnia 17 listopada 2021 r. o zmianie ustawy o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych oraz niektórych innych ustaw
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
