REKLAMA
Dziennik Ustaw - rok 2021 poz. 504
OBWIESZCZENIE
MINISTRA ZDROWIA
z dnia 17 lutego 2021 r.
w sprawie ogłoszenia jednolitego tekstu rozporządzenia Ministra Zdrowia w sprawie leczenia krwią i jej składnikami w podmiotach leczniczych wykonujących działalność leczniczą w rodzaju stacjonarne i całodobowe świadczenia zdrowotne
1. Na podstawie art. 16 ust. 3 ustawy z dnia 20 lipca 2000 r. o ogłaszaniu aktów normatywnych i niektórych innych aktów prawnych (Dz. U. z 2019 r. poz. 1461) ogłasza się w załączniku do niniejszego obwieszczenia jednolity tekst rozporządzenia Ministra Zdrowia z dnia 16 października 2017 r. w sprawie leczenia krwią i jej składnikami w podmiotach leczniczych wykonujących działalność leczniczą w rodzaju stacjonarne i całodobowe świadczenia zdrowotne (Dz. U. poz. 2051), z uwzględnieniem zmian wprowadzonych:
1) rozporządzeniem Ministra Zdrowia z dnia 8 lipca 2019 r. zmieniającym rozporządzenie w sprawie leczenia krwią i jej składnikami w podmiotach leczniczych wykonujących działalność leczniczą w rodzaju stacjonarne i całodobowe świadczenia zdrowotne (Dz. U. poz. 1441);
2) rozporządzeniem Ministra Zdrowia z dnia 26 marca 2020 r. zmieniającym rozporządzenie w sprawie leczenia krwią i jej składnikami w podmiotach leczniczych wykonujących działalność leczniczą w rodzaju stacjonarne i całodobowe świadczenia zdrowotne (Dz. U. poz. 535).
2. Podany w załączniku do niniejszego obwieszczenia tekst jednolity rozporządzenia nie obejmuje:
1) § 2 i § 3 rozporządzenia Ministra Zdrowia z dnia 8 lipca 2019 r. zmieniającego rozporządzenie w sprawie leczenia krwią i jej składnikami w podmiotach leczniczych wykonujących działalność leczniczą w rodzaju stacjonarne i całodobowe świadczenia zdrowotne (Dz. U. poz. 1441), które stanowią:
"§ 2. 1. Dotychczasowe karty identyfikacyjne grupy krwi mogą być wydawane do wyczerpania zapasów, jednak nie dłużej niż przez okres 12 miesięcy od dnia wejścia w życie rozporządzenia.
2. Karty identyfikacyjne grupy krwi wydane przed dniem wejścia w życie niniejszego rozporządzenia zachowują swoją ważność.
§ 3. Rozporządzenie wchodzi w życie po upływie 2 miesięcy od dnia ogłoszenia.";
2) § 2 rozporządzenia Ministra Zdrowia z dnia 26 marca 2020 r. zmieniającego rozporządzenie w sprawie leczenia krwią i jej składnikami w podmiotach leczniczych wykonujących działalność leczniczą w rodzaju stacjonarne i całodobowe świadczenia zdrowotne (Dz. U. poz. 535), który stanowi:
"§ 2. Rozporządzenie wchodzi w życie z dniem następującym po dniu ogłoszenia.".
Minister Zdrowia: wz. W. Kraska
Załącznik do obwieszczenia Ministra Zdrowia
z dnia 17 lutego 2021 r. (poz. 504)
ROZPORZĄDZENIE
MINISTRA ZDROWIA1)
z dnia 16 października 2017 r.
w sprawie leczenia krwią i jej składnikami w podmiotach leczniczych wykonujących działalność leczniczą w rodzaju stacjonarne i całodobowe świadczenia zdrowotne2)
Na podstawie art. 21 ust. 8 ustawy z dnia 22 sierpnia 1997 r. o publicznej służbie krwi (Dz. U. z 2020 r. poz. 1777 oraz z 2021 r. poz. 159) zarządza się, co następuje:
Rozdział 1
Przepisy ogólne
§ 1. 1. Rozporządzenie określa:
1) sposób i organizację leczenia krwią w podmiotach leczniczych wykonujących działalność leczniczą w rodzaju stacjonarne i całodobowe świadczenia zdrowotne, w których przebywają pacjenci ze wskazaniami do leczenia krwią i jej składnikami, zwanych dalej "podmiotami leczniczymi", w tym zadania kierownika podmiotu leczniczego, ordynatora albo lekarza kierującego oddziałem oraz lekarzy, pielęgniarek i położnych;
2) organizację banku krwi oraz pracowni serologii lub pracowni immunologii transfuzjologicznej podmiotu leczniczego, a także sposób sprawowania nadzoru nad działaniem banku krwi oraz pracowni serologii lub pracowni immunologii transfuzjologicznej w tym podmiocie leczniczym, w tym wymagane kwalifikacje i doświadczenie kierownika banku krwi lub pracowni serologii lub pracowni immunologii transfuzjologicznej oraz jego zadania;
3) sposób prowadzenia dokumentacji medycznej dotyczącej leczenia krwią i jej składnikami;
4) sposób zapewnienia dostępu do badań z zakresu immunologii transfuzjologicznej.
2. Ilekroć w rozporządzeniu jest mowa o:
1) pracowni immunologii transfuzjologicznej - rozumie się przez to również pracownię serologii;
2) walidacji - rozumie się przez to przedstawienie obiektywnych dowodów potwierdzających, że zostały spełnione szczególne wymagania dotyczące zamierzonego, specyficznego zastosowania określonej procedury albo procesu.
3.3) Przepisy rozdziałów 2-5 stosuje się odpowiednio do:
1) pracowni immunologii transfuzjologicznej wykonujących badania immunohematologiczne oraz
2) banków krwi świadczących usługi przechowywania i wydawania krwi i jej składników
- na rzecz podmiotów leczniczych, innych podmiotów wykonujących działalność leczniczą oraz, w zakresie badań immunohematologicznych, na rzecz osób fizycznych, jeżeli przepisy rozporządzenia nie zawierają regulacji skierowanych wprost do tych podmiotów.
4.3) Dopuszcza się stosowanie wzorów określonych w załącznikach do rozporządzenia ze zmienioną szatą graficzną i zmienionym układem strony, przy zachowaniu treści poszczególnych rubryk i zakresu wymaganych w nich informacji.
Rozdział 2
Organizacja leczenia krwią i jej składnikami w jednostkach lub komórkach organizacyjnych podmiotu leczniczego
§ 2. Leczenie krwią i jej składnikami w podmiocie leczniczym organizuje się w sposób zapewniający:4)
1) niezwłoczne, całodobowe zaopatrzenie jednostek lub komórek organizacyjnych zakładu leczniczego w krew i jej składniki;
2) badania z zakresu immunologii transfuzjologicznej, zwane dalej "badaniami immunohematologicznymi", takie jak grupa krwi i próba zgodności krwi dawcy i biorcy przed przetoczeniem, zwana dalej "próbą zgodności", warunkujące bezpieczne przetaczanie krwi i jej składników, zwane dalej "przetoczeniem", oraz kwalifikujące kobiety RhD ujemne do podania immunoglobuliny anty-RhD podczas ciąży lub po porodzie;
3) identyfikację i rejestrowanie wszelkich niepożądanych zdarzeń i niepożądanych reakcji, w szczególności poważnych niepożądanych zdarzeń i poważnych niepożądanych reakcji związanych z przetoczeniem, a także sporządzanie raportów o tych zdarzeniach i reakcjach.
§ 3. 1. Lekarz jest odpowiedzialny za:
1) ustalenie wskazań do przetoczenia;
2) identyfikację biorcy krwi na podstawie danych, o których mowa w § 11 ust. 1 pkt 1 i 2, i kontrolę dokumentacji medycznej przed przetoczeniem;
3) zabieg przetoczenia;
4) prawidłowe udokumentowanie zabiegu przetoczenia;
5) sporządzanie raportów o niepożądanych zdarzeniach i niepożądanych reakcjach, w tym poważnych niepożądanych zdarzeniach i reakcjach.
2. Pielęgniarka lub położna jest odpowiedzialna za:
1) czynności związane z pobieraniem próbek krwi od pacjentów;
2) identyfikację biorcy krwi, na podstawie danych, o których mowa w § 11 ust. 1 pkt 1 i 2, i kontrolę dokumentacji medycznej przed przetoczeniem;
3) obserwację biorcy krwi w trakcie przetoczenia i po przetoczeniu, niezwłoczne informowanie lekarza o objawach występujących w trakcie przetoczenia i po przetoczeniu mogących świadczyć o niepożądanych reakcjach, w tym poważnych niepożądanych reakcjach;
4) przekazywanie wypełnionego i podpisanego przez lekarza zlecenia na badania immunohematologiczne oraz badania kwalifikujące do podania immunoglobuliny anty-RhD oraz zamówienia na krew lub jej składniki do banku krwi lub właściwego centrum, o którym mowa w art. 23 ust. 3a, 4a i 5a ustawy z dnia 22 sierpnia 1997 r. o publicznej służbie krwi, zwanej dalej "ustawą";
5) prawidłowe udokumentowanie zabiegu przetoczenia;
6) niezwłoczne informowanie lekarza o niepożądanych zdarzeniach, w tym poważnych niepożądanych zdarzeniach.
3. Naczelna pielęgniarka lub położna lub osoba nadzorująca pracę pielęgniarek lub położnych, w porozumieniu z ordynatorem lub inną osobą kierującą jednostką lub komórką organizacyjną zakładu leczniczego, ustala imienną listę pielęgniarek lub położnych uprawnionych do dokonywania przetoczeń i czynności związanych z tym zabiegiem, posiadających zaświadczenie o odbyciu szkolenia określone w przepisach wydanych na podstawie art. 21 ust. 7 ustawy i przedstawia do zatwierdzenia kierownikowi podmiotu leczniczego.
§ 4. 1. Do zadań lekarzy i pielęgniarek lub położnych wykonujących czynności związane z przetoczeniem należy:
1) wypełnienie zlecenia na badania immunohematologiczne oraz zamówienia na krew i jej składniki - dotyczy wyłącznie lekarza;
2) złożenie zamówienia na krew i jej składniki;
3)5) pobranie od pacjenta próbek krwi w celu wykonania badań immunohematologicznych;
4) poinformowanie pacjenta o ryzyku i korzyściach wynikających z przetoczenia - dotyczy wyłącznie lekarza;
5) identyfikacja biorcy krwi na podstawie danych, o których mowa w § 11 ust. 1 pkt 1 i 2, i kontrola dokumentacji medycznej przed zabiegiem przetoczenia;
6) zabieg przetoczenia;
7) obserwacja pacjenta w trakcie przetoczenia i po przetoczeniu oraz podjęcie odpowiednich czynności, jeżeli wystąpi niepożądana reakcja.
2. Informacje o zabiegu przetoczenia i niepożądanych zdarzeniach i niepożądanych reakcjach, w tym poważnych niepożądanych zdarzeniach i poważnych niepożądanych reakcjach, mających miejsce w trakcie przetoczenia lub bezpośrednio po przetoczeniu, odnotowuje się w historii choroby, książce transfuzyjnej, której wzór jest określony w załączniku nr 1 do rozporządzenia, karcie informacyjnej z leczenia szpitalnego pacjenta oraz księdze raportów pielęgniarskich.
3. Wpisu w książce transfuzyjnej dokonuje pielęgniarka lub położna, przy czym każdy wpis musi być sprawdzony przez lekarza odpowiedzialnego za przetoczenie i potwierdzony. Potwierdzenie obejmuje wskazanie imienia, nazwiska lekarza, tytułu zawodowego, specjalizacji, numeru prawa wykonywania zawodu oraz czytelny podpis.
4. Dokumentacja wskazana w ust. 2 może być prowadzona w postaci elektronicznej w sposób określony w przepisach wydanych na podstawie art. 30 ust. 1 ustawy z dnia 6 listopada 2008 r. o prawach pacjenta i Rzeczniku Praw Pacjenta (Dz. U. z 2020 r. poz. 849).
§ 5. 1. Kierownik podmiotu leczniczego wyznacza lekarza specjalistę w dziedzinie transfuzjologii klinicznej jako lekarza odpowiedzialnego za gospodarkę krwią i jej składnikami, zwanego dalej "lekarzem odpowiedzialnym za gospodarkę krwią".
2. W przypadku gdy w podmiocie leczniczym nie zatrudnia się lekarza specjalisty w dziedzinie transfuzjologii klinicznej, obowiązki lekarza odpowiedzialnego za gospodarkę krwią powierza się innemu lekarzowi specjaliście, który wykonuje czynności w jednostkach lub komórkach organizacyjnych zakładu leczniczego, w których często przetacza się krew i jej składniki.
3. Lekarz odpowiedzialny za gospodarkę krwią:
1) odbywa przeszkolenie w jednej z jednostek organizacyjnych publicznej służby krwi, o których mowa w art. 4 ust. 3 ustawy, nie rzadziej niż co 4 lata;
2) bierze udział w kursach i seminariach organizowanych przez jednostki organizacyjne publicznej służby krwi, o których mowa w art. 4 ust. 3 ustawy.
4. Do zadań lekarza odpowiedzialnego za gospodarkę krwią należy:
1) nadzór nad leczeniem krwią i jej składnikami w jednostkach lub komórkach organizacyjnych zakładu leczniczego;
2) planowanie zaopatrzenia podmiotu leczniczego w krew i jej składniki;
3) kierowanie bankiem krwi, jeżeli tej czynności nie powierzono kierownikowi pracowni immunologii transfuzjologicznej;
4) nadzorowanie przestrzegania SOP przez bank krwi, pracownię immunologii transfuzjologicznej lub inne jednostki lub komórki organizacyjne zakładu leczniczego;
5)6) organizacja wewnętrznych szkoleń lekarzy i pielęgniarek lub położnych w dziedzinie leczenia krwią i jej składnikami w podmiocie leczniczym oraz szkoleń dla pracowników banku krwi, w zakresie zadań określonych w § 16 ust. 2;
6) przekazywanie do instytutu, o którym mowa w art. 4 ust. 3 pkt 1 ustawy, za pośrednictwem właściwego centrum raportów o niepożądanych zdarzeniach i niepożądanych reakcjach;
7) sporządzanie i przekazywanie do właściwego centrum rocznych sprawozdań z działalności podmiotu leczniczego w zakresie krwiolecznictwa, nie później niż do dnia 30 stycznia każdego roku, za rok poprzedni.
§ 6. 1.7) SOP w zakresie leczenia krwią i jej składnikami w podmiotach leczniczych dotyczą wszystkich czynności wynikających z rozdziałów 2-5 oraz sposobu prowadzenia dokumentacji, jak również czynności związanych z pobieraniem próbek krwi, pobieraniem krwi podczas zabiegów leczniczych, nadzorem nad sprzętem, aparaturą, warunkami przechowywania i transportu składników krwi.
2. Zmiany w wykonywaniu danej procedury wprowadza się, sporządzając nową SOP lub uaktualniając dotychczasową wersję SOP.
3. Czynności określone w rozdziałach 2-5 opisuje się w SOP.
4. Kierownik podmiotu leczniczego lub wyznaczona przez niego osoba przechowuje oryginał SOP.
5. Kopie SOP sporządza się dla każdego stanowiska pracy związanego z leczeniem krwią i jej składnikami.
6. Kopie SOP, o których mowa w ust. 5, przechowuje się przy stanowisku pracy i u kierownika jednostki lub komórki organizacyjnej zakładu leczniczego.
7. SOP sporządza się według wzoru określonego w załączniku nr 2 do rozporządzenia.
8. SOP zatwierdza kierownik podmiotu leczniczego.
9. Oryginały nieaktualnych SOP należy przechowywać 30 lat.
§ 7. 1. Wpis dokonany w dokumentacji dotyczący leczenia krwią i jej składnikami umożliwiający prześledzenie losów przetoczenia i związanych z tym badań nie może być z niej usunięty.
2. Poprawek lub zmian w dokumentacji należy dokonywać w taki sposób, aby możliwe było jednoznaczne rozróżnienie danych pierwotnych od danych, które poprawiono lub zmieniono.
3. Poprawkę lub zmianę należy każdorazowo opatrzyć podpisem osoby, która tę poprawkę lub zmianę wprowadziła, oraz datą jej dokonania.
§ 8. 1. W podmiocie leczniczym, w którym krew i jej składniki są przetaczane w więcej niż czterech jednostkach lub komórkach organizacyjnych zakładu leczniczego, kierownik podmiotu leczniczego powołuje komitet transfuzjologiczny, zwany dalej "komitetem", w celu:
1) rozwiązywania problemów dotyczących leczenia krwią i jej składnikami;
2) rozwiązywania problemów związanych z gospodarką krwią i jej składnikami;
3) sprawowania nadzoru nad leczeniem krwią i jej składnikami.
2. W skład komitetu wchodzą:
1) ordynatorzy lub inne osoby kierujące jednostkami lub komórkami organizacyjnymi zakładu leczniczego, w których często przetacza się krew i jej składniki, lub ich zastępcy;
2) lekarz odpowiedzialny za gospodarkę krwią;
3) lekarz specjalista anestezjologii i intensywnej terapii;
4) kierownik pracowni immunologii transfuzjologicznej;
5) pielęgniarka lub położna dokonująca przetoczeń.
3. Komitet współpracuje z jednostkami organizacyjnymi publicznej służby krwi, o których mowa w art. 4 ust. 3 ustawy, w szczególności z właściwym centrum.
4. Do zadań komitetu należy w szczególności:
1) dokonywanie okresowej oceny wskazań do przetoczenia, nie rzadziej niż raz na 6 miesięcy;
2) analiza zużycia krwi i jej składników w celu ograniczenia niepotrzebnych przetoczeń i nadmiernych zniszczeń krwi i jej składników;
3) nadzór nad działaniami związanymi z leczeniem krwią lub jej składnikami oraz nadzór nad związaną z tym dokumentacją;
4) ocena prawidłowości postępowania podczas przetoczeń wykonanych w podmiocie leczniczym, nie rzadziej niż raz na 6 miesięcy;
5) analiza każdego niepożądanego zdarzenia i każdej niepożądanej reakcji wraz z oceną postępowania;
6) analiza raportów o niepożądanych zdarzeniach i reakcjach;
7) opracowywanie wewnętrznych programów kształcenia lekarzy i pielęgniarek lub położnych w dziedzinie leczenia krwią i jej składnikami oraz nadzór nad ich realizacją;
8) udział w planowaniu zaopatrzenia w krew i jej składniki oraz w rocznej sprawozdawczości dotyczącej ich zużycia.
5. Raporty i okresowe sprawozdania z działalności komitetu są przekazywane kierownikowi podmiotu leczniczego i kierownikowi właściwego centrum nie rzadziej niż raz na rok, najpóźniej do dnia 30 stycznia każdego roku, za rok poprzedni.
6. Specjalistyczny nadzór nad leczeniem krwią i jej składnikami, o którym mowa w art. 27 ust. 1 pkt 12 ustawy, sprawuje właściwe centrum; w ramach sprawowanego nadzoru właściwe centrum przeprowadza kontrolę, o której mowa w art. 29 ust. 1 ustawy, co najmniej raz na dwa lata.
§ 8a.8) 1. W przypadku stanu zagrożenia epidemicznego lub stanu epidemii albo w razie niebezpieczeństwa szerzenia się zakażenia lub choroby zakaźnej, które może stanowić zagrożenie dla zdrowia publicznego, w szczególności wystąpienia choroby szczególnie niebezpiecznej i wysoce zakaźnej w rozumieniu art. 2 pkt 4 ustawy z dnia 5 grudnia 2008 r. o zapobieganiu oraz zwalczaniu zakażeń i chorób zakaźnych u ludzi (Dz. U. z 2020 r. poz. 1845, 2112 i 2401 oraz z 2021 r. poz. 159, 180 i 255) lub innych nadzwyczajnych okoliczności zagrażających zdrowiu i życiu wielu osób kierownik właściwej jednostki organizacyjnej publicznej służby krwi może przesunąć termin kontroli, o której mowa w § 8 ust. 6, jednorazowo o okres nieprzekraczający sześciu miesięcy, licząc od dnia upływu dwóch lat od ostatniej kontroli.
2. W przypadku nieustania okoliczności będących podstawą przesunięcia terminu kontroli w czasie, o który został przesunięty termin kontroli, kierownik właściwej jednostki organizacyjnej publicznej służby krwi może powtórnie przesunąć termin kontroli o okres nieprzekraczający trzech miesięcy.
§ 9.9) 1. Lekarz wypisuje zamówienie indywidualne na krew lub jej składniki na podstawie potwierdzonego wyniku badania grupy krwi pacjenta, informacji dotyczących poprzednich przetoczeń oraz szczególnych wskazań dotyczących krwi lub jej składnika. Wzór zamówienia jest określony w załączniku nr 3 do rozporządzenia.
2. Potwierdzonym wynikiem grupy krwi jest wyłącznie wynik oparty na dwóch badaniach, wykonanych z dwóch próbek krwi pobranych od pacjenta, każdorazowo zidentyfikowanego, w różnym czasie, z dwóch różnych miejsc wkłucia.
3. Badania wymienione w ust. 2 obejmują:
1) dwukrotne oznaczenie antygenów A, B i D, oznaczenie przeciwciał regularnych anty-A i anty-B oraz, przynajmniej w jednym badaniu, przeciwciał odpornościowych;
2) u biorców krwi, którym wykonywano próbę zgodności, jedno badanie obejmuje oznaczenie antygenów A, B i D, oznaczenie przeciwciał regularnych anty-A i anty-B oraz przeciwciał odpornościowych, a drugie badanie obejmuje oznaczenie antygenów A, B i D wykonanych przy próbie zgodności;
3) u noworodków i niemowląt do 4 miesiąca życia - dwukrotne oznaczenie antygenów A, B i D - nie bada się obecności przeciwciał anty-A i anty-B;
4) w przypadku pacjentów po przeszczepieniu krwiotwórczych komórek macierzystych w niezgodności ABO potwierdzony wynik grupy krwi wydany przed przeszczepieniem nie stanowi podstawy do zamawiania składników krwi; do czasu konwersji grupy krwi na grupę dawcy komórek krwiotwórczych pracownia immunologii transfuzjologicznej na zlecenie lekarza wykonuje oznaczenia antygenów A i B oraz przeciwciał anty-A i anty-B i na podstawie otrzymanych reakcji wydaje wynik określający zalecenia odnośnie zamawiania poszczególnych składników krwi do przetoczenia.
4. Za potwierdzony wynik grupy krwi uznaje się:
1) dwa zgodne wyniki badań określonych w ust. 3;
2) wynik zawierający wpisy o dwóch zgodnych oznaczeniach określonych w ust. 3;
3) wynik wpisany w karcie grupy krwi, której wzór jest określony w załączniku nr 4 do rozporządzenia;
4) wynik wpisany legitymacji służbowej żołnierzy zawodowych, w sposób określony w § 36.
5. Potwierdzony wynik grupy krwi wydaje się pacjentowi w postaci papierowej albo w formie przedstawionej w ust. 4 pkt 3 i 4. Wynik grupy krwi z jednego oznaczenia, zwany dalej "niepotwierdzonym wynikiem grupy krwi", wydaje się pacjentowi w postaci papierowej.
6. W przypadku braku potwierdzonego wyniku grupy krwi albo jeżeli istnieją wątpliwości co do wiarygodności wyniku badania grupy krwi, lekarz może wypisać zamówienie indywidualne na krew lub jej składniki na podstawie niepotwierdzonego wyniku grupy krwi, pod warunkiem jednoczesnego zlecenia wykonania kolejnego oznaczenia grupy krwi przed wydaniem krwi lub jej składników; w przypadku koncentratu krwinek czerwonych, zwanego dalej "KKCz", krwi pełnej konserwowanej, zwanej dalej "KPK", i koncentratu granulocytarnego, zwanego dalej "KG", dopuszcza się wykonanie drugiego oznaczenia grupy krwi i próby zgodności z jednej próbki krwi albo wykonanie tylko próby zgodności, jeżeli pozwoli to na uzyskanie potwierdzonego wyniku grupy krwi, zgodnie z ust. 3 pkt 2.
7. W przypadku braku wyniku grupy krwi, lekarz zleca wykonanie oznaczenia grupy krwi, a w przypadku konieczności przetoczenia krwi lub jej składników, zleca pobranie drugiej próbki krwi na ponowne oznaczenie grupy krwi w celu uzyskania wyniku potwierdzonego i wykonania próby zgodności, jeżeli jest wymagana.
8. W przypadku braku wyniku grupy krwi, jeżeli przetoczenie jest pilne albo w przypadku trudności w pobraniu krwi, w celu wykonania dwóch oznaczeń grupy krwi i uzyskania potwierdzonego wyniku dopuszcza się jednoczasowe pobranie dwóch próbek krwi, pod warunkiem udokumentowanego przeprowadzenia identyfikacji pacjenta przez złożenie czytelnego podpisu na zleceniu wykonania badania grupy krwi przez dwie osoby przeprowadzające identyfikację. W obydwu pobranych próbkach wykonuje się badania, o których mowa w ust. 3.
9. W przypadku noworodków z niską masą urodzeniową dopuszcza się wydanie potwierdzonego wyniku grupy krwi na podstawie oznaczenia grupy krwi z krwi pępowinowej oraz z jednej próbki krwi żylnej. W przypadku braku możliwości pobrania próbki krwi żylnej lekarz podejmuje decyzję o przetoczeniu KKCz grupy O, koncentratu krwinek płytkowych, zwanych dalej "KKP", rekonstytuowanego grupy O zawieszonego w osoczu AB albo w roztworze wzbogacającym, KKP grupy AB, osocza albo krioprecypitatu grupy AB.
10. Próbkę krwi pobiera się na podstawie wypełnionego i podpisanego przez lekarza zlecenia na badanie grupy krwi, którego wzór jest określony w załączniku nr 5 do rozporządzenia, lub zlecenia na wykonanie próby zgodności, którego wzór jest określony w załączniku nr 6 do rozporządzenia.
11. Na podstawie wyniku badania grupy krwi, którego wzór jest określony w załączniku nr 7 do rozporządzenia, lekarz wypełnia zamówienie indywidualne na krew i jej składniki, które jest przekazywane do banku krwi lub do właściwego centrum.
12. Przed wydaniem z banku krwi próbek krwi dawców do badań immunohematologicznych pracownik sprawdza zgodność grupy krwi i numeru donacji na segmencie drenu, będącego próbką krwi dawcy, z grupą krwi i numerem donacji na etykiecie pojemnika i po wpisaniu tych danych na zleceniu na wykonanie próby zgodności zlecenie wraz z próbką krwi, o której mowa w ust. 10, przekazuje się do pracowni immunologii transfuzjologicznej.
13. W przypadku pilnego przetoczenia:
1) lekarz może podjąć decyzję o przetoczeniu KKCz albo KPK zgodnych w układzie ABO i RhD, przed wykonaniem próby zgodności, na podstawie potwierdzonego wyniku grupy krwi;
2) przy braku potwierdzonego wyniku grupy krwi lekarz podejmuje decyzję o przetoczeniu:
a) KKCz grupy O,
b) w przypadku pacjentów z alloprzeciwciałami anty-D, dziewczynek oraz kobiet w wieku rozrodczym - KKCz grupy O RhD ujemny, K ujemny - jeżeli u pacjentki nie wykryto lub nie badano antygenu K,
c) osocza grupy AB,
d) rekonstytuowanego KKP grupy O zawieszonego w osoczu AB albo w roztworze wzbogacającym albo KKP grupy AB;
3) po wydaniu KKCz do pilnego przetoczenia, pracownia immunologii transfuzjologicznej niezwłocznie przystępuje do oznaczania grupy krwi, w przypadku jej braku, oraz do wykonania próby zgodności, zgodnie z ust. 8; do dalszych przetoczeń należy kwalifikować krew i jej składniki, zgodne z biorcą w układzie ABO i RhD; jeżeli wynik próby zgodności wskazuje na niezgodność, pracownia niezwłocznie powiadamia o tym lekarza prowadzącego leczenie w celu przerwania przetoczenia.
14. W przypadku, o którym mowa w ust. 13 pkt 2, przy braku KKCz O RhD ujemny K ujemny, u pacjentów bez przeciwciał anty-D lub anty-K, dopuszcza się przetoczenie KKCz grupy O RhD dodatni.
15. W przypadku, o którym mowa w ust. 13, do banku krwi przekazuje się zamówienie na krew lub jej składniki do pilnego przetoczenia, którego wzór jest określony w załączniku nr 8 do rozporządzenia. Jednocześnie lekarz, w przypadku braku wyniku badania grupy krwi, wypełnia zlecenie na badanie grupy krwi ABO i RhD oraz zlecenie wykonania próby zgodności. Po otrzymaniu potwierdzonego wyniku badania grupy krwi do dalszych przetoczeń, lekarz stosuje krew i jej składniki zgodne w układzie ABO i RhD.
§ 10. 1. Od pacjenta pobiera się krew żylną, a w wyjątkowych przypadkach krew tętniczą lub pępowinową, w sposób i na zasadach określonych przez pracownię immunologii transfuzjologicznej.
2.10) Bezpośrednio przed pobraniem osoba pobierająca dokonuje jednoznacznej identyfikacji i weryfikacji tożsamości pacjenta. Po pobraniu, na etykiecie probówki, w obecności pacjenta, na podstawie danych uzyskanych od pacjenta, a jeżeli jest to niemożliwe - danych uzyskanych na podstawie stosowanego w podmiocie leczniczym znaku identyfikacyjnego, wpisuje się następujące dane:
1) nazwisko i imię pacjenta (wielkimi literami);
2) numer PESEL pacjenta, a w przypadku braku numeru PESEL - datę urodzenia pacjenta;
3) datę i godzinę pobrania próbki krwi.
3. W przypadku braku możliwości uzyskania danych pacjenta, o których mowa w ust. 2, na etykiecie i na zleceniu na badanie grupy krwi należy wpisać symbol "NN", płeć, numer księgi głównej lub niepowtarzalny numer identyfikacyjny pacjenta, o którym mowa w przepisach wydanych na podstawie art. 36 ust. 6 ustawy z dnia 15 kwietnia 2011 r. o działalności leczniczej (Dz. U. z 2020 r. poz. 295, 567, 1493, 2112, 2345 i 2401).
4. Po pobraniu próbki krwi i opisaniu probówki osoba pobierająca sprawdza, czy dane pacjenta na etykiecie probówki z próbką krwi pacjenta są zgodne z danymi na zleceniu na badanie grupy krwi lub na zleceniu na wykonanie próby zgodności, i składa na tych zleceniach czytelny podpis oraz wpisuje datę i godzinę pobrania.
5. Pobrana próbka krwi jest niezwłocznie dostarczana do pracowni immunologii transfuzjologicznej wraz ze zleceniem na badanie grupy krwi lub zleceniem na wykonanie próby zgodności oraz zleceniem badania kwalifikacyjnego do podania immunoglobuliny anty-RhD w przypadku kobiet RhD ujemnych.
6. W przypadku korzystania z systemu teleinformatycznego jest drukowana etykieta z danymi, o których mowa w ust. 2, a zlecenie, o którym mowa w ust. 4, jest przekazywane w postaci elektronicznej, z zastosowaniem podpisu elektronicznego, w sposób określony w przepisach wydanych na podstawie art. 30 ust. 1 ustawy z dnia 6 listopada 2008 r. o prawach pacjenta i Rzeczniku Praw Pacjenta.
§ 11. 1. Kontrola zgodności grupy krwi biorcy krwi z każdą jednostką krwi lub jej składnika przeznaczoną do przetoczenia jest przeprowadzana w obecności pacjenta i polega na:
1) identyfikacji pacjenta oraz porównaniu jego imienia i nazwiska, numeru PESEL lub daty urodzenia z danymi zawartymi w wyniku próby zgodności, którego wzór jest określony w załączniku nr 9 do rozporządzenia;
2) identyfikacji pacjenta opisanego symbolem NN, symbolem płci oraz porównanie przypisanego numeru księgi głównej lub niepowtarzalnego numeru identyfikacyjnego pacjenta z danymi zawartymi w wyniku grupy krwi lub wyniku próby zgodności;
3) porównaniu wyniku badania grupy krwi pacjenta z grupą krwi na etykiecie pojemnika oraz, w przypadku przetaczania KKCz, KPK i KG, dodatkowo z grupą krwi zawartą w wyniku próby zgodności;
4) porównaniu numeru donacji krwi lub jej składnika z numerem donacji zawartym w wyniku próby zgodności, jeżeli jest wymagany;
5) sprawdzeniu, czy jednostka krwi lub jej składnika została przygotowana zgodnie ze specjalnymi zaleceniami wpisanymi w karcie zleceń lekarskich;
6) sprawdzeniu daty ważności krwi lub jej składnika;
7) sprawdzeniu daty ważności próby zgodności zawartej w wyniku próby zgodności;
8) porównaniu wyniku grupy krwi pacjenta z grupą krwi na etykiecie składnika, w przypadku przetaczania KKP, osocza lub krioprecypitatu.
2.11) Lekarz i uprawniona do tego pielęgniarka lub położna, którzy dokonali oceny zgodności krwi lub jej składnika z grupą krwi biorcy krwi, składają swój podpis na wyniku próby zgodności wraz z datą i godziną dokonania oceny albo na innym dokumencie wydanym przez bank krwi jednoznacznie wskazującym, dla kogo dany składnik krwi jest przeznaczony. Dokonują ponadto oceny wizualnej krwi lub jej składników.
3.11) W przypadku przetaczania składnika krwi niewymagającego przed podaniem wykonania próby zgodności: osocza, KKP oraz krioprecypitatu, lekarz i uprawniona do tego pielęgniarka albo położna składają swój podpis na druku wydania, który jest wydawany ze składnikiem krwi, z datą i godziną rozpoczęcia przetoczenia.
4.11) Datę i godzinę rozpoczęcia przetoczenia zawartości każdego pojemnika należy ponadto wpisać w książce transfuzyjnej, w wyniku próby zgodności oraz w karcie znieczulenia ogólnego, jeżeli obowiązuje, a na oddziale anestezjologii i intensywnej terapii - w karcie obserwacji pacjenta, a także po dokonanej ocenie zgodności z wynikiem grupy krwi pacjenta.
4a.12) Przed rozpoczęciem przetoczenia lekarz lub uprawniona do tego pielęgniarka lub położna dokonują oceny wizualnej krwi lub jej składników.
5.13) W przypadku rozbieżności wykrytych podczas kontroli zgodności krwi lub jej składnika, w szczególności z danymi biorcy krwi, nie wolno przetaczać tej jednostki krwi lub tego składnika.
6.13) W przypadku, o którym mowa w ust. 5, krew lub jej składnik zwraca się do banku krwi wraz z protokołem zawierającym informację o przyczynie zwrotu i wynikiem próby zgodności, jeżeli jest wymagana. O możliwości ponownego wydania krwi lub jej składnika decyduje kierownik banku krwi lub osoba przez niego upoważniona.
7. W przypadku, o którym mowa w ust. 5, sporządza się raport o niepożądanym zdarzeniu.
8. Wynik próby zgodności, jeżeli jest wymagany, oraz wynik grupy krwi muszą być dostępne podczas przetoczenia.
§ 12. 1. Przetoczenie KKP, rozmrożonego osocza oraz rozmrożonego krioprecypitatu należy rozpocząć niezwłocznie po ich wydaniu z banku krwi.
1a.14) Jeżeli bank krwi jest zlokalizowany poza podmiotem leczniczym, to przetoczenie KKP, rozmrożonego osocza oraz rozmrożonego krioprecypitatu należy rozpocząć niezwłocznie po ich otrzymaniu, pod warunkiem że składniki te były transportowane w warunkach optymalnej dla nich temperatury, monitorowanej w czasie transportu.
2. Przetoczenie KKCz, KPK i KG należy rozpocząć nie później niż w okresie 30 minut od ich wydania z banku krwi.
2a.15) Jeżeli bank krwi jest zlokalizowany poza podmiotem leczniczym, przetoczenie KKCz, KPK i KG należy rozpocząć nie później niż w okresie 30 minut od ich otrzymania, pod warunkiem że składniki te były transportowane w warunkach optymalnej dla nich temperatury, monitorowanej w czasie transportu.
3. Pojedyncze jednostki krwi lub jej składników należy sukcesywnie pobierać z banku krwi.
4.16) W wyjątkowych przypadkach można wydać jednorazowo więcej niż jedną jednostkę krwi lub jej składników, pod warunkiem że będą one przechowywane w oddziale w warunkach wymaganych dla krwi lub danego składnika krwi. Proces przechowywania musi być poddawany systematycznej walidacji oraz kontroli bieżącej.
5. Jeżeli przewiduje się, że czas do rozpoczęcia przetoczenia KKCz lub KPK będzie dłuższy niż 30 minut od wydania z banku krwi, należy je przechowywać w chłodziarce przeznaczonej wyłącznie do tego celu, w której proces przechowywania został poddany walidacji, w temperaturze od 2°C do 6°C, przy czym temperaturę w chłodziarce należy sprawdzać i zapisywać co najmniej 3 razy w ciągu doby (co 8 godzin).
6. Planowane przetoczenia powinny odbywać się w okresie pełnej obsady lekarzy i pielęgniarek lub położnych jednostki lub komórki organizacyjnej zakładu leczniczego.
7.17) Jednostkę krwi lub składniki krwi przetacza się za pomocą jednorazowych sterylnych zestawów.
8.17) Nie można przetaczać przez zestaw uprzednio użyty do przetaczania KPK lub KKCz jakiejkolwiek jednostki krwi lub jej składników oraz płynów infuzyjnych.
9.17) Do przetoczeń niemowlętom służą specjalne zestawy. Jeżeli krew lub jej składnik są podawane strzykawką, należy zastosować specjalny filtr.
10. Używane pompy muszą posiadać oznakowanie CE i instrukcję wytwórcy, jak należy je stosować.
11. Ogrzewanie KKCz lub KPK można przeprowadzać wyłącznie w specjalistycznym urządzeniu zaopatrzonym w termometr i system alarmowy. Zaleca się ich ogrzewanie, do temperatury nie wyższej niż 37°C, w przypadku:
1) dorosłych - jeżeli szybkość przetoczenia przekracza 50 ml/min;
2) dzieci - jeżeli szybkość przetoczenia przekracza 15 ml/min;
3) noworodków - w przetoczeniu wymiennym;
4) biorców z klinicznie znaczącymi przeciwciałami typu zimnego.
12. Nie można dodawać produktów leczniczych do przetaczanej krwi lub jej składników.
13. Nie można przetaczać jednej jednostki krwi pełnej lub KKCz dłużej niż 4 godziny, a jednej jednostki KKP, osocza albo krioprecypitatu - dłużej niż 30 minut.
14.18) Nie można po odłączeniu ponownie podłączać biorcy krwi tego samego zestawu lub tego samego pojemnika z krwią lub jej składnikiem.
15. Przez jeden zestaw można przetaczać, podczas jednego zabiegu, jedno opakowanie krwi lub jej składnika. Zestaw należy zmienić również w przypadku, gdy po zakończonym przetoczeniu podaje się płyny infuzyjne. W przypadkach wymagających szybkiego przetaczania kilku albo kilkunastu jednostek KKCz, KKP, KPK oraz osocza (masywna transfuzja), dopuszcza się przetaczanie z użyciem jednego zestawu do przetaczania, pod warunkiem, że przetoczenie będzie przeprowadzone przy użyciu specjalistycznego sprzętu.
16. Dopuszcza się przetaczanie podczas jednego zabiegu przetoczenia kilku jednostek krioprecypitatu przez jeden zestaw do przetaczania.
17. Krew lub jej składniki niewykorzystane w całości nie mogą być przetoczone innemu pacjentowi.
18.19) Pojemniki z pozostałością krwi lub jej składnika po przetoczeniu wraz z zestawami do przetoczenia, opisane datą i godziną zakończenia przetoczenia, należy przechowywać w temperaturze od 2°C do 6°C przez 72 godziny w specjalnie do tego celu przeznaczonej chłodziarce, a następnie zutylizować.
19. Pojemniki, o których mowa w ust. 18, muszą być odpowiednio zabezpieczone przed rozlaniem i wtórnym zakażeniem, chłodziarki przeznaczone do ich przechowywania muszą podlegać wstępnej i okresowej kwalifikacji, a proces przechowywania - systematycznej walidacji. Pomiar temperatury w chłodziarce powinien być przeprowadzany co najmniej 3 razy w ciągu doby (co 8 godzin) i dokumentowany.
§ 13. 1. Lekarz odpowiedzialny za przetoczenie jest obecny w chwili rozpoczęcia przetoczenia zawartości każdego pojemnika z krwią lub jej składnikami.
2.20) Osoba wykonująca przetoczenie jest obowiązana do obserwacji pacjenta bezpośrednio przed przetoczeniem, po 15 minutach od rozpoczęcia przetoczenia każdej jednostki krwi lub jej składnika, a po zakończeniu przetoczenia zmierzyć i zarejestrować ciepłotę ciała, tętno i ciśnienie tętnicze krwi pacjenta.
3.20) Lekarz odpowiedzialny za przetoczenie lub wyznaczona przez niego pielęgniarka lub położna oraz lekarz przejmujący opiekę nad pacjentem są odpowiedzialni za obserwację pacjenta podczas przetoczenia oraz przez 24 godziny od zakończenia przetoczenia. Lekarz może podjąć decyzję o krótszej obserwacji pacjenta, jednak nie może być ona krótsza niż 12 godzin.
4. Pacjentowi należy udzielić informacji o konieczności niezwłocznego zgłoszenia każdego niepokojącego objawu, w szczególności dreszczy, wysypki, zaczerwienienia skóry, duszności oraz bólu kończyn lub okolicy lędźwiowej.
5. Lekarz lub pielęgniarka zwracają szczególną uwagę na pacjentów, którzy są nieprzytomni. Pogorszenie stanu ogólnego pacjenta, w szczególności w okresie od 15 do 20 minut od rozpoczęcia przetaczania każdej jednostki krwi lub jej składnika, może być objawem niepożądanej reakcji, o której świadczą: obniżenie ciśnienia tętniczego, nieuzasadnione krwawienie, które może być następstwem rozsianego wykrzepiania wewnątrznaczyniowego, oraz hemoglobinuria lub oliguria, które mogą być pierwszym objawem ostrej hemolitycznej reakcji poprzetoczeniowej.
§ 14. 1. Do wczesnych niepożądanych reakcji, których objawy występują w okresie 24 godzin od przetoczenia, zalicza się w szczególności:21)
1) reakcję hemolityczną;
2) zakażenie bakteryjne;
3) reakcję alergiczną lub anafilaktyczną;
4) ostre poprzetoczeniowe uszkodzenie płuc, zwane dalej "TRALI";
5) duszność poprzetoczeniową;
6) niehemolityczną reakcję gorączkową;
7) poprzetoczeniowe przeciążenie krążenia (TACO).
2. Do opóźnionych niepożądanych reakcji zalicza się w szczególności:
1) reakcję hemolityczną;
2) poprzetoczeniową skazę małopłytkową;
3) poprzetoczeniową chorobę przeszczep przeciw biorcy (TA-GvHD);
4) przeniesienie biologicznych czynników chorobotwórczych.
3.22) W przypadku wystąpienia u pacjenta objawów nasuwających podejrzenie wczesnej niepożądanej reakcji, w tym poważnej niepożądanej reakcji, należy:
1) natychmiast wstrzymać przetoczenie i niezwłocznie powiadomić lekarza;
2) zmierzyć pacjentowi ciepłotę ciała, tętno i ciśnienie tętnicze krwi;
3) dalsze postępowanie uzależniać od nasilenia i rodzaju objawów.
4.22) W przypadku gdy potwierdzi się podejrzenie, że objawy wskazują na wystąpienie poważnej niepożądanej reakcji, należy niezwłocznie:
1) odłączyć pojemnik z krwią lub jej składnikiem wraz z zestawem do przetoczenia, utrzymać jednocześnie wkłucie do żyły, i powoli przetaczać biorcy - przez nowy sterylny zestaw - 0,9% roztwór chlorku sodowego (NaCl) lub inny płyn infuzyjny, zlecony przez lekarza, do czasu wdrożenia odpowiedniego leczenia;
2) zabezpieczyć odłączony pojemnik z krwią lub jej składnikiem do ewentualnych dalszych badań;
3) sprawdzić:
a) dane na wszystkich pojemnikach z przetaczaną krwią lub jej składnikami,
b) wynik próby zgodności, jeżeli dotyczy, i wynik grupy krwi pacjenta,
c) dane identyfikacyjne pacjenta, o których mowa w § 11 ust. 1 pkt 1 i 2,
d) dane na druku wydania KKP, osocza lub krioprecypitatu przez bank krwi, wskazujące, dla jakiego biorcy był wydany składnik krwi, jeżeli dotyczy;
4) pobrać próbki krwi od pacjenta z innego miejsca wkłucia niż miejsce, w którym dokonywano przetoczenia, w celu wykonania badań:
a) immunohematologicznych w zakresie ustalonym z pracownią badań konsultacyjnych centrum, a w przypadku podejrzenia TRALI - w zakresie ustalonym przez jednostkę organizacyjną publicznej służby krwi, o której mowa w art. 4 ust. 3 pkt 1 ustawy,
b) bakteriologicznych (na posiew) - objętość próbki krwi i rodzaj pojemnika z podłożem bakteriologicznym określa pracownia mikrobiologiczna wykonująca badania dla podmiotu leczniczego;
5) powiadomić pracownię immunologii transfuzjologicznej, która wykonywała badania przed przetoczeniem - jeżeli były wykonywane; pracownia przeprowadza kontrolę dokumentacji badań i przekazuje właściwemu centrum wyniki badań, wraz z próbkami krwi biorcy sprzed przetoczenia i próbkami krwinek dawców, dobranych do przetoczenia;
6) powiadomić właściwe centrum, pod którego nadzór specjalistyczny podlega dany podmiot leczniczy; jeżeli krew lub jej składnik były dostarczone przez inne centrum niż właściwe, właściwe centrum dla podmiotu leczniczego powiadamia centrum, z którego otrzymano krew lub jej składniki, o wystąpieniu poważnej niepożądanej reakcji lub poważnego niepożądanego zdarzenia;
7) przesłać do działu lub pracowni immunologii transfuzjologicznej właściwego centrum:
a) wszystkie próbki krwi pacjenta oraz krwi dobieranej do przetoczenia znajdujące się w pracowni immunologii transfuzjologicznej,
b) próbki krwi pacjenta pobrane do badań immunohematologicznych po przetoczeniu,
c) w przypadku podejrzenia TRALI - wraz ze zgłoszeniem niepożądanej reakcji lub zdarzenia, którego wzór jest określony w załączniku nr 10 do rozporządzenia, dział lub pracownia immunologii transfuzjologicznej właściwego centrum przesyła próbki krwi do diagnostyki w jednostce organizacyjnej publicznej służby krwi, o której mowa w art. 4 ust. 3 pkt 1 ustawy, oraz wyniki dodatkowych badań biorcy wykonanych w podmiocie leczniczym: badania radiologicznego klatki piersiowej, badania peptyd natriuretyczny: BNP lub NT-pro BNP oraz badania CRP (białko C-reaktywne);
8) przesłać w celu wykonania badań mikrobiologicznych:
a) pobrane po przetoczeniu próbki krwi pacjenta,
b) wszystkie pojemniki z resztkami przetaczanej krwi lub jej składników - pracownia mikrobiologiczna po pobraniu z pojemników próbek do badań przesyła je do działu lub pracowni immunologii transfuzjologicznej właściwego centrum;
9) przesłać do właściwego centrum zgłoszenie niepożądanej reakcji wypełnione przez lekarza odpowiedzialnego za przetoczenie; o wynikach analizy niepożądanej reakcji należy poinformować zgłaszający podmiot leczniczy.
5. W przypadku gdy niepożądana reakcja wystąpi po zakończonym przetoczeniu, należy powiadomić lekarza odpowiedzialnego za przetoczenie i postępować zgodnie z przepisami ust. 4 pkt 4-8.
6. W przypadkach wystąpienia poważnych niepożądanych zdarzeń i poważnych niepożądanych reakcji, kierownik właściwego centrum lub upoważniony przez niego lekarz przeprowadza w podmiocie leczniczym kontrolę postępowania przed przetoczeniem i podczas jego przeprowadzania oraz udziela wskazówek dotyczących postępowania po ich wystąpieniu.
Rozdział 3
Organizacja banku krwi w podmiocie leczniczym
§ 15. 1. Kierownik podmiotu leczniczego, w razie potrzeby, tworzy bank krwi i zapewnia jego funkcjonowanie.
2. Kierownikiem banku krwi jest lekarz odpowiedzialny za gospodarkę krwią lub kierownik pracowni immunologii transfuzjologicznej.
§ 16. 1. Specjalistyczny nadzór, o którym mowa w art. 27 ust. 1 pkt 12 ustawy, nad działalnością banku krwi sprawuje właściwe centrum; w ramach sprawowanego nadzoru właściwe centrum przeprowadza kontrolę, o której mowa w art. 29 ust. 1 ustawy, banku krwi co najmniej raz na dwa lata.
2. Do zadań banku krwi należy w szczególności:
1) składanie zamówień na krew i jej składniki we właściwym centrum, zgodnie z zamówieniami jednostek lub komórek organizacyjnych zakładu leczniczego;
2) odbiór krwi i jej składników;
3) przechowywanie krwi i jej składników do czasu ich wydania do jednostki lub komórki organizacyjnej zakładu leczniczego;
4) wydawanie krwi i jej składników do jednostek lub komórek organizacyjnych zakładu leczniczego;
5) prowadzenie dokumentacji dotyczącej przychodów i rozchodów krwi i jej składników;
6) sporządzanie sprawozdań dotyczących zużycia krwi i jej składników i przekazywanie ich do właściwego centrum.
3. Pracownicy banku krwi gromadzą i przekazują okresowo (co 3 miesiące) do właściwego centrum dane dotyczące niepożądanych reakcji poprzetoczeniowych i niepożądanych zdarzeń, które nie zostały zakwalifikowane jako poważne.
4. Kierownik banku krwi sporządza SOP obowiązujące w banku krwi, które zatwierdza kierownik podmiotu leczniczego. Warunkiem wykonywania działalności przez bank krwi jest posiadanie zatwierdzonych SOP.
§ 17. 1. Zadania, o których mowa w § 16 ust. 2, wykonują osoby posiadające co najmniej średnie wykształcenie medyczne.
2. Nadzór nad czynnościami osób, o których mowa w ust. 1, sprawuje kierownik banku krwi.
§ 18. 1. Bank krwi przechowuje wszystkie zbiorcze i indywidualne zamówienia na krew i jej składniki przez 5 lat od dnia ich złożenia oraz prowadzi książkę przychodów i rozchodów, którą przechowuje przez 30 lat od dnia dokonania w niej ostatniego wpisu.
2. Książka przychodów i rozchodów zawiera w szczególności następujące informacje:
1) datę i godzinę przychodu;
2) nazwę, numer donacji, grupę krwi, ilość krwi lub jej składników, datę pobrania oraz datę ważności;
3) czytelny podpis zawierający imię i nazwisko osoby odbierającej;
4) datę i godzinę rozchodu;
5) nazwę jednostki lub komórki organizacyjnej zakładu leczniczego, do którego przekazano krew lub jej składniki;
6) imię, nazwisko, numer PESEL lub datę urodzenia pacjenta - w przypadku braku numeru PESEL; w przypadku braku danych pacjenta - symbol "NN", płeć oraz numer księgi głównej lub niepowtarzalny numer identyfikacyjny pacjenta, o którym mowa w przepisach wydanych na podstawie art. 36 ust. 6 ustawy z dnia 15 kwietnia 2011 r. o działalności leczniczej;
6a)23) dane o niewykorzystanej do przetoczenia krwi lub jej składnika obejmujące:
a) przyczyny zwrotu krwi lub jej składnika, o których mowa w § 11 ust. 5 albo § 22 ust. 1, albo przyczyny utylizacji,
b) datę zwrotu albo utylizacji,
c) oznaczenie centrum albo banku krwi, do którego nastąpił zwrot;
7) czytelny podpis zawierający imię i nazwisko osoby wydającej krew lub jej składniki.
3. Wyniki kontroli temperatury w chłodziarkach, zamrażarkach i w innym sprzęcie do termostatowania, przeznaczonych do przechowywania krwi i jej składników, dokumentuje się przez sporządzenie protokołu kontroli temperatury przechowywania krwi i jej składników.
4. Protokoły kontroli temperatury przechowywania krwi i jej składników oraz protokoły kontroli temperatury transportu krwi i jej składników należy przechowywać przez okres co najmniej 5 lat od końca roku, w którym dokonano pomiarów.
5. Książka przychodów i rozchodów może być prowadzona w postaci elektronicznej w sposób określony w przepisach wydanych na podstawie art. 30 ust. 1 ustawy z dnia 6 listopada 2008 r. o prawach pacjenta i Rzeczniku Praw Pacjenta.
§ 19. 1. Krew i jej składniki zamawia się we właściwym centrum.
2. Składając wstępne zamówienie telefoniczne, należy uzgodnić z właściwym centrum termin i sposób dostarczenia krwi lub jej składników do banku krwi albo ich odbioru.
3. Uzupełniając zapas krwi i jej składników, bank krwi jest obowiązany sporządzić pisemne zamówienie zbiorcze na krew i jej składniki, którego wzór jest określony w załączniku nr 11 do rozporządzenia, i uzyskać jego akceptację przez kierownika podmiotu leczniczego lub osobę przez niego upoważnioną oraz głównego księgowego. Akceptacja taka może mieć formę stałej akceptacji rocznej.
4. Zamówienia indywidualne oraz zamówienia zbiorcze na krew i jej składniki należy dostarczyć do właściwego centrum przed wydaniem odbiorcy krwi lub jej składników.
5. W przypadkach pilnego przetoczenia krew i jej składniki można wydawać na podstawie zamówienia telefonicznego, zamówienia przesłanego faksem lub zamówienia przesłanego pocztą elektroniczną, z zachowaniem bezpieczeństwa danych. Zamówienie to musi być niezwłocznie uzupełnione formalnym złożeniem zamówienia na krew i jej składniki, najpóźniej w terminie 24 godzin od odbioru krwi lub jej składników.
6. Zamówienia indywidualne oraz zamówienia zbiorcze na krew i jej składniki sporządza się w dwóch egzemplarzach. Oryginał zamówienia przesyła się do właściwego centrum, a kopię przechowuje się w banku krwi przez okresy określone w § 18 ust. 1.
7. Zamówienie zbiorcze i zamówienie indywidualne mogą być prowadzone w postaci elektronicznej w sposób określony w przepisach wydanych na podstawie art. 30 ust. 1 ustawy z dnia 6 listopada 2008 r. o prawach pacjenta i Rzeczniku Praw Pacjenta.
§ 20. Krew i jej składniki są przewożone w warunkach poddawanych systematycznej walidacji i bieżącej kontroli, za które jest odpowiedzialna jednostka zajmująca się transportem. Każdorazowo sporządza się protokół kontroli temperatury transportu według wymagań określonych w obwieszczeniu wydanym na podstawie art. 24 pkt 2 lit. b ustawy.
§ 21. 1. Odbierając pojemniki z krwią lub jej składnikami, pracownik banku krwi sprawdza wszystkie pojemniki pod względem:24)
1) zgodności etykiet z zamówieniem na krew i jej składniki;
2) daty ważności;
3) szczelności pojemników;
4) oceny wizualnej krwi lub jej składników.
2. Przyjęcie pojemników z krwią lub jej składnikami potwierdza się przez umieszczenie daty oraz czytelnego podpisu kierownika banku krwi lub osoby upoważnionej do odbioru na kopii kwitu rozchodowego centrum.
3.25) Przed wydaniem krwi lub jej składników do jednostek lub komórek organizacyjnych zakładu leczniczego należy dokładnie sprawdzić zgodność danych na etykiecie pojemnika z zamówieniem na krew i jej składniki, w szczególności porównać numer donacji składnika z numerem na wyniku próby zgodności, jeżeli obowiązuje jej wykonanie. W przypadku KKP, osocza oraz krioprecypitatu pracownik przed wydaniem tych składników krwi sprawdza grupę krwi pacjenta w dokumentacji pracowni immunologii transfuzjologicznej, a jeżeli w pracowni brak jest wyniku, pracownik zwraca się do lekarza o przekazanie kopii wyniku z dokumentacji pacjenta. W sytuacjach nagłych, gdy lekarz zleca wydanie krwi lub jej składników do pilnego przetoczenia dla pacjenta, który nie ma oznaczonej grupy krwi, pracownik sprawdza, czy została wydana krew lub jej składniki o odpowiedniej grupie.
4. Krew i jej składniki powinny być wydawane do jednostek lub komórek organizacyjnych zakładu leczniczego bezpośrednio przed planowanym przetoczeniem po wykonaniu próby zgodności, jeżeli obowiązuje jej wykonanie, i innych wymaganych badań immunohematologicznych.
5.26) Przy wydawaniu krwi lub jej składników należy dokonać ich oceny wizualnej.
6.26) Wydanie krwi lub jej składników z banku krwi następuje na podstawie kwitu zawierającego następujące informacje: datę i godzinę wydania, nazwę oddziału, dane pacjenta (imię i nazwisko oraz PESEL albo w przypadku braku danych pacjenta symbol NN, płeć, numer księgi głównej lub niepowtarzalny numer identyfikacyjny pacjenta), dane składnika krwi (nazwę, numer donacji, grupę krwi, objętość, ilość jednostek), datę i podpis wydającego, datę i godzinę odbioru oraz podpis odbierającego.
§ 22. 1. Krew i jej składniki wydane do jednostek lub komórek organizacyjnych zakładu leczniczego nie podlegają zwrotowi do banku krwi albo do centrum, z wyjątkiem:
1) zgonu pacjenta, dla którego zamawiano krew lub jej składniki;
2) przypadku rzadko występującego fenotypu krwinek czerwonych;
3) innego uzasadnionego przypadku - po wyrażeniu zgody przez kierownika właściwego centrum;
4) uwzględnienia zgłoszonej reklamacji krwi lub jej składników.
2. Krew lub jej składniki można zwrócić w przypadku, o którym mowa w ust. 1, pod warunkiem że:
1) dana jednostka krwi lub jej składniki były przechowywane i transportowane we właściwy sposób przy zachowaniu odpowiedniej i prawidłowo kontrolowanej temperatury oraz przy użyciu sprzętu chłodniczego, w którym proces przechowywania został poddany walidacji;
2) w podmiocie leczniczym, z którego krew lub jej składniki są przyjmowane, właściwe centrum przeprowadziło wcześniej kontrolę potwierdzoną protokołem stwierdzającym brak uchybień w stosunku do obowiązujących przepisów dotyczących przechowywania krwi i jej składników.
3. Zwrot krwi lub jej składników może być przyjęty wyłącznie przez właściwe centrum na podstawie prawidłowo wypełnionego protokołu:
1) niewykorzystania krwi lub jej składników;
2) kontroli temperatury przechowywania krwi i jej składników;
3) kontroli temperatury transportu krwi i jej składników, który sporządza się w przypadku, gdy krew i jej składniki nie były przewożone środkami transportu kontrolowanymi przez centrum.
4. Protokoły, o których mowa w ust. 3, są sporządzane według wymagań określonych w obwieszczeniu wydanym na podstawie art. 24 pkt 2 lit. b ustawy.
§ 23. 1. W przypadku gdy, odbierając krew lub jej składniki, podmiot leczniczy stwierdzi nieprawidłowości w zakresie określonym w § 21 ust. 1, szpitalny bank krwi lub komórka organizacyjna zakładu leczniczego może złożyć do właściwego centrum reklamację.
2. W przypadku reklamacji należy przekazać do właściwego centrum bezpośrednio lub poprzez bank krwi reklamowaną krew lub jej składniki wraz z protokołem reklamacji, do którego załącza się:
1) protokół kontroli temperatury przechowywania krwi lub jej składników, jeżeli dotyczy;
2) protokół kontroli temperatury transportu krwi i jej składników (który sporządza się w przypadku, gdy krew i jej składniki nie były przewożone środkami transportu kontrolowanymi przez centrum).
3. Protokoły, o których mowa w ust. 2, muszą zawierać co najmniej dane opisane w obwieszczeniu wydanym na podstawie art. 24 pkt 2 lit. b ustawy.
4. Reklamacja może być rozpatrzona, pod warunkiem że:
1) reklamowana jednostka krwi lub jej składniki były przechowywane i transportowane we właściwy sposób przy zachowaniu odpowiedniej i prawidłowo kontrolowanej temperatury oraz przy użyciu sprzętu chłodniczego, w którym proces przechowywania został poddany walidacji;
2) w podmiocie leczniczym, od którego krew lub jej składniki są przyjmowane, właściwe centrum przeprowadziło wcześniej kontrolę, w wyniku której stwierdzono brak uchybień w stosunku do obowiązujących przepisów dotyczących przechowywania krwi i jej składników.
5. W przypadku uwzględnienia reklamacji dział ekspedycji właściwego centrum:
1)27) wydaje nieodpłatnie w miejsce zwróconej krwi lub jej składników inną, równoważną mu jednostkę krwi lub jej składników albo
2)27) nie nalicza opłaty za zwróconą krew lub jej składniki.
Rozdział 4
Organizacja pracowni immunologii transfuzjologicznej w podmiocie leczniczym
§ 24. Podmiot leczniczy zapewnia pracowni immunologii transfuzjologicznej:
1) odpowiednie pomieszczenie do wykonywania badań, w którym temperatura powinna wynosić 18-25°C;
2) odpowiedni sprzęt, aparaturę, odczynniki diagnostyczne, krwinki wzorcowe oraz odpowiednie formularze zleceń i wyników badań immunohematologicznych.
§ 25. 1. Kierownikiem pracowni immunologii transfuzjologicznej może być diagnosta laboratoryjny - specjalista w dziedzinie laboratoryjnej transfuzjologii medycznej lub lekarz specjalista w dziedzinie transfuzjologii klinicznej.
1a.28) Kierownik podmiotu leczniczego jest obowiązany powołać kierownika pracowni immunologii transfuzjologicznej.
2. Kierownik pracowni immunologii transfuzjologicznej musi posiadać zaświadczenie upoważniające do samodzielnego wykonywania badań immunohematologicznych i autoryzowania ich wyników wydane przez kierownika jednostki organizacyjnej publicznej służby krwi, o której mowa w art. 4 ust. 3 ustawy, oraz co najmniej dwuletnią praktykę w wykonywaniu badań immunohematologicznych.
3. Kierownik organizuje pracę pracowni w sposób zapewniający gotowość do wykonywania badań immunohematologicznych przez całą dobę, gwarantując bezpieczeństwo biorców krwi, w tym noworodków zagrożonych chorobą hemolityczną wynikającą z konfliktu serologicznego.
4. Kierownik pracowni immunologii transfuzjologicznej sporządza SOP obowiązujące w pracowni, które zatwierdza kierownik podmiotu leczniczego.
§ 26. 1. Pracownik, który nie posiada uprawnień do samodzielnego wykonywania badań immunohematologicznych, przez pierwszy rok pracy wykonuje je pod nadzorem kierownika pracowni immunologii transfuzjologicznej lub osoby przez niego wyznaczonej.
2. Pracownik, o którym mowa w ust. 1, po co najmniej rocznej praktyce w wykonywaniu badań pod nadzorem osób wskazanych w ust. 1, odbywa dwutygodniowe szkolenie teoretyczne i praktyczne w jednostkach organizacyjnych publicznej służby krwi, o których mowa w art. 4 ust. 3 ustawy.
3. Po zdaniu egzaminu praktycznego i teoretycznego technik analityki medycznej otrzymuje zaświadczenie upoważniające do samodzielnego wykonywania badań immunohematologicznych, a lekarz lub diagnosta laboratoryjny otrzymuje zaświadczenie upoważniające do samodzielnego wykonywania badań immunohematologicznych i autoryzacji wyników.
4. Zaświadczenia są wydawane przez kierownika jednostki przeprowadzającej szkolenia. Wzór zaświadczenia upoważniającego do samodzielnego wykonywania badań immunohematologicznych oraz autoryzacji wyników dla lekarza i diagnosty laboratoryjnego oraz zaświadczenia upoważniającego do samodzielnego wykonywania badań immunohematologicznych dla technika analityki medycznej określa załącznik nr 12 do rozporządzenia.
5. Roczna praktyka w wykonywaniu badań pod nadzorem odbywa się w pełnym wymiarze czasu pracy lub niepełnym wymiarze czasu pracy odpowiadającym rocznemu pełnemu wymiarowi czasu pracy w okresie nie dłuższym niż trzy lata.
6. W przypadku przerwy w wykonywaniu pracy w pracowni immunologii transfuzjologicznej dłuższej niż 2 lata personel zatrudniony w pracowni immunologii transfuzjologicznej musi odbyć dodatkowe 14-godzinne szkolenie w jednostce organizacyjnej publicznej służby krwi, o której mowa w art. 4 ust. 3 ustawy.
7. Pracownia immunologii transfuzjologicznej co najmniej raz w roku jest poddawana kontroli jakości wykonywanych badań przeprowadzanej przez właściwe centrum.
8. Wynik dokonanej oceny jest przekazywany kierownikowi podmiotu leczniczego i kierownikowi pracowni immunologii transfuzjologicznej podmiotu leczniczego. W przypadku gdy przekazana ocena jest negatywna, kierownik podmiotu leczniczego podejmuje niezwłocznie działania mające na celu zapewnienie wymaganej jakości wykonywanych badań.
9. Liczba osób posiadających uprawnienia do samodzielnego wykonywania badań i autoryzacji wyników, zatrudnionych w pracowni immunologii transfuzjologicznej, jest uzależniona od zakresu i liczby wykonywanych badań.
10. Personel wykonujący badania immunohematologiczne w pracowni immunologii transfuzjologicznej nie może być kierowany na stanowiska pracy w innych pracowniach.
11. Wszystkie wyniki badań wydawane z pracowni immunologii transfuzjologicznej muszą być autoryzowane przez diagnostę laboratoryjnego lub lekarza posiadających zaświadczenie upoważniające do wykonywania badań i autoryzacji wyników w zakresie immunologii transfuzjologicznej.
12. Przebieg czynności wykonywanych w pracowni immunologii transfuzjologicznej poza godzinami z pełną obsadą pracowników pracowni, wynikającymi z organizacji czasu pracy pracowni immunologii transfuzjologicznej, zwanych dalej "pozaregulaminowymi godzinami pracy", w tym w porze nocnej oraz w dniach ustawowo wolnych od pracy, należy odnotowywać w książce raportów. W raportach należy uwzględnić w szczególności napotkane trudności w interpretacji wyników badań, opis okoliczności związanej z wydaniem lub niewydaniem wyniku próby zgodności dla pacjenta, u którego wykryto nieregularne przeciwciała, oraz informację o zdalnej autoryzacji wyników badań, jeżeli była dokonana. Raporty podlegają codziennemu przeglądowi oraz analizie i są podpisywane przez kierownika pracowni immunologii transfuzjologicznej lub przez inną upoważnioną przez niego osobę.
13. Dopuszcza się zdalną autoryzację wyników badań wykonywaną zgodnie z warunkami, o których mowa w ust. 14-18.
14. Zdalnej autoryzacji może dokonać osoba, o której mowa w ust. 11, jeżeli jest zatrudniona lub wykonuje swoje zadania na innej podstawie niż stosunek pracy w pracowni, w której autoryzuje wyniki.
15. Osoba, o której mowa w ust. 11, może dokonywać zdalnej autoryzacji dla maksymalnie dwóch pracowni immunologii transfuzjologicznej znajdujących się na obszarze działania właściwego centrum, które wydało pozytywną opinię, o której mowa w ust. 18 pkt 6, dopuszczającą zdalną autoryzację.
16.29) Wyniki badań wydawane z pracowni immunologii transfuzjologicznej podmiotu leczniczego albo innego podmiotu wykonującego badania w zakresie immunologii transfuzjologicznej mogą być autoryzowane przez osoby, o których mowa w ust. 11, zatrudnione lub wykonujące swoje zadania na innej podstawie niż stosunek pracy w pracowni właściwego centrum.
17. Zdalna autoryzacja wyników badań jest dopuszczalna wyłącznie w pozaregulaminowych godzinach pracy, w tym w porze nocnej oraz w dniach ustawowo wolnych od pracy.
18. Zdalnej autoryzacji wyników badań można dokonać, jeżeli:
1) badanie jest wykonywane za pomocą automatycznego analizatora immunohematologicznego;
2) osobie dokonującej zdalnej autoryzacji wyników badań zapewniono:
a) dostęp do danych operacyjnych, protokołów badań zapisanych w programie komputerowym oraz do obrazów reakcji pobranych z analizatora z możliwością wprowadzenia zmian w razie takiej konieczności, historii badań pacjentów oraz wyników kontroli jakości badań przeprowadzanych codziennie,
b) interaktywną komunikację audiowizualną umożliwiającą monitorowanie przebiegu badania od przyjęcia próbki do wydania wyniku;
3) pracownia immunologii transfuzjologicznej posiada oprogramowanie analizatora, o którym mowa w pkt 1, które jest zintegrowane z programem pracowni immunologii transfuzjologicznej;
4) pracownia immunologii transfuzjologicznej posiada szyfrowany bezpieczny dostęp do bazy danych zapewniony przez bezpieczne łącze internetowe;
5) osoba dokonująca zdalnej autoryzacji wyniku badania stosuje kwalifikowany podpis elektroniczny, zaawansowany podpis elektroniczny w rozumieniu art. 3 pkt 11 rozporządzenia Parlamentu Europejskiego i Rady (UE) nr 910/2014 z dnia 23 lipca 2014 r. w sprawie identyfikacji elektronicznej i usług zaufania w odniesieniu do transakcji elektronicznych na rynku wewnętrznym oraz uchylającego dyrektywę 1999/93/WE (Dz. Urz. UE L 257 z 28.08.2014, s. 73) albo podpis potwierdzony profilem zaufanym ePUAP w rozumieniu art. 3 pkt 1530) ustawy z dnia 17 lutego 2005 r. o informatyzacji działalności podmiotów realizujących zadania publiczne (Dz. U. z 2020 r. poz. 346, 568, 695, 1517 i 2320);
6) w pracowni immunologii transfuzjologicznej przeprowadzono walidację procesów wpływających na prawidłowy przebieg autoryzacji wyników i uzyskano pozytywną opinię właściwego centrum oraz instytutu, o którym mowa w art. 4 ust. 3 pkt 1 ustawy, w tym zakresie.
§ 27. Pracownia immunologii transfuzjologicznej posiada wyposażenie niezbędne do wykonywania badań z zakresu immunologii transfuzjologicznej. Zaleca się stosowanie automatycznych analizatorów immunohematologicznych lub technik umożliwiających wykonywanie badań metodą manualną z użyciem testów mikrokolumnowych, mikropłytkowych lub innych opisanych w obwieszczeniu wydanym na podstawie art. 24 pkt 2 lit. b ustawy.
§ 28. 1. Nadzór specjalistyczny nad pracowniami immunologii transfuzjologicznej pełni właściwe centrum.
2. W ramach nadzoru właściwe centrum:
1) opiniuje liczbę niezbędnych do zatrudnienia osób w zależności od zakresu i liczby wykonywanych badań;
2) szkoli pracowników pracowni przed dopuszczeniem do samodzielnego wykonywania badań i autoryzacji wyników;
3) wydaje zaświadczenia uprawniające do samodzielnego wykonywania badań i autoryzacji wyników;
4) przeprowadza dodatkowe szkolenia dla pracowników w przypadku przerwy w wykonywaniu badań dłuższej niż 2 lata;
5) przeprowadza, co najmniej raz na dwa lata, okresowe kontrole organizacji pracy, stosowanych metod i procedur oraz wyposażenia i warunków pracy;
6) wydaje zalecenia pokontrolne oraz nadzoruje ich wykonanie w przypadku stwierdzenia nieprawidłowości;
7) zaleca wprowadzenie uzasadnionych zmian w funkcjonowaniu pracowni oraz modyfikację metod badań immunohematologicznych i dokumentacji;
8) zaleca przeprowadzenie dodatkowego szkolenia pracowników, w przypadku gdy przyczyną niepożądanego zdarzenia lub niepożądanej reakcji był błąd pracownika pracowni immunologii transfuzjologicznej;
9) w przypadku niezrealizowania przez kontrolowany podmiot, w wyznaczonym terminie, zaleceń, o których mowa w pkt 6, powiadamia wojewodę właściwego dla siedziby kontrolowanego podmiotu leczniczego.
3. Protokół z kontroli przeprowadzonej przez właściwe centrum przekazuje się kierownikowi podmiotu leczniczego i kierownikowi pracowni immunologii transfuzjologicznej.
4. Właściwe centrum przekazuje do instytutu, o którym mowa w art. 4 ust. 3 pkt 1 ustawy, corocznie, do dnia 31 marca, podsumowanie wyników kontroli przeprowadzonych w pracowniach immunologii transfuzjologicznej.
§ 29. 1. Pracownia immunologii transfuzjologicznej przyjmuje do badań tylko próbki krwi opisane zgodnie z § 10 ust. 2 wraz z dołączonym właściwym zleceniem w postaci papierowej albo elektronicznej.
2. W przypadku braku danych pacjenta do badania, można przyjąć próbki krwi i zlecenia z wpisanym symbolem "NN", płcią lub niepowtarzalnym numerem identyfikacyjnym pacjenta oraz resortowym kodem identyfikacyjnym podmiotu zlecającego badanie, o którym mowa w przepisach wydanych na podstawie art. 105 ust. 5 ustawy z dnia 15 kwietnia 2011 r. o działalności leczniczej.
3. Po otrzymaniu próbek krwi należy sprawdzić zgodność danych na etykietach probówek i zleceniach. Jeżeli dane na probówce są niezgodne z danymi na zleceniu, należy wyjaśnić przyczynę rozbieżności i w razie potrzeby zażądać ponownego pobrania próbki krwi od pacjenta. Niezgodności takie należy monitorować i dokumentować w sposób przewidziany dla niepożądanych zdarzeń lub reakcji.
4.31) Próbki krwi należy zarejestrować w książce badań grup krwi lub w książce prób zgodności, albo w systemie informatycznym, nadając im kolejne numery przy zachowaniu ciągłości numeracji w danym roku. Wzór książki badań grup krwi oraz wzór książki prób zgodności są określone odpowiednio w załącznikach nr 13 i 14 do rozporządzenia.
5. W przypadku biorców krwi leczonych krwią w przeszłości oraz kobiet, u których w wyniku przeprowadzonego wywiadu medycznego uzyskano informację o przebytych ciążach, należy zapoznać się z całą dostępną dokumentacją dotyczącą poszukiwania i identyfikacji przeciwciał, a także dokumentacją dotyczącą niepożądanych reakcji, jeżeli takie wystąpiły.
6. Próbki krwi pacjentów i dawców krwi przechowuje się w temperaturze od 2°C do 8°C przez 72 godziny.
§ 30. 1. Do podstawowego zakresu badań wykonywanych w pracowni immunologii transfuzjologicznej należy:
1)32) określanie grup krwi ABO i RhD obejmujące: oznaczenie antygenów A, B i D, oznaczanie przeciwciał regularnych anty-A i anty-B oraz przeglądowe badanie przeciwciał odpornościowych do antygenów krwinek czerwonych;
2)32) wykonywanie prób zgodności serologicznej krwi obejmujące: oznaczanie antygenów A, B i D u biorcy i u dawcy, badanie przeglądowe przeciwciał odpornościowych u biorcy oraz badanie surowicy biorcy z krwinkami dawcy (próba krzyżowa); dopuszcza się rezygnację z badania antygenu D u dawcy, jeżeli biorca jest RhD dodatni, a także rezygnację z próby krzyżowej, jeżeli badania u biorcy i dawcy są wykonywane metodami automatycznymi, a u biorcy nie wykrywa się i nie wykryto w przeszłości przeciwciał odpornościowych.
2. Do rozszerzonego zakresu badań wykonywanych w pracowni immunologii transfuzjologicznej należy:
1) badanie w kierunku konfliktu serologicznego między matką a płodem;
2) badanie kwalifikujące do podania immunoglobuliny anty-RhD w ramach profilaktyki konfliktu serologicznego RhD;
3) badanie w celu identyfikacji przeciwciał;
4) określanie antygenu K oraz innych antygenów grupowych krwi.
3.33) W przypadku konieczności pilnego przetoczenia i trudności w oznaczeniu grupy krwi ABO lub RhD oraz w przypadku braku potwierdzonego wyniku grupy krwi, o którym mowa w § 9 ust. 2, jeżeli lekarz zdecyduje o przetoczeniu, dopuszcza się do czasu otrzymania wyniku grupy krwi wydanie składników krwi:
1) KKCz grupy O przed wykonaniem próby zgodności, a w przypadku pacjentów z alloprzeciwciałami anty-D oraz dziewczynek i kobiet do okresu menopauzy O RhD ujemny K ujemny;
2) osocza lub krioprecypitatu grupy AB;
3) KKP - składnik grupy O zawieszony w osoczu grupy AB albo w odpowiednim roztworze wzbogacającym, albo KKP grupy AB.
4. Przy braku KKCz O RhD ujemnego dopuszcza się przetoczenie dziewczynkom i kobietom do okresu menopauzy KKCz grupy O RhD dodatniego.
5. W celu optymalnego wykorzystania krwi grupy O należy jak najszybciej po otrzymaniu wyniku grupy krwi przetaczać KKCz zgodne z oznaczoną grupą.
6.34) W przypadku pacjentów, u których uzyskano dodatni wynik badania przeglądowego, dokonuje się identyfikacji przeciwciał. W przypadku konieczności pilnego przetoczenia dopuszcza się przetoczenie KKCz przed otrzymaniem wyniku identyfikacji przeciwciał, opierając się na zgodności krwi w ABO i RhD oraz na ujemnym wyniku w próbie krzyżowej. Wynik należy sformułować: "Krew dawcy nr .... zgodna w próbie krzyżowej". Krew można przetoczyć w sytuacji bezpośredniego zagrożenia życia pacjenta. W uwagach należy dopisać: "W surowicy pacjenta wykryto alloprzeciwciała. Identyfikacja w toku.".
7. Jeżeli pracownia immunologii transfuzjologicznej nie ma możliwości wykonania identyfikacji przeciwciał, przesyła próbki do jednostki organizacyjnej publicznej służby krwi wraz ze zleceniem na konsultacyjne badania immunohematologiczne, którego wzór jest określony w załączniku nr 15 do rozporządzenia, i protokołem wykonanych badań.
8. Właściwe centrum wydaje wynik badania w trzech egzemplarzach, z których jeden egzemplarz jest przeznaczony dla pracowni immunologii transfuzjologicznej podmiotu leczniczego w celu uzupełnienia dokumentacji wyników badań, jeden egzemplarz dla pacjenta i jeden egzemplarz dla lekarza w celu umieszczenia w historii choroby.
9. (uchylony).35)
10. U biorców krwi systematycznie leczonych KKCz oraz u osób, którym przetaczano KKCz w okresie ostatnich 3 miesięcy, bezwzględnie należy przestrzegać czasu ważności próby zgodności, który - liczony od momentu pobrania próbki krwi od pacjenta - wynosi 48 godzin. Jeżeli KKCz nie został w tym czasie przetoczony, należy powtórnie wykonać próbę zgodności ze świeżo pobranej próbki krwi od pacjenta.
11.36) Próbę zgodności wykonuje się z próbki krwi biorcy krwi, pobranej wyłącznie do badań immunohematologicznych. Jako krew dawcy służy próbka zawarta w segmencie drenu połączonego z pojemnikiem z KKCz, KPK lub KG. Przed odłączeniem segmentu drenu należy porównać jego numer donacji i grupy krwi z numerem i grupą krwi na etykiecie pojemnika.
12. Wyniki próby zgodności wpisuje się na formularzu wyniku próby zgodności.
13.37) Wzór zlecenia na wykonanie badań immunohematologicznych kwalifikujących do podania immunoglobuliny anty-RhD w ramach profilaktyki konfliktu serologicznego RhD jest określony w załączniku nr 16 do rozporządzenia.
§ 31. 1. Badania wykonywane w pracowni immunologii transfuzjologicznej wpisuje się w książce badań grup krwi lub w książce prób zgodności. Dopuszcza się prowadzenie dokumentacji elektronicznej z możliwością wydruku.
2. Badanie jest zakończone sporządzeniem wyniku, który podpisuje osoba wykonująca to badanie i osoba autoryzująca wynik.
3. W pozaregulaminowych godzinach pracy, w tym w porze nocnej oraz w dniach ustawowo wolnych od pracy, może być wydany wynik badania wykonany przez osobę uprawnioną do wykonywania i autoryzowania wyników i jednocześnie przez nią podpisany jako osobę wykonującą badanie i autoryzującą wynik.
4. Dopuszcza się podpisanie wyniku w sposób określony w przepisach wydanych na podstawie art. 30 ust. 1 ustawy z dnia 6 listopada 2008 r. o prawach pacjenta i Rzeczniku Praw Pacjenta i przekazanie go drogą elektroniczną do oddziału lub kliniki.
5. Jeżeli badania wykonuje się metodą automatyczną, dopuszcza się prowadzenie dokumentacji w postaci wydruków komputerowych zamiast książek, o których mowa w ust. 1, przy czym wydruki muszą uwzględniać wszystkie dane ujęte we wzorach tych książek.
§ 32. 1. Do przetoczenia wybiera się komórkowe składniki krwi zgodne w układzie ABO i RhD z biorcą krwi, a osocze i krioprecypitat zgodne w układzie ABO.
2. Pacjentom, u których wykryto autoprzeciwciała do krwinek czerwonych reagujące w temperaturze 37°C, należy dobierać krew lub jej składniki zgodne fenotypowo w układzie Rh i antygenie K z układu Kell.
3. Dla kobiet do okresu menopauzy jest wskazane dobieranie KKCz zgodnego w układzie ABO i RhD oraz dodatkowo K ujemnego w ramach profilaktyki konfliktu serologicznego w antygenie K. Jeżeli wykonano badania antygenu K u pacjenta i stwierdzono jego obecność, można przetaczać KKCz K dodatni.
4. Biorcom krwi, u których wykryto przeciwciała odpornościowe w aktualnym badaniu lub w przeszłości, dobiera się KKCz niezawierający odpowiadającego im antygenu oraz zgodny fenotypowo w układzie Rh i antygenie K z układu Kell.
5. Dopuszcza się przetaczanie KKCz grupy O pacjentom innej grupy krwi, w przypadku:
1) braku krwi jednoimiennej w układzie ABO;
2) bardzo słabej ekspresji antygenu A lub B albo trudności w oznaczeniu grupy krwi ABO. 6. Dopuszcza się przetaczanie KKCz grupy A lub B biorcom grupy AB, w przypadku braku krwi jednoimiennej.
7. Biorcy RhD dodatniemu można przetaczać KPK, KKCz, KG i KKP RhD dodatni lub RhD ujemny.
8.38) W przypadku pilnego przetoczenia, na pisemne zamówienie na krew lub jej składniki do pilnego przetoczenia, wydane przez lekarza odpowiedzialnego za przetoczenie krwi lub składnika, wydaje się krew lub jej składniki zgodne w układzie ABO i RhD z biorcą, przed wykonaniem próby zgodności. Wydanie KKCz, zgodnego w ABO i RhD z biorcą, jest możliwe wyłącznie na podstawie potwierdzonego wyniku grupy krwi. Krew lub jej składniki do pilnego przetoczenia są wydawane razem z wypełnionym formularzem, którego wzór jest określony w załączniku nr 18 do rozporządzenia.
9. Po wydaniu KKCz do pilnego przetoczenia zgodnie z ust. 8 przystępuje się niezwłocznie do wykonania próby zgodności. Jeżeli wynik wskazuje na niezgodność, jest konieczne natychmiastowe powiadomienie o tym lekarza prowadzącego leczenie w celu przerwania przetoczenia.
10. W wyjątkowo nagłym przypadku pilnego przetoczenia, jeżeli lekarz prowadzący leczenie zdecyduje o przetoczeniu przed wykonaniem badania grupy krwi u biorcy krwi i próby zgodności, należy wydać:
1) KKCz grupy O, a kobietom w wieku rozrodczym - KKCz grupy O RhD ujemny, K ujemny;
2) osocze grupy AB;
3) krioprecypitat grupy AB;
4) KKP grupy O zawieszone w osoczu grupy AB lub w roztworze wzbogacającym; dopuszcza się także przetoczenie KKP grupy AB, jeżeli rekonstytuowany KKP jest niedostępny.
11.39) W przypadku, o którym mowa w ust. 10, należy niezwłocznie przystąpić do określenia u biorcy grupy krwi ABO i RhD, wykonania przeglądowego badania przeciwciał odpornościowych i próby krzyżowej. Do dalszych przetoczeń należy kwalifikować krew lub jej składniki zgodne z biorcą w układzie ABO i RhD.
§ 33. 1. W przypadku wykonywania badań i doboru KKCz do przetoczenia u noworodków i niemowląt do ukończenia 4 miesiąca życia należy:
1) określić grupę krwi w układzie ABO i antygen D z układu Rh u matki i u dziecka;
2) wykonać badania w kierunku obecności alloprzeciwciał odpornościowych w surowicy matki;
3) wykonać bezpośredni test antyglobulinowy, zwany dalej "BTA", u dziecka.
2.40) Jeżeli w surowicy matki nie wykrywa się alloprzeciwciał odpornościowych i BTA dziecka jest ujemny:
1) noworodkom i niemowlętom do ukończenia 4 miesiąca życia urodzonym przez matkę o tej samej grupie krwi ABO co dziecko przetacza się KKCz zgodne w układzie ABO i RhD dziecka, bez wykonywania próby krzyżowej, po sprawdzeniu zgodności oznaczenia antygenów A, B i D w składniku krwi zawierającym krwinki czerwone, przeznaczonym do przetoczenia; można również przetoczyć KKCz grupy O;
2) noworodkom i niemowlętom do ukończenia 4 miesiąca życia urodzonym przez matkę o innej grupie krwi ABO niż dziecko przetacza się KKCz grupy O i RhD zgodnym z RhD dziecka, bez wykonywania próby krzyżowej, po sprawdzeniu zgodności oznaczenia antygenów A, B i D w składniku krwi, zawierającym krwinki czerwone, przeznaczonym do przetoczenia;
3) w przypadku gdy matka ma grupę krwi AB, dziecku można przetoczyć KKCz grupy krwi dziecka lub KKCz grupy O z RhD zgodnym z RhD dziecka, bez wykonywania próby krzyżowej, po sprawdzeniu zgodności oznaczenia antygenów A, B i D w składniku krwi, zawierającym krwinki czerwone, przeznaczonym do przetoczenia.
2a.41) W przypadkach, o których mowa w ust. 2, do przetoczenia jest wydawane KKCz razem z wypełnionym formularzem, którego wzór jest określony w załączniku nr 19 do rozporządzenia.
3. Jeżeli w surowicy matki wykrywa się alloprzeciwciała odpornościowe spoza układu ABO:
1) noworodkom i niemowlętom do ukończenia 4 miesiąca życia urodzonym przez matki tej samej grupy krwi ABO dobiera się KKCz zgodne w grupie ABO oraz bez antygenu, do którego są skierowane alloprzeciwciała; przed każdym przetoczeniem należy wykonywać próbę krzyżową z surowicą matki;
2) noworodkom i niemowlętom do ukończenia 4 miesiąca urodzonym przez matki innej grupy krwi ABO dobiera się KKCz grupy O bez antygenu, do którego są skierowane alloprzeciwciała; przed każdym przetoczeniem należy wykonywać próbę krzyżową z surowicą matki.
3a.42) Sposób postępowania określony w ust. 2, 2a i 3 dotyczy wszystkich składników krwi zawierających krwinki czerwone.
4. Jeżeli krew matki jest niedostępna, należy sprawdzić obecność odpornościowych przeciwciał w surowicy dziecka oraz BTA na krwinkach dziecka, a w przypadku gdy:
1) nie wykrywa się przeciwciał odpornościowych i BTA jest ujemny - należy przetaczać KKCz grupy O, RhD zgodne z dzieckiem i wykonać próbę krzyżową z surowicą dziecka;
2) BTA jest dodatni i w surowicy dziecka wykryto alloprzeciwciała odpornościowe - należy ustalić ich swoistość i do przetoczenia należy dobierać krwinki grupy O ujemne w antygenie, do którego jest skierowana swoistość przeciwciał; należy zawsze wykonać próbę krzyżową z surowicą dziecka; można użyć eluatu z jego krwinek.
5. Ujemny wynik badania przeglądowego na obecność przeciwciał i ujemny wynik w próbie krzyżowej upoważniają do odstąpienia od wykonywania tych badań przed następnymi przetoczeniami.
6. Dodatni wynik badania przeglądowego na obecność przeciwciał nakazuje wykonywanie próby krzyżowej z surowicą lub osoczem dziecka.
§ 34. Dobieranie KKCz do przetaczania dopłodowego odbywa się w następujący sposób:
1) należy dobierać krwinki czerwone grupy O niezawierające antygenów, do których są skierowane przeciwciała wykryte u matki;
2) w celu uniknięcia uodpornienia ciężarnej antygenami zawartymi w KKCz użytym do przetoczenia dopłodowego należy oznaczyć u niej antygeny z układów grupowych Rh (D, C, Cw, c, E, e), Kell (K i k), Kidd (Jka i Jkb), Duffy (Fya i Fyb) i MNS (S i s) oraz dobierać do przetoczenia krwinki czerwone dawców zgodne z krwią matki;
3) jeżeli grupa krwi ABO płodu jest zgodna z grupą krwi matki oraz gdy matka ma grupę AB, a płód ma grupę A lub B, można dobierać krwinki jednoimienne w układzie ABO z dzieckiem.
§ 35. 1. Dobieranie krwi do przetoczenia wymiennego odbywa się w następujący sposób:
1) w konflikcie RhD należy dobierać krwinki czerwone RhD ujemne, przy czym:
a) w przypadku gdy zachodzi zgodność serologiczna w układzie ABO między matką i dzieckiem, przetacza się krew pełną rekonstytuowaną, zwaną dalej "KPR", składającą się z KKCz i osocza od dawców o zgodnej grupie krwi w układzie ABO z dzieckiem,
b) noworodkom o grupie krwi A lub B matek innej grupy krwi w układzie ABO niż dziecko przetacza się KPR, składającą się z KKCz od dawcy grupy O, zawieszonego w osoczu od dawcy grupy zgodnej z grupą krwi dziecka lub w osoczu grupy AB,
c) noworodkom urodzonym przez matkę grupy AB przetacza się KPR składający się z KKCz i osocza grupy krwi ABO zgodnej z dzieckiem;
2) w konflikcie w układzie ABO przetacza się KPR składającą się z KKCz od dawcy grupy O i RhD zgodnym z RhD dziecka, zawieszonego w osoczu od dawcy grupy krwi ABO zgodnej z grupą krwi dziecka lub w osoczu grupy AB;
3) w konflikcie serologicznym w zakresie innych antygenów niż wymienione w pkt 1 i 2 KKCz przeznaczony do sporządzenia KPR nie może zawierać antygenu odpowiedzialnego za uodpornienie matki.
2. W okresie pierwszych 4 miesięcy życia dziecka do kolejnych przetoczeń uzupełniających stosuje się KKCz tej samej grupy ABO i RhD, jak do pierwszego przetoczenia.
§ 36.43) 1. W celu trwałego i wiarygodnego udokumentowania wyniku grupy krwi wydaje się kartę grupy krwi lub dokonuje się wpisu w legitymacji służbowej żołnierza zawodowego, grupy krwi ABO i RhD oraz ewentualnie obecnych przeciwciał odpornościowych, w oparciu o jednobrzmiące wyniki badań dwóch próbek krwi, pobranych w różnym czasie, z dwóch różnych miejsc wkłucia.
2. Wpisu wyników badań do karty grupy krwi oraz do legitymacji służbowej żołnierza zawodowego dokonuje pracownik posiadający uprawnienia do samodzielnego wykonywania badań z zakresu immunologii transfuzjologicznej i ich autoryzowania.
§ 37. (uchylony).44)
Rozdział 5
Monitorowanie i zgłaszanie niepożądanych zdarzeń i niepożądanych reakcji
§ 38. 1. Bank krwi, pracownia immunologii transfuzjologicznej i podmiot leczniczy zgłaszają do właściwego centrum wszelkie niepożądane zdarzenia związane z pobieraniem próbek, badaniem, przechowywaniem, wydaniem krwi i jej składników oraz z przetoczeniem, wpływające na ich jakość i bezpieczeństwo, oraz wszelkie niepożądane reakcje związane z przeprowadzaniem zabiegu przetoczenia.
2. Poważne niepożądane reakcje, o których mowa w § 14 ust. 1 i 2, oraz poważne niepożądane zdarzenia zgłasza się na formularzu zgłoszenia niepożądanej reakcji lub zdarzenia, o którym mowa w załączniku nr 10 do rozporządzenia.
3. Do właściwego centrum przesyła się raporty dotyczące niepożądanych reakcji i niepożądanych zdarzeń. Właściwe centrum dla podmiotu leczniczego rejestruje wszystkie niepożądane reakcje i zdarzenia na podstawie otrzymanych raportów i uwzględnia je w danych statystycznych.
4. Podmiot leczniczy rejestruje także niepożądane zdarzenia, które mogły zagrażać bezpieczeństwu pacjenta, ale były usunięte przed przetoczeniem, i raporty o nich przesyła do właściwego centrum.
5.45) Jeżeli aktualne badanie dawcy wykazało potwierdzoną obecność zakażenia wirusem HBV, HCV lub HIV, właściwe centrum rozpoczyna procedurę śledzenia drogi krwi lub jej składników od dawcy do biorcy w celu ustalenia biorców krwi, którzy mogli ulec zakażeniu tymi wirusami w okresie wczesnego zakażenia dawcy, w którym pomimo obecności czynników zakaźnych jeszcze się ich nie wykrywa stosowanymi metodami (okienko diagnostyczne).
6. Lekarz, który sprawował opiekę nad pacjentem, u którego wystąpiło podejrzenie poprzetoczeniowego zakażenia jednym z wirusów HBV, HCV lub HIV, lub lekarz wyznaczony przez kierownika jednostki lub komórki organizacyjnej podmiotu leczniczego ma obowiązek poinformować o tym pacjenta i zlecić odpowiednie badania w celu potwierdzenia lub wykluczenia zakażenia. Podmiot leczniczy informuje właściwe centrum o rezultatach przeprowadzonej procedury - również w przypadku, gdy badania nie zostały wykonane - wraz z podaniem przyczyny niewykonania badań.
7.46) Jeżeli u biorcy rozpoznano TRALI i w osoczu dawcy, w trakcie diagnostyki przyczyn TRALI, wykryto przeciwciała, właściwe centrum rozpoczyna procedurę prześledzenia drogi krwi od biorcy do dawcy w celu stwierdzenia, czy krew i jej składniki od tego samego dawcy spowodowały niepożądane reakcje u innych biorców krwi.
Rozdział 6
Przepisy przejściowe i przepis końcowy
§ 39. Do dnia 31 grudnia 2020 r. kierownikiem pracowni immunologii transfuzjologicznej może być:
1) osoba zatrudniona na tym stanowisku w dniu wejścia w życie rozporządzenia nieposiadająca kwalifikacji, o których mowa w § 25 ust. 1 i 2,
2) diagnosta laboratoryjny lub lekarz niezatrudniony w dniu wejścia w życie rozporządzenia na stanowisku kierownika, jeżeli posiada co najmniej 3-letnie doświadczenie zawodowe w wykonywaniu badań immunohematologicznych
- pod warunkiem, że osoba ta posiada zaświadczenie uprawniające do wykonywania badań i autoryzacji wyników i jest w trakcie specjalizacji w dziedzinie laboratoryjnej transfuzjologii medycznej lub transfuzjologii klinicznej.
§ 40. Do dnia 31 grudnia 2027 r. obowiązki lekarza odpowiedzialnego za gospodarkę krwią i jej składnikami można powierzyć innemu lekarzowi specjaliście, o którym mowa w § 5 ust. 2.
§ 41. 1. Komitety transfuzjologiczne działające na podstawie dotychczasowych przepisów z dniem wejścia w życie niniejszego rozporządzenia stają się komitetami transfuzjologicznymi w rozumieniu niniejszego rozporządzenia.
2. Lekarze odpowiedzialni za gospodarkę krwią powołani na podstawie dotychczasowych przepisów z dniem wejścia w życie niniejszego rozporządzenia stają się lekarzami odpowiedzialnym za gospodarkę krwią w rozumieniu niniejszego rozporządzenia.
§ 42. Zaświadczenia upoważniające do wykonywania, w tym samodzielnego, badań serologicznych (immunohematologicznych) uzyskane przed dniem wejścia w życie niniejszego rozporządzenia zachowują ważność.
§ 43. Rozporządzenie wchodzi w życie z dniem następującym po dniu ogłoszenia47).48)
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 16 października 2017 r.
Załącznik nr 1
WZÓR - KSIĄŻKA TRANSFUZYJNA
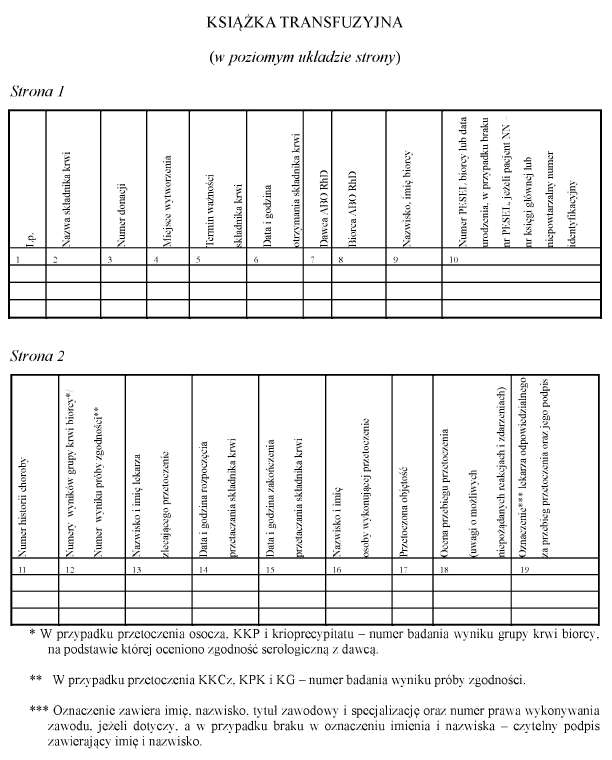
Załącznik nr 2
WZÓR - STANDARDOWA PROCEDURA OPERACYJNA (SOP)
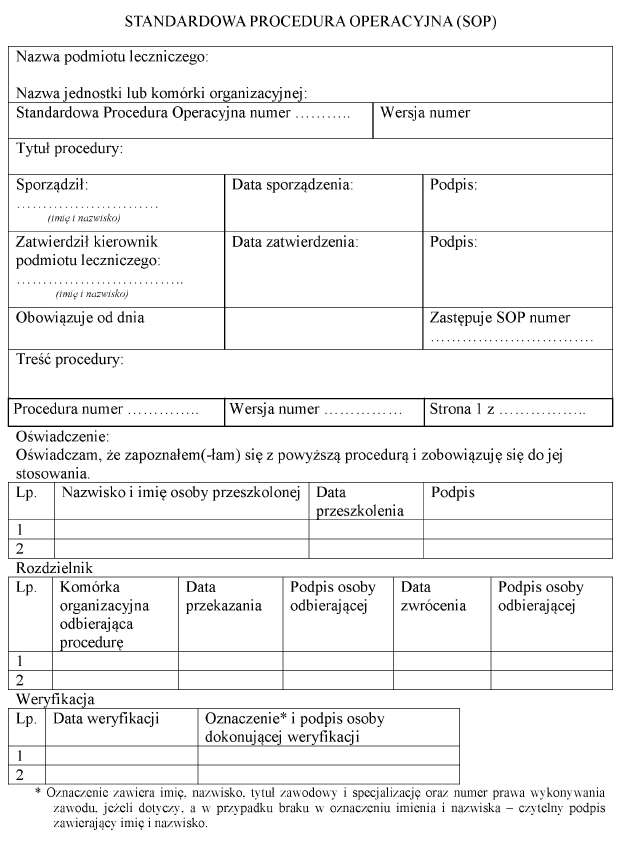
Załącznik nr 3
WZÓR - ZAMÓWIENIE INDYWIDUALNE NA KREW LUB JEJ SKŁADNIKI

Załącznik nr 449)
WZÓR - KARTA GRUPY KRWI
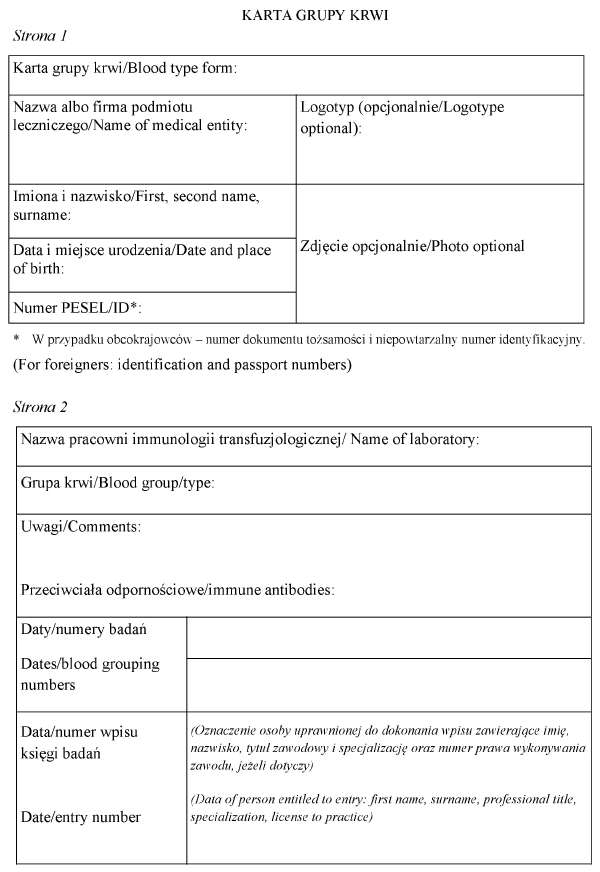
Załącznik nr 550)
WZÓR - ZLECENIE NA BADANIE GRUPY KRWI

Załącznik nr 651)
WZÓR - ZLECENIE NA WYKONANIE PRÓBY ZGODNOŚCI

Załącznik nr 752)
WZÓR - WYNIK BADANIA GRUPY KRWI

Załącznik nr 8
WZÓR - ZAMÓWIENIE NA KREW I JEJ SKŁADNIKI DO PILNEGO PRZETOCZENIA


Załącznik nr 9
WZÓR - WYNIK PRÓBY ZGODNOŚCI

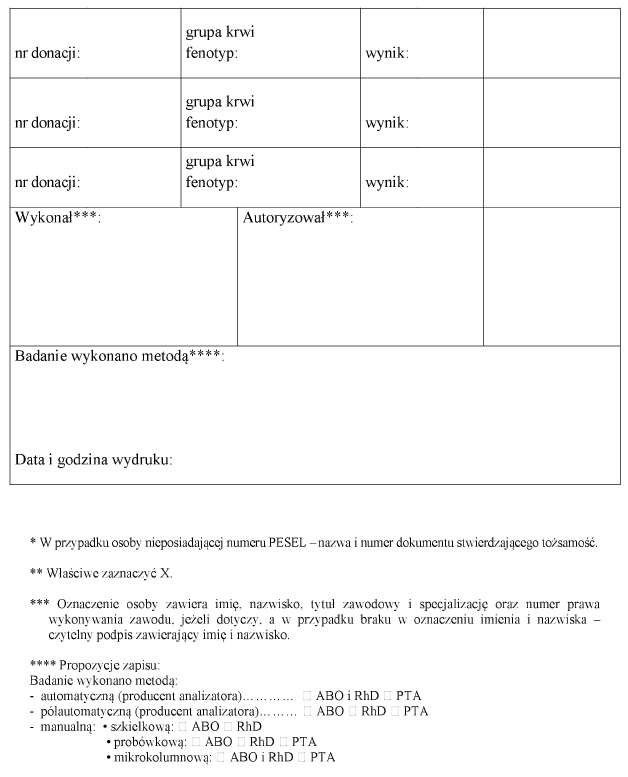
Załącznik nr 10
WZÓR - ZGŁOSZENIE NIEPOŻĄDANEJ REAKCJI LUB ZDARZENIA

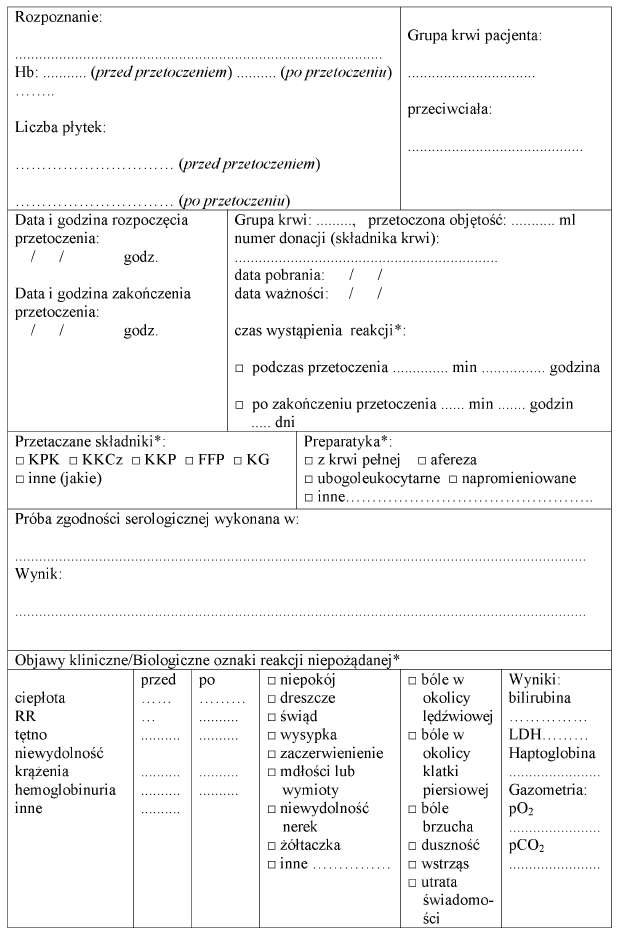


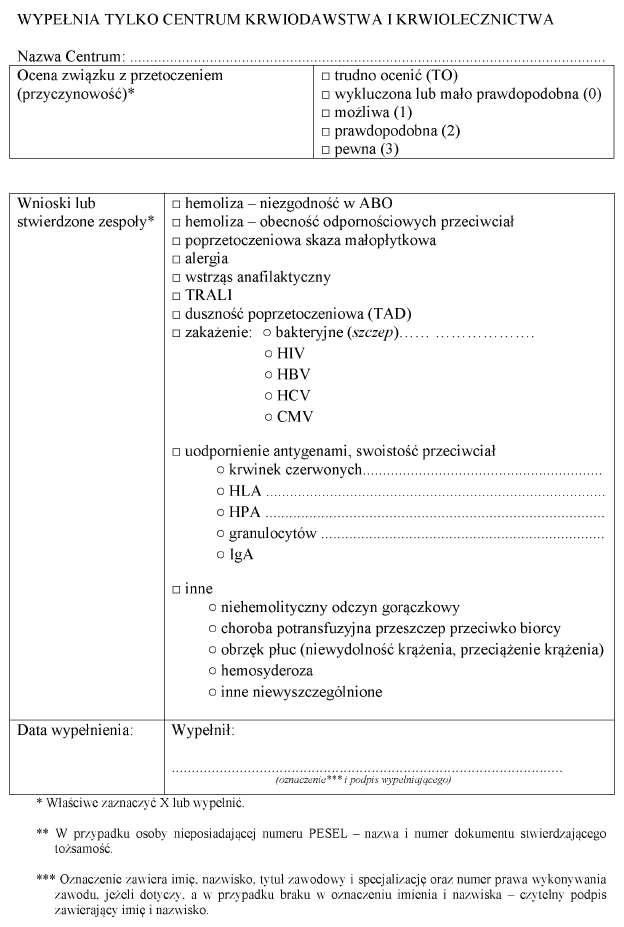
Załącznik nr 11
WZÓR - ZAMÓWIENIE ZBIORCZE NA KREW LUB JEJ SKŁADNIKI

Załącznik nr 12
WZÓR - ZAŚWIADCZENIE UPOWAŻNIAJĄCE DO SAMODZIELNEGO WYKONYWANIA BADAŃ IMMUNOHEMATOLOGICZNYCH ORAZ AUTORYZACJI WYNIKÓW DLA DIAGNOSTY LABORATORYJNEGO I LEKARZA ORAZ ZAŚWIADCZENIE UPOWAŻNIAJĄCE DO SAMODZIELNEGO WYKONYWANIA BADAŃ IMMUNOHEMATOLOGICZNYCH DLA TECHNIKA ANALITYKI MEDYCZNEJ


Załącznik nr 13
WZÓR - KSIĄŻKA BADAŃ GRUP KRWI
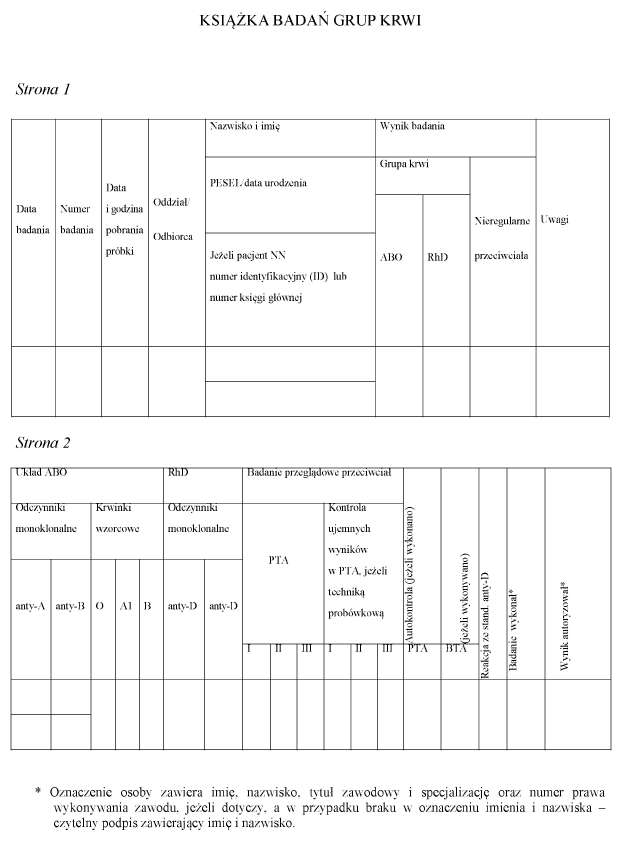
Załącznik nr 14
WZÓR - KSIĄŻKA PRÓB ZGODNOŚCI
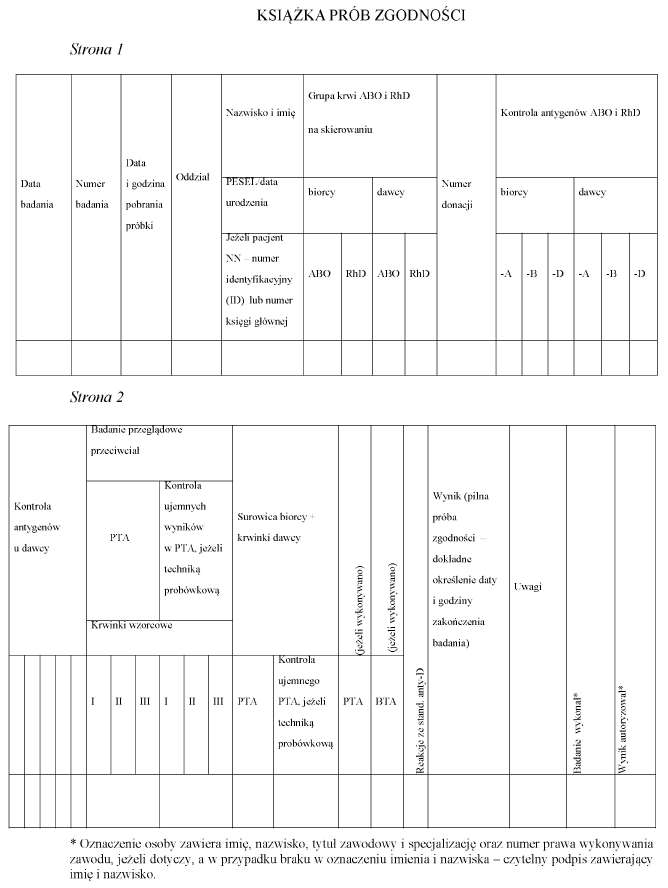
Załącznik nr 15
WZÓR - ZLECENIE NA KONSULTACYJNE BADANIE IMMUNOHEMATOLOGICZNE

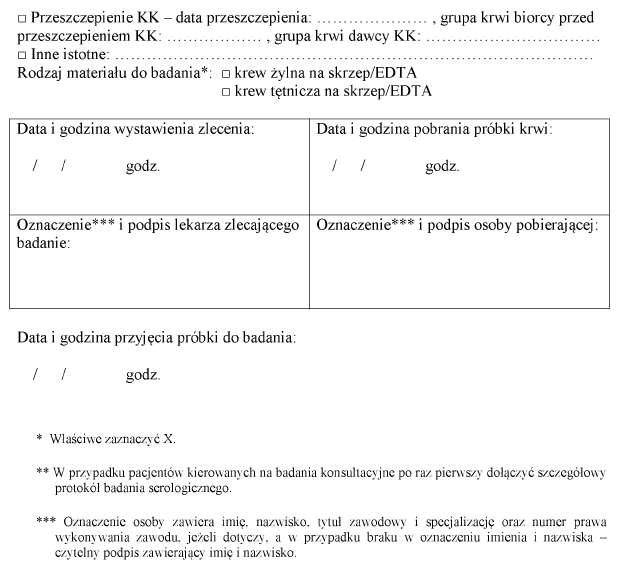
Załącznik nr 1653)
WZÓR - ZLECENIE NA WYKONANIE BADAŃ IMMUNOHEMATOLOGICZNYCH KWALIFIKUJĄCYCH DO PODANIA IMMUNOGLOBULINY ANTY-RhD

Załącznik nr 1754)
(uchylony)
Załącznik nr 1855)
WZÓR - WYDANIE KRWI DO PILNEGO PRZETOCZENIA PRZED WYKONANIEM PRÓBY ZGODNOŚCI

Załącznik nr 1955)
WZÓR - WYDANIE KRWI DLA NOWORODKA/NIEMOWLĘCIA DO UKOŃCZENIA 4 MIESIĄCA ŻYCIA BEZ WYKONYWANIA PRÓBY KRZYŻOWEJ

1) Minister Zdrowia kieruje działem administracji rządowej - zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 27 sierpnia 2020 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. poz. 1470 i 1541).
2) Niniejsze rozporządzenie w zakresie swojej regulacji wdraża:
1) dyrektywę 2002/98/WE Parlamentu Europejskiego i Rady z dnia 27 stycznia 2003 r. ustanawiającą normy jakości i bezpiecznego pobierania, badania, preparatyki, przechowywania, wydawania krwi ludzkiej i składników krwi oraz zmieniającej dyrektywę 2001/83/WE (Dz. Urz. UE L 33 z 08.02.2003, str. 30 - Dz. Urz. UE Polskie wydanie specjalne, rozdz. 15, t. 7, str. 346, Dz. Urz. UE L 230 z 24.08.2006, str. 12, Dz. Urz. UE L 188 z 18.07.2009, str. 14 oraz Dz. Urz. UE L 98 z 15.04.2015, str. 11);
2) dyrektywę Komisji 2004/33/WE z dnia 22 marca 2004 r. wykonującą dyrektywę 2002/98/WE Parlamentu Europejskiego i Rady w zakresie niektórych wymagań technicznych dotyczących krwi i składników krwi (Dz. Urz. UE L 91 z 30.03.2004, str. 25 - Dz. Urz. UE Polskie wydanie specjalne, rozdz. 15, t. 8, str. 272, Dz. Urz. UE L 288 z 04.11.2009, str. 7, Dz. Urz. UE L 97 z 12.04.2011, str. 28 oraz Dz. Urz. UE L 366 z 20.12.2014, str. 81);
3) dyrektywę Komisji 2005/61/WE z dnia 30 września 2005 r. wykonującą dyrektywę 2002/98/WE Parlamentu Europejskiego i Rady w zakresie wymogów dotyczących śledzenia losów krwi oraz powiadamiania o poważnych, niepożądanych reakcjach i zdarzeniach (Dz. Urz. UE L 256 z 01.10.2005, str. 32);
4) dyrektywę Komisji 2005/62/WE z dnia 30 września 2005 r. wykonującą dyrektywę 2002/98/WE Parlamentu Europejskiego i Rady w zakresie norm i specyfikacji wspólnotowych odnoszących się do systemu jakości obowiązującego w placówkach służby krwi (Dz. Urz. UE L 256 z 01.10.2005, str. 41 oraz Dz. Urz. UE L 199 z 26.07.2016, str. 14).
3) Dodany przez § 1 pkt 1 rozporządzenia Ministra Zdrowia z dnia 8 lipca 2019 r. zmieniającego rozporządzenie w sprawie leczenia krwią i jej składnikami w podmiotach leczniczych wykonujących działalność leczniczą w rodzaju stacjonarne i całodobowe świadczenia zdrowotne (Dz. U. poz. 1441), które weszło w życie z dniem 2 października 2019 r.
4) Wprowadzenie do wyliczenia w brzmieniu ustalonym przez § 1 pkt 2 rozporządzenia, o którym mowa w odnośniku 3.
5) W brzmieniu ustalonym przez § 1 pkt 3 rozporządzenia, o którym mowa w odnośniku 3.
6) W brzmieniu ustalonym przez § 1 pkt 4 rozporządzenia, o którym mowa w odnośniku 3.
7) W brzmieniu ustalonym przez § 1 pkt 5 rozporządzenia, o którym mowa w odnośniku 3.
8) Dodany przez § 1 rozporządzenia Ministra Zdrowia z dnia 26 marca 2020 r. zmieniającego rozporządzenie w sprawie leczenia krwią i jej składnikami w podmiotach leczniczych wykonujących działalność leczniczą w rodzaju stacjonarne i całodobowe świadczenia zdrowotne (Dz. U. poz. 535), które weszło w życie z dniem 27 marca 2020 r.
9) W brzmieniu ustalonym przez § 1 pkt 6 rozporządzenia, o którym mowa w odnośniku 3.
10) W brzmieniu ustalonym przez § 1 pkt 7 rozporządzenia, o którym mowa w odnośniku 3.
11) W brzmieniu ustalonym przez § 1 pkt 8 lit. a rozporządzenia, o którym mowa w odnośniku 3.
12) Dodany przez § 1 pkt 8 lit. b rozporządzenia, o którym mowa w odnośniku 3.
13) W brzmieniu ustalonym przez § 1 pkt 8 lit. c rozporządzenia, o którym mowa w odnośniku 3.
14) Dodany przez § 1 pkt 9 lit. a rozporządzenia, o którym mowa w odnośniku 3.
15) Dodany przez § 1 pkt 9 lit. b rozporządzenia, o którym mowa w odnośniku 3.
16) W brzmieniu ustalonym przez § 1 pkt 9 lit. c rozporządzenia, o którym mowa w odnośniku 3.
17) W brzmieniu ustalonym przez § 1 pkt 9 lit. d rozporządzenia, o którym mowa w odnośniku 3.
18) W brzmieniu ustalonym przez § 1 pkt 9 lit. e rozporządzenia, o którym mowa w odnośniku 3.
19) W brzmieniu ustalonym przez § 1 pkt 9 lit. f rozporządzenia, o którym mowa w odnośniku 3.
20) W brzmieniu ustalonym przez § 1 pkt 10 rozporządzenia, o którym mowa w odnośniku 3.
21) Wprowadzenie do wyliczenia ze zmianą wprowadzoną przez § 1 pkt 11 lit. a rozporządzenia, o którym mowa w odnośniku 3.
22) W brzmieniu ustalonym przez § 1 pkt 11 lit. b rozporządzenia, o którym mowa w odnośniku 3.
23) Dodany przez § 1 pkt 12 rozporządzenia, o którym mowa w odnośniku 3.
24) Wprowadzenie do wyliczenia w brzmieniu ustalonym przez § 1 pkt 13 lit. a rozporządzenia, o którym mowa w odnośniku 3.
25) W brzmieniu ustalonym przez § 1 pkt 13 lit. b rozporządzenia, o którym mowa w odnośniku 3.
26) Dodany przez § 1 pkt 13 lit. c rozporządzenia, o którym mowa w odnośniku 3.
27) W brzmieniu ustalonym przez § 1 pkt 14 rozporządzenia, o którym mowa w odnośniku 3.
28) Dodany przez § 1 pkt 15 rozporządzenia, o którym mowa w odnośniku 3.
29) W brzmieniu ustalonym przez § 1 pkt 16 rozporządzenia, o którym mowa w odnośniku 3.
30) Uchylony przez art. 29 pkt 2 lit. c ustawy z dnia 5 lipca 2018 r. o zmianie ustawy o usługach zaufania oraz identyfikacji elektronicznej oraz niektórych innych ustaw (Dz. U. poz. 1544), która weszła w życie z dniem 11 września 2018 r.
31) W brzmieniu ustalonym przez § 1 pkt 17 rozporządzenia, o którym mowa w odnośniku 3.
32) W brzmieniu ustalonym przez § 1 pkt 18 lit. a rozporządzenia, o którym mowa w odnośniku 3.
33) W brzmieniu ustalonym przez § 1 pkt 18 lit. b rozporządzenia, o którym mowa w odnośniku 3.
34) W brzmieniu ustalonym przez § 1 pkt 18 lit. c rozporządzenia, o którym mowa w odnośniku 3.
35) Przez § 1 pkt 18 lit. d rozporządzenia, o którym mowa w odnośniku 3.
36) W brzmieniu ustalonym przez § 1 pkt 18 lit. e rozporządzenia, o którym mowa w odnośniku 3.
37) W brzmieniu ustalonym przez § 1 pkt 18 lit. f rozporządzenia, o którym mowa w odnośniku 3.
38) W brzmieniu ustalonym przez § 1 pkt 19 lit. a rozporządzenia, o którym mowa w odnośniku 3.
39) W brzmieniu ustalonym przez § 1 pkt 19 lit. b rozporządzenia, o którym mowa w odnośniku 3.
40) W brzmieniu ustalonym przez § 1 pkt 20 lit. a rozporządzenia, o którym mowa w odnośniku 3.
41) Dodany przez § 1 pkt 20 lit. b rozporządzenia, o którym mowa w odnośniku 3.
42) Dodany przez § 1 pkt 20 lit. c rozporządzenia, o którym mowa w odnośniku 3.
43) W brzmieniu ustalonym przez § 1 pkt 21 rozporządzenia, o którym mowa w odnośniku 3.
44) Przez § 1 pkt 22 rozporządzenia, o którym mowa w odnośniku 3.
45) W brzmieniu ustalonym przez § 1 pkt 23 lit. a rozporządzenia, o którym mowa w odnośniku 3.
46) W brzmieniu ustalonym przez § 1 pkt 23 lit. b rozporządzenia, o którym mowa w odnośniku 3.
47) Rozporządzenie zostało ogłoszone w dniu 6 listopada 2017 r.
48) Niniejsze rozporządzenie było poprzedzone rozporządzeniem Ministra Zdrowia z dnia 11 grudnia 2012 r. w sprawie leczenia krwią w podmiotach leczniczych wykonujących działalność leczniczą w rodzaju stacjonarne i całodobowe świadczenia zdrowotne, w których przebywają pacjenci ze wskazaniami do leczenia krwią i jej składnikami (Dz. U. z 2013 r. poz. 5), które utraciło moc z dniem 12 września 2017 r. zgodnie z art. 15 ust. 1 ustawy z dnia 20 maja 2016 r. o zmianie ustawy o publicznej służbie krwi oraz niektórych innych ustaw (Dz. U. poz. 823 oraz z 2017 r. poz. 1524).
49) W brzmieniu ustalonym przez § 1 pkt 24 rozporządzenia, o którym mowa w odnośniku 3.
50) W brzmieniu ustalonym przez § 1 pkt 25 rozporządzenia, o którym mowa w odnośniku 3.
51) W brzmieniu ustalonym przez § 1 pkt 26 rozporządzenia, o którym mowa w odnośniku 3.
52) W brzmieniu ustalonym przez § 1 pkt 27 rozporządzenia, o którym mowa w odnośniku 3.
53) W brzmieniu ustalonym przez § 1 pkt 28 rozporządzenia, o którym mowa w odnośniku 3.
54) Przez § 1 pkt 29 rozporządzenia, o którym mowa w odnośniku 3.
55) Dodany przez § 1 pkt 30 rozporządzenia, o którym mowa w odnośniku 3.
- Data ogłoszenia: 2021-03-19
- Data wejścia w życie: 2021-03-19
- Data obowiązywania: 2023-06-11
- Dokument traci ważność: 2023-08-29
- ROZPORZĄDZENIE MINISTRA ZDROWIA z dnia 11 maja 2022 r. zmieniające rozporządzenie w sprawie leczenia krwią i jej składnikami w podmiotach leczniczych wykonujących działalność leczniczą w rodzaju stacjonarne i całodobowe świadczenia zdrowotne
- ROZPORZĄDZENIE MINISTRA ZDROWIA z dnia 4 maja 2023 r. zmieniające rozporządzenie w sprawie leczenia krwią i jej składnikami w podmiotach leczniczych wykonujących działalność leczniczą w rodzaju stacjonarne i całodobowe świadczenia zdrowotne
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
