REKLAMA
Dziennik Ustaw - rok 2019 poz. 2499
ROZPORZĄDZENIE
MINISTRA ZDROWIA1)
z dnia 21 grudnia 2019 r.
zmieniające rozporządzenie w sprawie wzoru formularza powiadomienia o produktach wprowadzanych po raz pierwszy do obrotu na terytorium Rzeczypospolitej Polskiej, rejestru produktów objętych powiadomieniem oraz wykazu krajowych jednostek naukowych właściwych do wydawania opinii
Na podstawie art. 31 ust. 6 ustawy z dnia 25 sierpnia 2006 r. o bezpieczeństwie żywności i żywienia (Dz. U. z 2019 r. poz. 1252) zarządza się, co następuje:
§ 1. [Rozporządzenie w sprawie wzoru formularza powiadomienia o produktach wprowadzanych po raz pierwszy do obrotu na terytorium Rzeczypospolitej Polskiej, rejestru produktów objętych powiadomieniem oraz wykazu krajowych jednostek naukowych właściwych do wydawania opinii]
1) w odnośniku nr 2 do tytułu rozporządzenia uchyla się pkt 3;
2) do tytułu rozporządzenia dodaje się odnośnik nr 2a w brzmieniu:
„2a) Niniejsze rozporządzenie służy stosowaniu:
1) rozporządzenia Parlamentu Europejskiego i Rady (UE) nr 609/2013 z dnia 12 czerwca 2013 r. w sprawie żywności przeznaczonej dla niemowląt i małych dzieci oraz żywności specjalnego przeznaczenia medycznego i środków spożywczych zastępujących całodzienną dietę, do kontroli masy ciała oraz uchylającego dyrektywę Rady 92/52/EWG, dyrektywy Komisji 96/8/WE, 1999/21/WE, 2006/125/WE i 2006/141/WE, dyrektywę Parlamentu Europejskiego i Rady 2009/39/WE oraz rozporządzenia Komisji (WE) nr 41/2009 i (WE) nr 953/2009 (Dz. Urz. UE L 181 z 29.06.2013, str. 35, Dz. Urz. UE L 349 z 05.12.2014, str. 67 oraz Dz. Urz. UE L 158 z 21.06.2017, str. 5);
2) rozporządzenia delegowanego Komisji (UE) 2016/127 z dnia 25 września 2015 r. uzupełniającego rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 609/2013 w odniesieniu do szczegółowych wymogów dotyczących składu preparatów do początkowego żywienia niemowląt i preparatów do dalszego żywienia niemowląt oraz informacji na ich temat, a także w odniesieniu do informacji dotyczących żywienia niemowląt i małych dzieci (Dz. Urz. UE L 25 z 02.02.2016, str. 1, Dz. Urz. UE L 94 z 12.04.2018, str. 1 oraz Dz. Urz. UE L 137 z 23.05.2019, str. 12);
3) rozporządzenia delegowanego Komisji (UE) 2016/128 z dnia 25 września 2015 r. uzupełniającego rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 609/2013 w odniesieniu do szczegółowych wymogów dotyczących składu żywności specjalnego przeznaczenia medycznego oraz informacji na jej temat (Dz. Urz. UE L 25 z 02.02.2016, str. 30);
4) rozporządzenia delegowanego Komisji (UE) 2017/1798 z dnia 2 czerwca 2017 r. uzupełniającego rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 609/2013 w odniesieniu do szczegółowych wymogów dotyczących składu i informacji w odniesieniu do środków spożywczych zastępujących całodzienną dietę, do kontroli masy ciała (Dz. Urz. UE L 259 z 07.10.2017, str. 2).”;
3) w § 2 w ust. 2 skreśla się wyrazy „w Biuletynie Informacji Publicznej”;
4) w § 3 ust. 1 otrzymuje brzmienie:
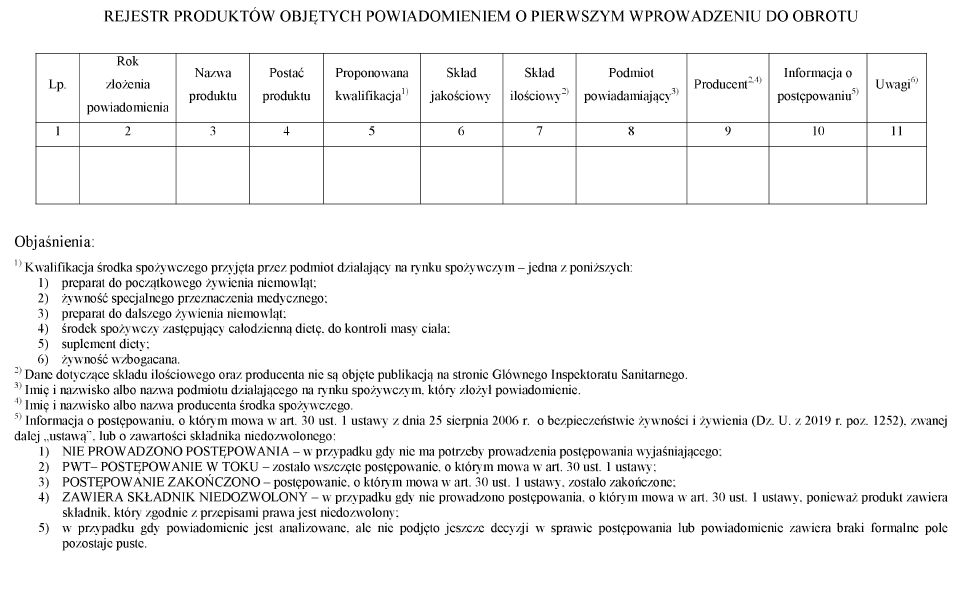
„1. Rejestr produktów objętych powiadomieniem zawiera następujące dane:
1) rok złożenia powiadomienia;
2) nazwę produktu;
3) postać produktu, w jakiej jest on wprowadzany do obrotu;
4) kwalifikację zaproponowaną przez podmiot działający na rynku spożywczym;
5) skład jakościowy obejmujący dane dotyczące składników zawartych w produkcie, w tym substancji czynnych;
6) skład ilościowy składników;
7) imię i nazwisko albo nazwę podmiotu powiadamiającego o pierwszym wprowadzeniu do obrotu;
8) imię i nazwisko albo nazwę producenta;
9) informację o postępowaniu, o którym mowa w art. 30 ust. 1 ustawy, lub o zawartości składnika niedozwolonego;
10) uwagi – informacje dodatkowe o danym przypadku, w sytuacji gdy postępowanie, o którym mowa w art. 30 ust. 1 ustawy, nie było prowadzone, zostało zakończone lub produkt zawiera składnik niedozwolony.”;
5) załączniki nr 1 i 2 do rozporządzenia otrzymują brzmienie określone odpowiednio w załącznikach nr 1 i 2 do niniejszego rozporządzenia.
§ 2. [Przepis przejściowy]
2. Wpisy w rejestrze produktów objętych powiadomieniem, dokonane przed dniem wejścia w życie niniejszego rozporządzenia, w przypadku których w kolumnie nr 9 użyto sformułowania „PWT – postępowanie w toku”, dostosowuje się do wymogów niniejszego rozporządzenia w terminie do dnia 31 grudnia 2022 r.
§ 3. [Wejście w życie]
Minister Zdrowia: wz. J. Szczurek-Żelazko
1) Minister Zdrowia kieruje działem administracji rządowej - zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 18 listopada 2019 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. poz. 2269).
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 21 grudnia 2019 r. (poz. 2499)
Załącznik nr 1
WZÓR – POWIADOMIENIE O WPROWADZENIU/O ZAMIARZE WPROWADZENIA PO RAZ PIERWSZY DO OBROTU NA TERYTORIUM RZECZYPOSPOLITEJ POLSKIEJ


Załącznik nr 2
WZÓR – REJESTR PRODUKTÓW OBJĘTYCH POWIADOMIENIEM O PIERWSZYM WPROWADZENIU DO OBROTU

- Data ogłoszenia: 2019-12-27
- Data wejścia w życie: 2020-01-01
- Data obowiązywania: 2020-01-01
REKLAMA
