REKLAMA
Dziennik Ustaw - rok 2014 poz. 1604
OBWIESZCZENIE
MINISTRA ZDROWIA
z dnia 19 września 2014 r.
w sprawie ogłoszenia jednolitego tekstu rozporządzenia Ministra Zdrowia w sprawie kategorii substancji niebezpiecznych i mieszanin niebezpiecznych, których opakowania wyposaża się w zamknięcia utrudniające otwarcie przez dzieci i wyczuwalne dotykiem ostrzeżenie o niebezpieczeństwie
1. Na podstawie art. 16 ust. 3 ustawy z dnia 20 lipca 2000 r. o ogłaszaniu aktów normatywnych i niektórych innych aktów prawnych (Dz. U. z 2011 r. Nr 197, poz. 1172 i Nr 232, poz. 1378) ogłasza się w załączniku do niniejszego obwieszczenia jednolity tekst rozporządzenia Ministra Zdrowia z dnia 11 czerwca 2012 r. w sprawie kategorii substancji niebezpiecznych i mieszanin niebezpiecznych, których opakowania wyposaża się w zamknięcia utrudniające otwarcie przez dzieci i wyczuwalne dotykiem ostrzeżenie o niebezpieczeństwie (Dz. U. poz. 688), z uwzględnieniem zmiany wprowadzonej rozporządzeniem Ministra Zdrowia z dnia 10 października 2013 r. zmieniającym rozporządzenie w sprawie kategorii substancji niebezpiecznych i mieszanin niebezpiecznych, których opakowania wyposaża się w zamknięcia utrudniające otwarcie przez dzieci i wyczuwalne dotykiem ostrzeżenie o niebezpieczeństwie (Dz. U. poz. 1225).
2. Podany w załączniku do niniejszego obwieszczenia tekst jednolity rozporządzenia nie obejmuje odnośnika nr 2 oraz § 2 rozporządzenia Ministra Zdrowia z dnia 10 października 2013 r. zmieniającego rozporządzenie w sprawie kategorii substancji niebezpiecznych i mieszanin niebezpiecznych, których opakowania wyposaża się w zamknięcia utrudniające otwarcie przez dzieci i wyczuwalne dotykiem ostrzeżenie o niebezpieczeństwie (Dz. U. poz. 1225), które stanowią:
„2) Niniejsze rozporządzenie w zakresie swojej regulacji uzupełnia wdrożenie:
1) dyrektywy Rady 67/548/EWG z dnia 27 czerwca 1967 r. w sprawie zbliżenia przepisów ustawodawczych, wykonawczych i administracyjnych odnoszących się do klasyfikacji, pakowania i etykietowania substancji niebezpiecznych (Dz. Urz. WE L 196 z 16.08.1967, str. 1; Dz. Urz. UE Polskie wydanie specjalne, rozdz. 13, t. 1, str. 27);
2) dyrektywy 1999/45/WE Parlamentu Europejskiego i Rady z dnia 31 maja 1999 r. w sprawie zbliżenia przepisów ustawowych, wykonawczych i administracyjnych Państw Członkowskich odnoszących się do klasyfikacji, pakowania i etykietowania preparatów niebezpiecznych (Dz. Urz. WE L 200 z 30.07.1999, str. 1; Dz. Urz. UE Polskie wydanie specjalne, rozdz. 13, t. 24, str. 109).”
„§ 2. Rozporządzenie wchodzi w życie z dniem następującym po dniu ogłoszenia.”.
Minister Zdrowia: B.A. Arłukowicz
Załącznik do obwieszczenia Ministra Zdrowia
z dnia 19 września 2014 r. (poz. 1604)
ROZPORZĄDZENIE
MINISTRA ZDROWIA1)
z dnia 11 czerwca 2012 r.
w sprawie kategorii substancji niebezpiecznych i mieszanin niebezpiecznych, których opakowania wyposaża się w zamknięcia utrudniające otwarcie przez dzieci i wyczuwalne dotykiem ostrzeżenie o niebezpieczeństwie2)
Na podstawie art. 22 ust. 7 ustawy z dnia 25 lutego 2011 r. o substancjach chemicznych i ich mieszaninach (Dz. U. Nr 63, poz. 322 oraz z 2012 r. poz. 908) zarządza się, co następuje:
§ 1. Rozporządzenie określa:
1) kategorie substancji niebezpiecznych i mieszanin niebezpiecznych, których opakowania wyposaża się w zamknięcia utrudniające ich otwarcie przez dzieci i wyczuwalne dotykiem ostrzeżenie o niebezpieczeństwie;
2) wymagania dotyczące zamknięć i ostrzeżeń, o których mowa w pkt 1, oraz normy, które muszą spełniać takie zamknięcia oraz wyczuwalne dotykiem ostrzeżenia.
§ 2. Opakowania substancji lub mieszanin oznakowane zgodnie z przepisami wydanymi na podstawie art. 20 ust. 11 ustawy z dnia 25 lutego 2011 r. o substancjach chemicznych i ich mieszaninach, zwanej dalej „ustawą”, jako bardzo toksyczne, toksyczne lub żrące, oferowane lub sprzedawane konsumentom, wyposaża się, niezależnie od pojemności opakowania, w zamknięcia utrudniające otwarcie przez dzieci i wyczuwalne dotykiem ostrzeżenie o niebezpieczeństwie.
§ 3. 1. Opakowania substancji lub mieszanin oznakowane zgodnie z przepisami wydanymi na podstawie art. 20 ust. 11 ustawy jako szkodliwe, skrajnie łatwopalne lub wysoce łatwopalne, oferowane lub sprzedawane konsumentom, wyposaża się, niezależnie od pojemności opakowania, w wyczuwalne dotykiem ostrzeżenie o niebezpieczeństwie.
2. Przepisu ust. 1 nie stosuje się do pojemników aerozolowych zawierających substancje lub mieszaniny zaklasyfikowane zgodnie z przepisami wydanymi na podstawie art. 19 ust. 5 ustawy lub tabelą 3.2 załącznika VI do rozporządzenia Parlamentu Europejskiego i Rady (WE) nr 1272/2008 z dnia 16 grudnia 2008 r. w sprawie klasyfikacji, oznakowania i pakowania substancji i mieszanin, zmieniającego i uchylającego dyrektywy 67/548/EWG i 1999/45/WE oraz zmieniającego rozporządzenie (WE) nr 1907/2006 (Dz. Urz. UE L 353 z 31.12.2008, str. 1), zwanej dalej „tabelą 3.2 załącznika VI do rozporządzenia nr 1272/2008”, wyłącznie jako skrajnie łatwopalne lub wysoce łatwopalne.
§ 4. Opakowania substancji lub mieszanin zawierających co najmniej 3% metanolu (Nr CAS 67-56-1) lub co najmniej 1% dichlorometanu (Nr CAS 75-09-2), oferowane lub sprzedawane konsumentom, wyposaża się, niezależnie od pojemności opakowania, w zamknięcia utrudniające otwarcie przez dzieci.
§ 5. Opakowania substancji lub mieszanin, oferowane lub sprzedawane konsumentom, które zgodnie z przepisami wydanymi na podstawie art. 19 ust. 5 ustawy lub tabelą 3.2 załącznika VI do rozporządzenia nr 1272/2008 zaklasyfikowano i oznakowano jako szkodliwe z przypisanym zwrotem R65 „Działa szkodliwie; może powodować uszkodzenie płuc w przypadku połknięcia”, z wyjątkiem substancji lub mieszanin wprowadzanych do obrotu w pojemnikach aerozolowych lub w pojemnikach wyposażonych w szczelne urządzenia do wytwarzania aerozolu, wyposaża się, niezależnie od pojemności opakowania, w zamknięcia utrudniające otwarcie przez dzieci.
§ 6. 1. W opakowaniach wielokrotnego zamykania zamknięcia utrudniające otwarcie przez dzieci muszą spełniać wymagania określone w normie dotyczącej opakowań zabezpieczonych przed niepożądanym otwarciem przez dziecko – wymagań i metod badań opakowań przystosowanych do powtórnego zamknięcia.
2. Wymagania dla zamknięć utrudniających otwarcie przez dzieci w opakowaniach bez zamknięć wielokrotnego zamykania określa załącznik do rozporządzenia.
3. W opakowaniach bez zamknięć wielokrotnego zamykania zamknięcia utrudniające otwarcie przez dzieci muszą spełniać wymagania określone w załączniku do rozporządzenia lub normie dotyczącej metod badań dla opakowań zabezpieczonych przed niepożądanym otwarciem przez dziecko.
§ 7. Wyczuwalne dotykiem ostrzeżenia o niebezpieczeństwie muszą spełniać wymagania odnoszące się do opakowań określone w normie dotyczącej znaków ostrzegających przed niebezpieczeństwem wyczuwalnych dotykiem.
§ 8. Rozporządzenie wchodzi w życie z dniem ogłoszenia3).4)
1) Minister Zdrowia kierował działem administracji rządowej – zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 18 listopada 2011 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. Nr 248, poz. 1495 i Nr 284, poz. 1672).
2) Niniejsze rozporządzenie w zakresie swojej regulacji wdraża dyrektywę 1999/45/WE Parlamentu Europejskiego i Rady z dnia 31 maja 1999 r. w sprawie zbliżenia przepisów ustawowych, wykonawczych i administracyjnych Państw Członkowskich odnoszących się do klasyfikacji, pakowania i etykietowania preparatów niebezpiecznych (Dz. Urz. WE L 200 z 30.07.1999, str. 1; Dz. Urz. UE Polskie wydanie specjalne, rozdz. 13, t. 24, str. 109) oraz dyrektywę Rady 67/548/EWG z dnia 27 czerwca 1967 r. w sprawie zbliżenia przepisów ustawodawczych, wykonawczych i administracyjnych odnoszących się do klasyfikacji, pakowania i etykietowania substancji niebezpiecznych (Dz. Urz. WE L 196 z 16.08.1967, str. 1; Dz. Urz. UE Polskie wydanie specjalne, rozdz. 13, t. 1, str. 27).
3) Rozporządzenie zostało ogłoszone w dniu 20 czerwca 2012 r.
4) Niniejsze rozporządzenie było poprzedzone rozporządzeniem Ministra Zdrowia z dnia 29 kwietnia 2010 r. w sprawie rodzajów substancji niebezpiecznych i preparatów niebezpiecznych, których opakowania zaopatruje się w zamknięcia utrudniające otwarcie przez dzieci i wyczuwalne dotykiem ostrzeżenie o niebezpieczeństwie (Dz. U. Nr 83, poz. 544), które utraciło moc z dniem 9 kwietnia 2012 r. na podstawie art. 88 pkt 1 ustawy z dnia 25 lutego 2011 r. o substancjach chemicznych i ich mieszaninach (Dz. U. Nr 63, poz. 322).
5) W brzmieniu ustalonym przez § 1 rozporządzenia Ministra Zdrowia z dnia 10 października 2013 r. zmieniającego rozporządzenie w sprawie kategorii substancji niebezpiecznych i mieszanin niebezpiecznych, których opakowania wyposaża się w zamknięcia utrudniające otwarcie przez dzieci i wyczuwalne dotykiem ostrzeżenie o niebezpieczeństwie (Dz. U. poz. 1225), które weszło w życie z dniem 18 października 2013 r.
Załącznik do rozporządzenia Ministra Zdrowia
z dnia 11 czerwca 2012 r.
WYMAGANIA DLA ZAMKNIĘĆ UTRUDNIAJĄCYCH OTWARCIE PRZEZ DZIECI W OPAKOWANIACH BEZ ZAMKNIĘĆ WIELOKROTNEGO ZAMYKANIA
1. Ilekroć w niniejszych wymaganiach jest mowa o:
1) opakowaniu zabezpieczonym przed niepożądanym otwarciem przez dzieci – należy przez to rozumieć opakowanie trudne do otwarcia, lub w którym utrudniony jest dostęp do jego zawartości, przez dzieci, lecz niesprawiające trudności osobom dorosłym, przeznaczone do właściwego stosowania;
2) opakowaniu nieprzystosowanym do powtórnego zamknięcia zabezpieczonym przed niepożądanym otwarciem przez dzieci – należy przez to rozumieć opakowanie lub część opakowania, zabezpieczone przed niepożądanym otwarciem przez dzieci, które nie może być ponownie prawidłowo zamknięte;
3) produkcie zastępczym – należy przez to rozumieć obojętny materiał podobny do produktu, który zastępuje, w szczególności taki jak proszek, tabletki lub ciecz (woda niezabarwiona);
4) dawce jednostkowej – należy przez to rozumieć małą ilość produktu przeznaczoną do pobrania w całości z opakowania, w którym bezpośrednio się znajduje;
5) opakowaniu jednorazowego zamykania – należy przez to rozumieć opakowanie zawierające jedną lub wiele pojedynczych dawek jednostkowych, osobno zabezpieczonych i osobno opakowanych w celu jednorazowego użycia.
2. Badanie jest wykonywane w dwóch etapach:
1) badanie z udziałem dorosłych, które jest fakultatywne z wyjątkiem sytuacji, w których w punkcie sprzedaży pojemnik został wyposażony w narzędzie służące do jego otwarcia;
2) badanie z udziałem dzieci.
3. W celu ograniczenia udziału dzieci w zbędnych badaniach badanie z udziałem dorosłych jest wykonywane przed badaniami z udziałem dzieci.
4. Do badania opakowania należy dostarczyć dostateczną liczbę opakowań, aby osoba nadzorująca badanie mogła wybrać reprezentatywną próbę przeznaczoną do badania oraz zapewnić ich grupę rezerwową do celów porównawczych. Do napełniania opakowań stosowanych w badaniu nie może być użyty produkt niebezpieczny. W tym celu należy użyć odpowiedniego produktu zastępczego. Materiał i konstrukcja prób przeznaczonych do badania muszą spełniać wymagania techniczne oraz muszą być reprezentatywne w stosunku do przeciętnej partii oryginalnych opakowań.
5. Opakowania do badań z udziałem dzieci nie mogą mieć napisów.
6. W każdym badaniu dostarcza się nowe opakowanie każdemu członkowi grupy.
7. Przed rozpoczęciem badania sprawdza się każde opakowanie, które ma być użyte w badaniu, pod kątem jego kompletności. Opakowania są pokazywane dzieciom bez zewnętrznej warstwy opakowania jednostkowego; dzieciom umożliwia się dostęp do poszczególnych dawek jednostkowych.
8. Grupa badawcza składa się maksymalnie z 200 dzieci w wieku od 42. do 51. miesiąca życia. W miarę możliwości w grupie należy uwzględnić proporcjonalny podział ze względu na wiek, płeć oraz dobierać dzieci w taki sposób, aby ich grupa była reprezentatywna pod względem pochodzenia społecznego, etnicznego i kulturowego w stosunku do całego społeczeństwa oraz nie ograniczała się wyłącznie do dzieci z najbliższego obszaru, w którym przeprowadzane jest badanie. Dzieci należy dobierać losowo; żadne z nich nie powinno mieć widocznych niepełnosprawności fizycznych lub umysłowych, mogących wpływać na ich sprawność manualną.
9. W czasie jednego badania dziecko nie powinno testować więcej niż jednego opakowania, nawet jeżeli ma ono inną konstrukcję. Jeżeli dziecko bierze udział w więcej niż jednym badaniu, to przerwa między badaniami musi wynosić co najmniej 4 tygodnie.
10. Udział dziecka w grupie badawczej jest możliwy po wyrażeniu zgody przez rodzica lub opiekuna.
11. Wyklucza się z badań dziecko, które uległo wcześniej zatruciu.
12. Badanie przeprowadza się w obecności osoby nadzorującej badanie.
13. Badanie z udziałem dzieci odbywa się w otoczeniu, które jest im dobrze znane.
14. Personel badawczy odwiedza miejsce badania przed jego przeprowadzeniem i zapoznaje się z dziećmi w celu zdobycia ich zaufania. Podczas badania obecne są tylko osoby, które nadzorują dzieci; nie biorą w nim udziału rodzice lub opiekunowie.
15. Osoba nadzorująca badanie:
1) formułuje prośbę otwarcia opakowania w sposób zachęcający dzieci do wykonania zadania;
2) nie może przekazywać żadnych instrukcji dotyczących otwarcia opakowania, z wyjątkiem wizualnej prezentacji przedstawionej podczas pokazu, o którym mowa w ust. 19;
3) nie może stwarzać napięcia ani rozpraszać dzieci;
4) powtarza prośbę otwarcia opakowania, jeżeli dzieci przestają interesować się przedmiotem badań;
5) może stać w pewnej odległości od dzieci, jeżeli stosowane są inne metody obserwacji;
6) zachęca dzieci do uzyskania dostępu do zawartości dowolnymi sposobami, nie wymieniając żadnej konkretnej metody;
7) ostrzega dzieci po zakończeniu każdego badania, aby nie bawiły się opakowaniami tego typu lub nie próbowały ich otwierać.
16. Badanie wykonuje się za pomocą metody sekwencyjnej; liczba dzieci uczestniczących w badaniu zależy od uzyskiwanych wyników. Podczas badania należy przestrzegać ograniczeń dotyczących wieku i płci.
17. Do badania dzieci łączy się w pary, z których każda kontrolowana jest przez jedną osobę nadzorującą badanie. W przypadku oddalenia się dziecka podczas badania, osoba nadzorująca badanie odprowadza dziecko z powrotem na jego miejsce i prosi o kontynuowanie badania, nie udzielając dziecku żadnych dodatkowych wskazówek dotyczących otwarcia opakowania; taki przypadek opisuje się w sprawozdaniu.
18. Badanie można przeprowadzić z udziałem maksymalnie pięciu par w tym samym pomieszczeniu i w tym samym czasie. Podczas badania należy zapewnić, aby dzieci nie przeszkadzały sobie nawzajem. Dzieci mogą przyjmować dowolną, wygodną dla siebie pozycję lub postawę. Podczas badania dzieci powinny być możliwie jak najdalej od wszelkich czynników zewnętrznych rozpraszających uwagę.
19. Każde dziecko otrzymuje dostateczną liczbę opakowań z prośbą, aby otworzyło je w dowolny sposób. Czas na otwarcie wynosi 10 minut. Nie należy podejmować żadnych prób powstrzymania dziecka od korzystania z zębów lub zastosowania jakiegokolwiek sposobu otwarcia opakowania. Dziecku nie udostępnia się żadnych narzędzi ani środków, z których mogłoby skorzystać, z wyjątkiem sytuacji, gdy takie narzędzia lub środki są dostarczane przez producenta, podmiot napełniający opakowanie lub podmiot je opakowujący w punkcie sprzedaży.
Dzieci, którym w ciągu pierwszych 5 minut badania nie udało się otworzyć opakowania lub uzyskać dostępu do co najmniej 1 dawki jednostkowej, obserwują jednorazowy pokaz przedstawiający sposób otwierania opakowania prezentowany przez osobę nadzorującą badanie, po którym mają następne 5 minut na otwarcie opakowania lub uzyskanie dostępu do jego zawartości. Podczas pokazu osoba nadzorująca badanie nie może udzielać żadnych wyjaśnień ani kłaść nacisku na żadną z czynności związanych z otwarciem opakowania.
20. W przypadku gdy do otwarcia opakowania wymagane są narzędzia, ale nie zostały one dostarczone przez producenta, badanie ogranicza się do pierwszej części okresu badania trwającej 5 minut bez przeprowadzania pokazu.
21. W przypadku opuszczenia przez dziecko miejsca badania w czasie jego trwania lub odmowy uczestniczenia w badaniu mimo namowy osoby nadzorującej badanie, wyniku badania z udziałem tego dziecka nie uwzględnia się; taki przypadek odnotowuje się w sprawozdaniu.
22. W przypadku badań z udziałem dzieci wynik danego badania dotyczącego opakowania jednorazowego użytku jest uznawany za negatywny, jeżeli dziecku uda się uzyskać dostęp do jednej lub więcej dawek jednostkowych znajdujących się w tym opakowaniu.
23. Wynik otrzymany w ramach każdego badania z udziałem dzieci zaznacza się na wykresach wyników badań przedstawionych na wykresach B.1 i B.2 oraz ocenia zgodnie z niniejszymi wymaganiami.
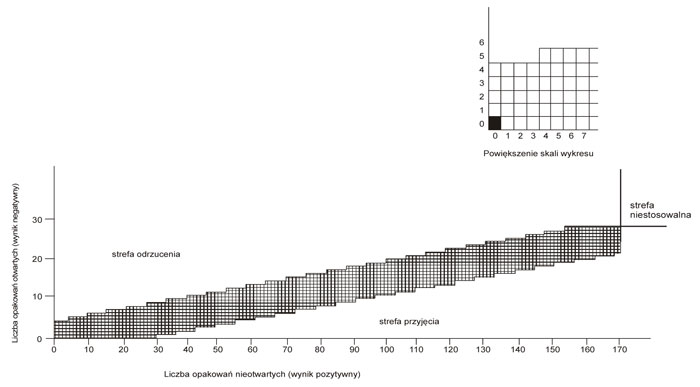
Wykres B.1 – Wykres wyników badania metodą sekwencyjną, przeprowadzonego z udziałem dzieci (po 5 minutach trwania badania, przed pokazem)
Wykres B.2 – Wykres wyników badania metodą sekwencyjną, przeprowadzonego z udziałem dzieci (pełny okres badania)
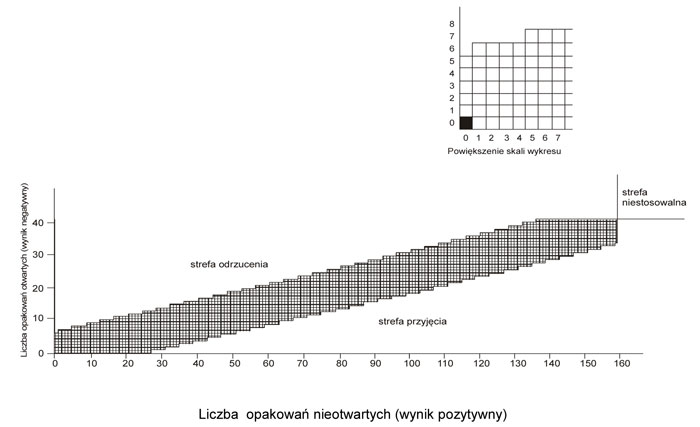
24. Wynik każdego badania zaznacza się na wykresach B.1 lub B.2 w następujący sposób:
1) wypełnia się kwadrat znajdujący się bezpośrednio na prawo od poprzedniego wyniku na wykresie B.1, jeżeli dziecku nie udało się otworzyć opakowania lub uzyskać dostępu do jego zawartości w ciągu pierwszych 5 minut, a na wykresie B.2, jeżeli dziecku nie udało się otworzyć opakowania lub uzyskać dostępu do jego zawartości w ciągu pełnego okresu badania;
2) wypełnia się kwadrat znajdujący się bezpośrednio nad poprzednim wynikiem, zaznaczonym na wykresach B.1 i B.2, jeżeli dziecku udało się otworzyć opakowanie lub uzyskać dostęp do jego zawartości w ciągu pierwszych 5 minut, a tylko na wykresie B.2, jeżeli dziecku udało się otworzyć opakowanie lub uzyskać dostęp do jego zawartości w ciągu następnych 5 minut;
3) w przypadku nanoszenia pierwszego wyniku zaciemniony kwadrat uważa się za „wynik poprzedni”.
25. Jeżeli ciąg wypełnionych kwadratów na wykresach B.1 lub B.2 przechodzi do strefy odrzucenia lub do strefy przyjęcia, badanie należy przerwać i zapisać wynik końcowy w następujący sposób:
1) w przypadku ciągu przechodzącego do strefy przyjęcia – „opakowanie uznane za zabezpieczone przed niepożądanym otwarciem przez dzieci”;
2) w przypadku ciągu przechodzącego do strefy odrzucenia – „opakowanie nieuznane za zabezpieczone przed niepożądanym otwarciem przez dzieci”.
26. Przydatność metody oceny wyników badań charakteryzuje się współrzędnymi dwóch punktów krzywej granicznej: punktu ryzyka producenta i punktu ryzyka odbiorcy. Stosuje się następujące metody oceny wyników badań z udziałem dzieci1):
1) wykres B.1:
a) akceptowany poziom jakości α = 5% (AQL) = 10%,
b) graniczny poziom jakości β = 5% (LQ) = 20%;
2) wykres B.2:
a) akceptowany poziom jakości α = 5% (AQL) = 15%,
b) graniczny poziom jakości β = 5% (LQ) = 25%.
27. Jeżeli w badaniu opakowania uczestniczyła grupa 200 dzieci, opakowanie jest uznane za zabezpieczone przed niepożądanym otwarciem przez dzieci, jeżeli są spełnione następujące wymagania:
1) co najmniej 85% dzieci z grupy badawczej nie jest w stanie uzyskać dostępu do jednej lub więcej dawek jednostkowych w ciągu 5 minut bez pokazu;
2) co najmniej 80% dzieci z grupy badawczej nie jest w stanie uzyskać dostępu do jednej lub więcej dawek jednostkowych w ciągu pełnego okresu badania.
28. Uczestnicy biorący udział w badaniu z udziałem dorosłych muszą zostać wybrani przy użyciu metody przesiewowej, w ramach której kandydatom należy zadać następujące pytanie: „Czy jest Pan/Pani osobą zawodowo związaną z projektowaniem, produkcją lub stosowaniem opakowań zabezpieczonych przed niepożądanym otwarciem przez dziecko?”. Do udziału w badaniu wybiera się wyłącznie te osoby, które udzielą odpowiedzi przeczącej.
29. W celu uzyskania informacji, o której mowa w ust. 28, i jednocześnie ustalenia, czy dana osoba potrafi czytać, niniejsze pytanie powinno być napisane na maszynie lub wydrukowane na formularzu, który należy przekazać kandydatowi z prośbą o jego przeczytanie.
30. Osoby dorosłe z widoczną niepełnosprawnością mogącą wpływać na ich sprawność manualną nie mogą uczestniczyć w badaniu. W badaniu nie mogą również uczestniczyć osoby, które nie są w stanie zrozumieć pisemnych instrukcji otwarcia.
31. Losowo wybiera się 100 uczestników w wieku od 50. do 70. roku życia zgodnie z następującymi kryteriami: Skład grupy badawczej uczestniczącej w badaniu z udziałem dorosłych
|
| Zakres wiekowy w latach | Liczba mężczyzn uczestniczących w badaniu | Liczba kobiet uczestniczących w badaniu | Liczba wszystkich uczestników badania |
| 50 do 54 | 8 lub 7 | 17 lub 18 | 25 | |
| 55 do 59 | 7 lub 8 | 18 lub 17 | 25 | |
| 60 do 70 | 15 | 35 | 50 | |
| Razem | – | 30 | 70 | 100 |
Z jednego obszaru można wybrać nie więcej niż 30 dorosłych.
W jednym miejscu przeprowadza się badanie nie więcej niż 30 dorosłych.
Osoba nadzorująca badanie może przeprowadzić badania maksymalnie 35 dorosłych.
32. Badanie z udziałem dorosłych może być przeprowadzone w dowolnym miejscu lub czasie.
33. Podczas badania, poza uczestnikami badania, obecna jest tylko osoba nadzorująca badanie.
34. Każdy uczestnik badania otrzymuje opakowanie z całym wyposażeniem dodatkowym służącym do jego otwarcia dostarczanym w punkcie sprzedaży oraz pisemnymi instrukcjami, jak prawidłowo opakowanie otwierać, jeżeli takie instrukcje są dostarczane wraz z opakowaniem.
35. Instrukcje mogą być dostarczane wraz z opakowaniem lub znajdować się na opakowaniu przeznaczonym do użytku przez konsumenta.
36. Osoba nadzorująca badanie nie przeprowadza pokazu otwarcia opakowania, wyjaśnia wyłącznie cel badania. Uczestnicy badania mają 5 minut na zapoznanie się z badanym opakowaniem – w tym czasie czytają instrukcje, a następnie próbują prawidłowo otworzyć opakowanie. Uczestnicy badania nie mogą konsultować się z osobą nadzorującą badanie ani z pozostałymi uczestnikami badania.
37. Uczestnicy badania, którym uda się otworzyć badane opakowanie w ciągu 5 minut, otrzymują identyczne nowe opakowanie i są proszeni o jego otwarcie w jak najkrótszym czasie. Na otwarcie nowego opakowania uczestnicy badania mają 1 minutę.
Jeżeli badanie przeprowadzono zgodnie z niniejszymi wymaganiami, wynik uczestnika badania, któremu w czasie 1 minuty, przeznaczonym na otwarcie nowego opakowania, nie udało się uzyskać dostępu do co najmniej jednej dawki jednostkowej, jest uznawany za negatywny. Jeżeli w badaniu z udziałem dorosłych przeprowadzonym zgodnie z niniejszymi wymaganiami co najmniej 90% dorosłych uzyska w czasie 1 minuty, przeznaczonym na otwarcie nowego opakowania, dostęp do co najmniej 1 dawki jednostkowej, wynik dotyczący tej części badania jest uznawany za pozytywny.
38.5) Jeżeli w badaniu trwającym 5 minut dany uczestnik badania nie jest w stanie otworzyć badanego opakowania, zostaje on poproszony o otwarcie i zamknięcie dwóch konwencjonalnych zamknięć niezabezpieczonych przed niepożądanym otwarciem przez dzieci:
1) zamknięcia zakręcanego o średnicy 28 mm stosowanego przy momencie obrotowym wynoszącym 1,1 Nm na cylindrycznym plastikowym pojemniku o pojemności od 25 ml do 50 ml;
2) zamknięcia typu „push-off” o średnicy 28 mm stosowanego na okrągłym plastikowym pojemniku o pojemności od 25 ml do 50 ml.
Na otwarcie i ponowne zamknięcie każdego z opakowań uczestnik ma 1 minutę.
Wyniki uczestników badania, którzy:
1) nie są w stanie otworzyć opakowań – nie są uwzględniane w całkowitym wyniku badania;
2) są w stanie otworzyć opakowania – są uznawane w całkowitym wyniku badania za negatywne.
1) Przedstawione wartości są dostatecznie dokładne do scharakteryzowania przyjętej metody oceny wyników badań, niemniej jednak są niewystarczające do wyliczenia nowego zestawu danych przyjęcia i odrzucenia. Niniejsze dane przedstawione na wykresach i w tabelach uwzględniają również inne kryteria i w praktyce można je uznać za standardowe.
- Data ogłoszenia: 2014-11-17
- Data wejścia w życie: 2014-11-17
- Data obowiązywania: 2014-11-17
- Dokument traci ważność: 2020-08-19
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
