REKLAMA
Dziennik Ustaw - rok 2012 poz. 491
ROZPORZĄDZENIE
MINISTRA ZDROWIA1)
z dnia 2 maja 2012 r.
w sprawie wzorów dokumentów przedkładanych w związku z badaniem klinicznym produktu leczniczego oraz w sprawie wysokości i sposobu uiszczania opłat za złożenie wniosku o rozpoczęcie badania klinicznego
Na podstawie art. 37w ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne (Dz. U. z 2008 r. Nr 45, poz. 271, z późn. zm.2)) zarządza się, co następuje:
1) wzór wniosku do komisji bioetycznej o wydanie opinii o badaniu klinicznym produktu leczniczego i do Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, zwanego dalej „Prezesem Urzędu”, o rozpoczęcie badania klinicznego produktu leczniczego;
2) dokumentację, którą należy dołączyć do wniosku do komisji bioetycznej o wydanie opinii o badaniu klinicznym produktu leczniczego;
3) dokumentację, którą należy dołączyć do wniosku do Prezesa Urzędu o rozpoczęcie badania klinicznego produktu leczniczego;
4) wzór wniosku do komisji bioetycznej o wydanie opinii i do Prezesa Urzędu o wyrażenie zgody w zakresie istotnych i mających wpływ na bezpieczeństwo uczestników badania klinicznego zmian w protokole badania klinicznego lub dokumentacji dotyczącej badanego produktu leczniczego będącej podstawą uzyskania pozwolenia na prowadzenie badania klinicznego;
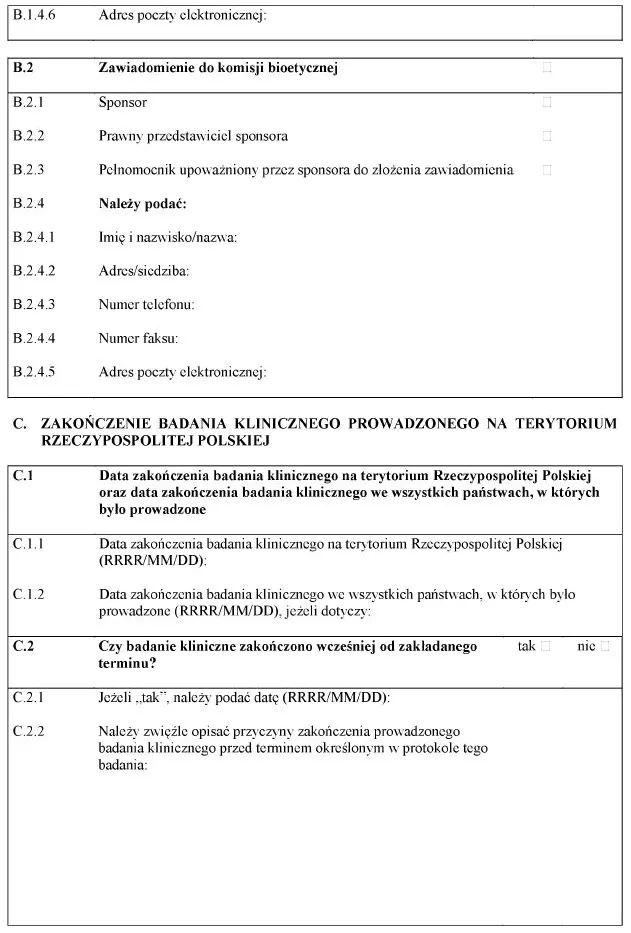
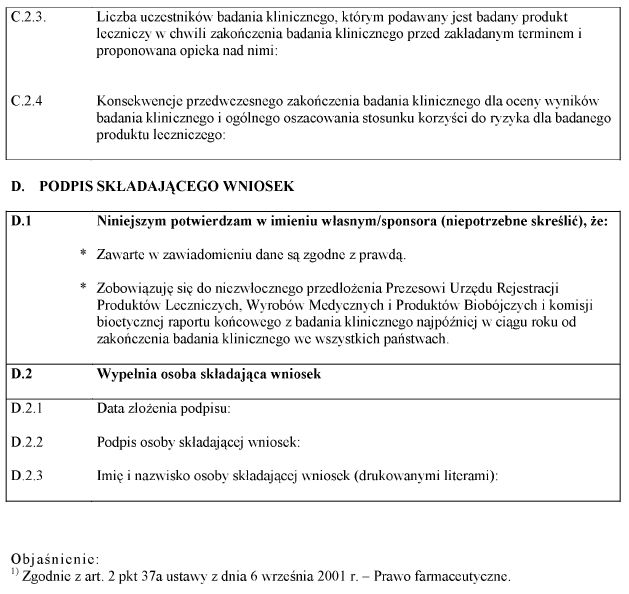
5) wzór zawiadomienia do komisji bioetycznej i do Prezesa Urzędu o zakończeniu badania klinicznego produktu leczniczego prowadzonego na terytorium Rzeczypospolitej Polskiej;
6) wysokość i sposób uiszczania opłat za złożenie wniosku o rozpoczęcie badania klinicznego produktu leczniczego.
1) państwie członkowskim – rozumie się przez to państwo członkowskie Unii Europejskiej lub państwo członkowskie Europejskiego Porozumienia o Wolnym Handlu (EFTA) – stronę umowy o Europejskim Obszarze Gospodarczym;
2) państwie członkowskim ICH – rozumie się przez to państwo członkowskie, Stany Zjednoczone Ameryki i Japonię.
2. Do wniosku o wydanie opinii o badaniu klinicznym przez komisję bioetyczną dołącza się:
1) list przewodni;
2) kopię protokołu badania klinicznego zatwierdzonego przez sponsora;
3) kopię zmian protokołu badania klinicznego, zatwierdzonych przez sponsora, jeżeli dotyczy i jeżeli nie są zawarte w protokole badania klinicznego;
4) streszczenie protokołu badania klinicznego;
5) kopię broszury badacza w przypadku badanych produktów leczniczych niedopuszczonych do obrotu na terytorium żadnego z państw członkowskich ICH;
6) pełnomocnictwo udzielone przez sponsora dla podmiotu składającego wniosek do działania w imieniu sponsora wraz z tłumaczeniem sporządzonym przez tłumacza przysięgłego, jeżeli dotyczy;
7) kopię umowy dotyczącej przekazania niektórych lub wszystkich obowiązków lub czynności sponsora osobie lub jednostce organizacyjnej prowadzącej badanie kliniczne na zlecenie wraz z tłumaczeniem sporządzonym przez tłumacza przysięgłego, jeżeli dotyczy;
8) wzór formularza świadomej zgody;
9) wzór formularza zgody na przetwarzanie danych osobowych uczestnika badania klinicznego związanych z jego udziałem w badaniu klinicznym;
10) wzór pisemnej informacji dla pacjenta;
11) wzór karty obserwacji klinicznej;
12) podpisany i opatrzony datą życiorys badacza wraz z opisem jego działalności naukowej i zawodowej;
13) oświadczenie sponsora albo podmiotu, o którym mowa w pkt 7, albo badacza dotyczące zasad rekrutacji uczestników badania klinicznego, o ile nie zostało zawarte w protokole badania klinicznego;
14) wzór ogłoszenia rekrutacyjnego dla pacjentów;
15) oświadczenie badacza dotyczące wyposażenia ośrodka badawczego w zakresie niezbędnym do przeprowadzenia badania oraz informację dotyczącą kwalifikacji personelu, który będzie uczestniczył w prowadzeniu badania klinicznego;
16) informację o rekompensacie, o której mowa w art. 37e ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne, jeżeli nie została zawarta w pisemnej informacji dla pacjenta;
17) informację o wysokości odszkodowania lub rekompensaty przewidzianych w przypadku ewentualnego uszkodzenia ciała lub zgonu spowodowanego uczestnictwem w badaniu klinicznym;
18) kopię dokumentu potwierdzającego zawarcie umowy obowiązkowego ubezpieczenia odpowiedzialności cywilnej sponsora i badacza, obejmującej cały okres trwania badania klinicznego, za szkody wyrządzone w związku z prowadzeniem badania klinicznego;
19) kopie umów dotyczących prowadzenia badania klinicznego zawartych pomiędzy sponsorem lub podmiotem, o którym mowa w pkt 7, a badaczem oraz kopie umów zawartych pomiędzy sponsorem lub podmiotem, o którym mowa w pkt 7, a ośrodkami badawczymi, potwierdzonych za zgodność z oryginałem przez sponsora albo podmiot, o którym mowa w pkt 7;
20) informację o wysokości wynagrodzenia prowadzących badanie kliniczne, jeżeli nie została zawarta w umowie między sponsorem i prowadzącym badanie kliniczne;
21) informację o gratyfikacjach finansowych, o których mowa w art. 37e ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne.
3. Do wniosku do Prezesa Urzędu o rozpoczęcie badania klinicznego dołącza się:
1) wydruk potwierdzenia nadania numeru EudraCT;
2) list przewodni;
3) wniosek w języku angielskim na informatycznym nośniku danych, jako dokument elektroniczny w formacie xml do bazy EudraCT, zgodnie z wzorem opublikowanym na stronie internetowej Europejskiej Agencji Leków, przygotowanym na podstawie dyrektywy 2001/20/WE Parlamentu Europejskiego i Rady z dnia 4 kwietnia 2001 r. w sprawie zbliżania przepisów ustawowych, wykonawczych i administracyjnych Państw Członkowskich, odnoszących się do wdrożenia zasady dobrej praktyki klinicznej w prowadzeniu badań klinicznych produktów leczniczych, przeznaczonych do stosowania przez człowieka (Dz. Urz. WE L 121 z 01.05.2001, str. 34, z późn. zm.; Dz. Urz. UE Polskie wydanie specjalne, rozdz. 13, t. 26, str. 299);
4) kopię broszury badacza w przypadku badanych produktów leczniczych niedopuszczonych do obrotu na terytorium żadnego z państw członkowskich ICH;
5) kopię dokumentacji badanego produktu leczniczego (IMPD) obejmującej dokumentację naukową zawierającą informacje dotyczące jakości, wytwarzania i kontroli badanego produktu leczniczego, wyniki badań klinicznych i przedklinicznych produktu, poprzedzone szczegółowym spisem treści i słownikiem użytych terminów;
6) kopię uproszczonej dokumentacji badanego produktu leczniczego (sIMPD) obejmującą:
a) Charakterystykę Produktu Leczniczego, a w przypadku Stanów Zjednoczonych Ameryki oraz Japonii jej odpowiednik – jeżeli badany produkt leczniczy został dopuszczony do obrotu na terytorium przynajmniej jednego z państw członkowskich ICH i jest stosowany w badaniu klinicznym, zgodnie z Charakterystyką Produktu Leczniczego bądź jej odpowiednikiem oraz dodatkowo wyniki badań klinicznych i przedklinicznych przeprowadzonych z użyciem badanego produktu leczniczego w przypadku, gdy badany produkt leczniczy jest stosowany poza wskazaniem zawartym w Charakterystyce Produktu Leczniczego bądź jej odpowiedniku,
b) wyniki badań klinicznych i przedklinicznych, informacje dotyczące jakości badanego produktu leczniczego oraz Charakterystykę Produktu Leczniczego, a w przypadku Stanów Zjednoczonych Ameryki oraz Japonii jej odpowiednik – jeżeli badany produkt leczniczy został dopuszczonych do obrotu na terytorium przynajmniej jednego z państw członkowskich ICH w innej postaci lub mocy,
c) wyniki badań klinicznych i przedklinicznych oraz informacje dotyczące jakości badanego produktu leczniczego – w przypadku badanych produktów leczniczych niedopuszczonych do obrotu na terytorium żadnego z państw członkowskich ICH, których wszystkie substancje czynne wchodzą w skład produktów leczniczych dopuszczonych do obrotu na terytorium przynajmniej jednego z państw członkowskich ICH oraz dodatkowo dane na temat substancji czynnych, jeżeli substancje te pochodzą od innego wytwórcy,
d) nowe wyniki badań klinicznych i przedklinicznych oraz informacje dotyczące jakości badanego produktu leczniczego uzyskane od czasu złożenia poprzedniego wniosku lub tylko informację o numerze EudraCT badania objętego poprzednim wnioskiem, jeżeli takich wyników i informacji nie uzyskano – w przypadku badanego produktu leczniczego objętego innym wnioskiem o rozpoczęcie badania klinicznego,
e) informacje dotyczące jakości badanego produktu leczniczego, którym jest placebo – w przypadku gdy placebo nie mając substancji czynnej, nie ma również takiego samego składu co badany produkt leczniczy i jest wytwarzane przez innego wytwórcę oraz jest jałowe;
7) pełnomocnictwo udzielone przez sponsora dla podmiotu składającego wniosek do działania w imieniu sponsora wraz z tłumaczeniem sporządzonym przez tłumacza przysięgłego, jeżeli dotyczy;
8) wzór karty obserwacji klinicznej;
9) wzór formularza świadomej zgody;
10) wzór formularza zgody na przetwarzanie danych osobowych uczestnika badania klinicznego związanych z jego udziałem w badaniu klinicznym;
11) wzór informacji dla pacjenta;
12) kopię protokołu badania klinicznego zatwierdzonego przez sponsora;
13) kopię zmian protokołu badania klinicznego, zatwierdzonych przez sponsora, jeżeli nie zostały zawarte w protokole badania klinicznego;
14) kopię specjalistycznej recenzji badania klinicznego, jeżeli była wydana;
15) kopię świadectwa analizy badanego produktu leczniczego, jeżeli obecność zanieczyszczeń jest niezgodna ze specyfikacją lub jeżeli zostały wykryte zanieczyszczenia niespodziewane nieujęte w specyfikacji;
16) kopię zezwolenia na wytwarzanie, jeżeli badany produkt leczniczy jest wytwarzany na terytorium państwa członkowskiego, a nie zostało wydane pozwolenie na dopuszczenie do obrotu;
17) kopię zezwolenia na import badanego produktu leczniczego, jeżeli badany produkt leczniczy nie jest wytwarzany na terytorium państw członkowskich;
18) kopię oświadczenia osoby wykwalifikowanej zwalniającej serię badanych produktów leczniczych importowanych spoza terytorium państw członkowskich;
19) kopie decyzji administracyjnych dotyczących użycia lub wprowadzenia do środowiska badanych produktów leczniczych, które muszą spełniać dodatkowe warunki wymagane prawem, w szczególności decyzji dotyczących pozwolenia na pobieranie, przetwarzanie, transport i przeszczepianie komórek i tkanek oraz organizmów zmodyfikowanych genetycznie i produktów radiofarmaceutycznych;
20) wyniki badań bezpieczeństwa wirusologicznego, jeżeli dotyczy;
21) kopię oświadczenia sponsora o spełnianiu wymogów bezpieczeństwa do celów oceny ryzyka przenoszenia gąbczastej encefalopatii, jeżeli dotyczy;
22) podpisany i opatrzony datą życiorys badacza wraz z opisem jego działalności naukowej i zawodowej;
23) dokument potwierdzający zawarcie umowy obowiązkowego ubezpieczenia odpowiedzialności cywilnej sponsora i badacza, obejmującej cały okres trwania badania klinicznego, za szkody wyrządzone w związku z prowadzeniem badania klinicznego;
24) umowę dotyczącą przekazania niektórych lub wszystkich obowiązków lub czynności sponsora osobie lub jednostce organizacyjnej prowadzącej badanie kliniczne na zlecenie wraz z tłumaczeniem sporządzonym przez tłumacza przysięgłego, jeżeli dotyczy;
25) dokument upoważniający prawnego przedstawiciela sponsora do działania na terytorium państw członkowskich w imieniu sponsora spoza terytorium państw członkowskich wraz z tłumaczeniem sporządzonym przez tłumacza przysięgłego, jeżeli dotyczy;
26) wykaz aktualnie prowadzonych przez sponsora badań klinicznych z wykorzystaniem badanego produktu leczniczego;
27) wzór oznakowania badanego produktu leczniczego;
28) kopię opinii komisji bioetycznej, jeżeli została wydana;
29) umowy dotyczące prowadzenia badania klinicznego zawarte pomiędzy sponsorem lub podmiotem, o którym mowa w pkt 24, a badaczem oraz umowy zawarte pomiędzy sponsorem lub podmiotem, o którym mowa w pkt 24, a ośrodkami badawczymi,
30) potwierdzenie uiszczenia opłaty za złożenie wniosku;
31) oświadczenie sponsora, o którym mowa w art. 37ia ust. 3 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne, w przypadku składania wniosku o rozpoczęcie badania klinicznego niekomercyjnego.
2. Wniosek, o którym mowa w ust. 1, jest składany do Prezesa Urzędu również w języku angielskim na informatycznym nośniku danych, jako dokument elektroniczny w formacie doc do bazy EudraCT, zgodnie z wzorem opublikowanym na stronie internetowej Europejskiej Agencji Leków przygotowanym na podstawie dyrektywy 2001/20/WE Parlamentu Europejskiego i Rady z dnia 4 kwietnia 2001 r. w sprawie zbliżania przepisów ustawowych, wykonawczych i administracyjnych Państw Członkowskich, odnoszących się do wdrożenia zasady dobrej praktyki klinicznej w prowadzeniu badań klinicznych produktów leczniczych, przeznaczonych do stosowania przez człowieka.
2. Zawiadomienie, o którym mowa w ust. 1, składa się również w języku angielskim na informatycznym nośniku danych, jako dokument elektroniczny w formacie doc do bazy EudraCT, zgodnie z wzorem opublikowanym na stronie internetowej Europejskiej Agencji Leków przygotowanym na podstawie dyrektywy 2001/20/WE Parlamentu Europejskiego i Rady z dnia 4 kwietnia 2001 r. w sprawie zbliżania przepisów ustawowych, wykonawczych i administracyjnych Państw Członkowskich, odnoszących się do wdrożenia zasady dobrej praktyki klinicznej w prowadzeniu badań klinicznych produktów leczniczych, przeznaczonych do stosowania przez człowieka.
2. Opłaty za złożenie wniosku, o których mowa w ust. 1, uiszcza się na rachunek Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych gotówką, przelewem lub przekazem pocztowym.
3. Opłaty należne z różnych tytułów uiszcza się oddzielnie.
Minister Zdrowia: B.A. Arłukowicz
|
|
1) Minister Zdrowia kieruje działem administracji rządowej – zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 18 listopada 2011 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. Nr 248, poz. 1495 i Nr 284, poz. 1672).
2) Zmiany tekstu jednolitego wymienionej ustawy zostały ogłoszone w Dz. U. z 2008 r. Nr 227, poz. 1505 i Nr 234, poz. 1570, z 2009 r. Nr 18, poz. 97, Nr 31, poz. 206, Nr 92, poz. 753, Nr 95, poz. 788 i Nr 98, poz. 817, z 2010 r. Nr 78, poz. 513 i Nr 107, poz. 679 oraz z 2011 r. Nr 63, poz. 322, Nr 82, poz. 451, Nr 106, poz. 622, Nr 112, poz. 654, Nr 113, poz. 657 i Nr 122, poz. 696.
3) Niniejsze rozporządzenie było poprzedzone rozporządzeniem Ministra Zdrowia z dnia 4 listopada 2008 r. w sprawie wzorów dokumentów przedkładanych w związku z badaniem klinicznym produktu leczniczego oraz w sprawie wysokości i sposobu uiszczania opłat za rozpoczęcie badania klinicznego (Dz. U. Nr 201, poz. 1247), które utraciło moc z dniem 2 maja 2012 r. na podstawie art. 23 ustawy z dnia 18 marca 2011 r. o Urzędzie Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (Dz. U. Nr 82, poz. 451 oraz z 2012 r. poz. 95).
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 2 maja 2012 r. (poz. 491)
Załącznik nr 1
WZÓR – WNIOSEK DO PREZESA URZĘDU REJESTRACJI PRODUKTÓW LECZNICZYCH, WYROBÓW MEDYCZNYCH I PRODUKTÓW BIOBÓJCZYCH O ROZPOCZĘCIE BADANIA KLINICZNEGO PRODUKTU LECZNICZEGO / DO KOMISJI BIOETYCZNEJ O WYDANIE OPINII O BADANIU KLINICZNYM PRODUKTU LECZNICZEGO
Załącznik nr 2
WZÓR – WNIOSEK DO KOMISJI BIOETYCZNEJ O WYDANIE OPINII I DO PREZESA URZĘDU REJESTRACJI PRODUKTÓW LECZNICZYCH, WYROBÓW MEDYCZNYCH I PRODUKTÓW BIOBÓJCZYCH O WYRAŻENIE ZGODY W ZAKRESIE ISTOTNYCH I MAJĄCYCH WPŁYW NA BEZPIECZEŃSTWO UCZESTNIKÓW BADANIA KLINICZNEGO ZMIAN W PROTOKOLE BADANIA KLINICZNEGO LUB DOKUMENTACJI DOTYCZĄCEJ BADANEGO PRODUKTU LECZNICZEGO BĘDĄCEJ PODSTAWĄ UZYSKANIA POZWOLENIA NA PROWADZENIE BADANIA KLINICZNEGO








Załącznik nr 3
WZÓR – ZAWIADOMIENIE DO KOMISJI BIOETYCZNEJI DO PREZESA URZĘDU REJESTRACJI PRODUKTÓW LECZNICZYCH, WYROBÓW MEDYCZNYCH I PRODUKTÓW BIOBÓJCZYCH O ZAKOŃCZENIU BADANIA KLINICZNEGO PRODUKTU LECZNICZEGO PROWADZONEGO NA TERYTORIUM RZECZYPOSPOLITEJ POLSKIEJ

Załącznik nr 4
WYSOKOŚĆ OPŁAT ZA ZŁOŻENIE WNIOSKU DO PREZESA URZĘDU REJESTRACJI PRODUKTÓW LECZNICZYCH, WYROBÓW MEDYCZNYCH I PRODUKTÓW BIOBÓJCZYCH O ROZPOCZĘCIE BADANIA KLINICZNEGO PRODUKTU LECZNICZEGO
| Wyszczególnienie | Wysokość opłaty |
| Badanie fazy I–III | 8 000 zł |
| Badanie biorównoważności | 7 000 zł |
| Badanie fazy IV | 4 000 zł |
| Badanie niekomercyjne | 2 000 zł |
- Data ogłoszenia: 2012-05-09
- Data wejścia w życie: 2012-05-09
- Data obowiązywania: 2012-05-09
- Dokument traci ważność: 2018-10-18
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
