REKLAMA
Dziennik Ustaw - rok 2008 nr 101 poz. 650
ROZPORZĄDZENIE MINISTRA ZDROWIA1)
z dnia 28 maja 2008 r.
w sprawie wzoru wniosku o wydanie wpisu do rejestru, pozwolenia albo pozwolenia tymczasowego, sposobu przedstawienia dokumentacji oraz wymagań, jakim powinna odpowiadać dokumentacja niezbędna do oceny substancji czynnej i produktu biobójczego2)
Na podstawie art. 8a ust. 1 ustawy z dnia 13 września 2002 r. o produktach biobójczych (Dz. U. z 2007 r. Nr 39, poz. 252) zarządza się, co następuje:
1) wzór wniosku o wydanie decyzji o wpisie do rejestru produktów biobójczych niskiego ryzyka, zwanej dalej „wpisem do rejestru”, pozwolenia na wprowadzanie do obrotu, zwanego dalej „pozwoleniem”, albo pozwolenia tymczasowego;
2) sposób przedstawienia dokumentacji, o której mowa w art. 8 ust. 2 i 3 ustawy z dnia 13 września 2002 r. o produktach biobójczych;
3) wymagania, jakim powinna odpowiadać dokumentacja niezbędna do oceny substancji czynnej i produktu biobójczego.
1) wymagania podstawowe określone w załączniku nr 2 do rozporządzenia;
2) wymagania dodatkowe określone w załączniku nr 3 do rozporządzenia.
2. Wymagania, jakim powinna odpowiadać dokumentacja niezbędna do oceny produktu biobójczego zawierającego substancję czynną, obejmują:
1) wymagania podstawowe określone w załączniku nr 4 do rozporządzenia;
2) wymagania dodatkowe określone w załączniku nr 5 do rozporządzenia.
3. Wymagania, jakim powinna odpowiadać dokumentacja niezbędna do oceny substancji czynnej, jaką są mikroorganizmy, w tym także wirusy i grzyby, zawarte w produkcie biobójczym, określa załącznik nr 6 do rozporządzenia.
4. Wymagania, jakim powinna odpowiadać dokumentacja niezbędna do oceny produktu biobójczego zawierającego jako substancję czynną mikroorganizmy, w tym także wirusy i grzyby, określa załącznik nr 7 do rozporządzenia.
Minister Zdrowia: E. Kopacz
|
|
1) Minister Zdrowia kieruje działem administracji rządowej – zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 16 listopada 2007 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. Nr 216, poz. 1607).
2) Niniejsze rozporządzenie dokonuje w zakresie swojej regulacji wdrożenia dyrektywy 98/8/WE Parlamentu Europejskiego i Rady z dnia 16 lutego 1998 r. dotyczącej wprowadzania do obrotu produktów biobójczych (Dz. Urz. WE L 123 z 24.04.1998, str. 1, z późn. zm.; Dz. Urz. UE Polskie wydanie specjalne, rozdz. 3, t. 23, str. 3, z późn. zm.).
3) Niniejsze rozporządzenie było poprzedzone rozporządzeniem Ministra Zdrowia z dnia 13 lipca 2005 r. w sprawie szczegółowych wymagań, jakim powinna odpowiadać dokumentacja niezbędna do oceny produktu biobójczego (Dz. U. Nr 147, poz. 1229), które utraciło moc z dniem 6 października 2006 r. na podstawie art. 4 ustawy z dnia 28 lipca 2005 r. o zmianie ustawy o produktach biobójczych (Dz. U. Nr 180, poz. 1491).
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 28 maja 2008 r. (poz. 650)
Załącznik nr 1
WZÓR WNIOSKU O WYDANIE WPISU DO REJESTRU, POZWOLENIA ALBO POZWOLENIA TYMCZASOWEGO

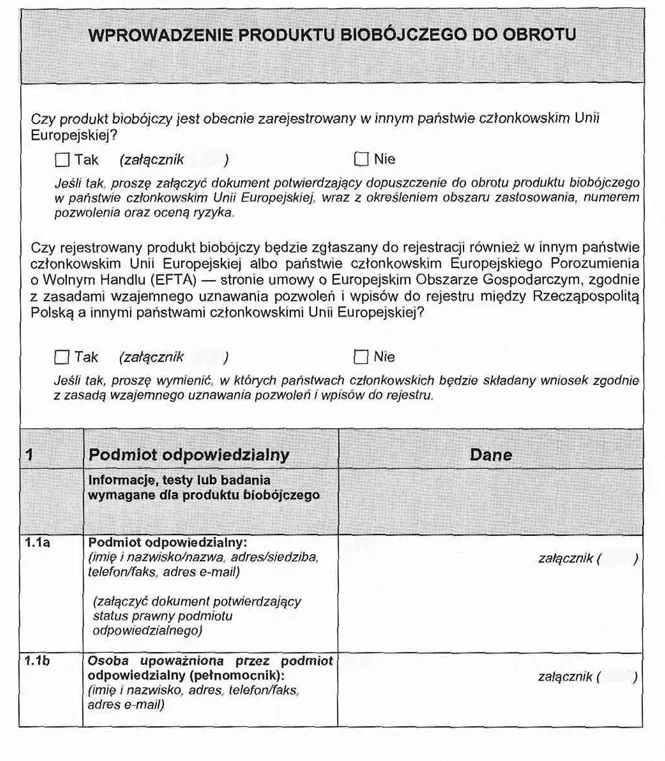

Załącznik nr 2
WYMAGANIA PODSTAWOWE, JAKIM POWINNA ODPOWIADAĆ DOKUMENTACJA NIEZBĘDNA DO OCENY SUBSTANCJI CZYNNEJ
Wymagania ogólne
1. Dokumentacja musi zawierać przynajmniej dane, o których mowa w częściach I–X. Dokumentacja musi uwzględniać aktualny stan wiedzy naukowej i technicznej.
2. Informacje, które nie są niezbędne ze względu na rodzaj produktu biobójczego lub jego zamierzone wykorzystanie, nie muszą być przedłożone. To samo odnosi się do przypadku, gdy dostarczenie tego rodzaju informacji jest z naukowego punktu widzenia zbyteczne lub technicznie niemożliwe. W takich przypadkach należy przekazać uzasadnienie. Takim uzasadnieniem może być receptura ramowa, do której podmiot odpowiedzialny ma prawo dostępu.
Dokumentacja obejmuje następujące części:
I. Podmiot odpowiedzialny.
II. Tożsamość substancji czynnej.
III. Właściwości fizyczne i chemiczne substancji czynnej.
IV. Analityczne metody wykrywania i identyfikacji substancji czynnej.
V. Skuteczność substancji czynnej wobec organizmów podlegających zwalczaniu i zakres zamierzonego stosowania.
VI. Charakterystyka toksykologiczna substancji czynnej w odniesieniu do ludzi i zwierząt, z uwzględnieniem metabolizmu.
VII. Charakterystyka ekotoksykologiczna substancji czynnej łącznie z losami i zachowaniem w środowisku.
VIII. Środki niezbędne w celu ochrony zdrowia ludzi, zwierząt i środowiska.
IX. Klasyfikacja i oznakowanie substancji czynnej.
X. Streszczenie i ocena części II–IX.
Wymagania szczegółowe
I. Podmiot odpowiedzialny
1.1. Imię i nazwisko lub nazwa oraz adres lub siedziba podmiotu odpowiedzialnego.
1.2. Wytwórca substancji czynnej (imię i nazwisko lub nazwa oraz adres i siedziba, adres miejsca wytwarzania substancji czynnej).
II. Tożsamość substancji czynnej
2.1. Proponowana nazwa zwyczajowa i jej synonimy oraz nazwa stosowana przez ISO1).
2.2. Nazwa chemiczna (zgodna z nazewnictwem IUPAC2)).
2.3. Numer kodowy nadany przez wytwórcę.
2.4. Numery CAS3) i WE4) (jeżeli są dostępne).
2.5. Wzór cząsteczkowy i strukturalny (z uwzględnieniem wszystkich szczegółów struktury izomerów), masa cząsteczkowa.
2.6. Metody wytwarzania substancji czynnej (drogi syntezy w skrócie).
2.7. Specyfikacja dotycząca czystości substancji czynnej w g/kg lub g/l, tam gdzie jest to właściwe.
2.8. Identyfikacja zanieczyszczeń i substancji dodatkowych (np. stabilizatorów), łącznie z ich wzorem strukturalnym i przewidywaną zawartością wyrażoną w g/kg lub g/l.
2.9. Pochodzenie substancji czynnej pochodzenia naturalnego lub prekursora substancji czynnej, np. ekstrakt z kwiatu.
2.10. Dane dotyczące narażenia na substancję czynną.
III. Właściwości fizyczne i chemiczne substancji czynnej
3.1. Temperatura topnienia, wrzenia, gęstość5).
3.2. Prężność par (w Pa)5).
3.3. Wygląd (stan skupienia, barwa)6).
3.4. Widma absorpcyjne (UV/VIS, IR, NMR), widma masowe, absorbancja molowa przy odpowiednich długościach fal, w przypadkach, w których znajduje to zastosowanie5).
3.5. Rozpuszczalność w wodzie z uwzględnieniem wpływu pH (od 5 do 9) i temperatury na rozpuszczalność, w przypadkach, w których znajduje to zastosowanie5).
3.6. Współczynnik podziału n-oktanol/woda z uwzględnieniem wpływu pH (od 5 do 9) i temperatury.
3.7. Stabilność termiczna, identyfikacja produktów rozkładu termicznego.
3.8. Palność, w tym temperatura samozapłonu i identyfikacja produktów spalania.
3.9. Temperatura zapłonu.
3.10. Napięcie powierzchniowe.
3.11. Właściwości wybuchowe.
3.12. Właściwości utleniające.
3.13. Reaktywność z materiałem opakowania.
IV. Analityczne metody wykrywania i identyfikacji substancji czynnej
4.1. Metody analityczne oznaczania czystej substancji czynnej oraz, w uzasadnionych przypadkach, oznaczania odpowiednich produktów rozkładu, izomerów i zanieczyszczeń substancji czynnej i substancji dodatkowych (np. stabilizatorów).
4.2. Metody analityczne, w tym odzysk i granice oznaczalności substancji czynnej i jej pozostałości w przypadkach, gdy jest to uzasadnione, w:
a) glebie,
b) powietrzu,
c) wodzie: podmiot odpowiedzialny powinien potwierdzić, że substancja czynna i każdy z produktów jej rozkładu mogą zostać oznaczone z odpowiednią dokładnością na podstawie charakterystyki metody i najwyższego dopuszczalnego stężenia tych substancji określonego w rozporządzeniu Ministra Zdrowia z dnia 29 marca 2007 r. w sprawie jakości wody przeznaczonej do spożycia przez ludzi (Dz. U. Nr 61, poz. 417),
d) płynach ustrojowych oraz tkankach ludzkich i zwierzęcych.
V. Skuteczność substancji czynnej wobec organizmów podlegających zwalczaniu i zakres zamierzonego stosowania
5.1. Działanie (np. produkt bakteriobójczy, grzybobójczy, do zwalczania gryzoni i owadów).
5.2. Organizm podlegający zwalczaniu oraz produkty, organizmy lub obiekty, które należy zabezpieczyć przed działaniem substancji czynnej.
5.3.Wpływ na organizm podlegający zwalczaniu i przewidywane stężenie, w jakim substancja czynna będzie stosowana.
5.4. Mechanizm działania, włączając działanie opóźnione w czasie.
5.5. Zalecane miejsce stosowania.
5.6. Użytkownik: profesjonalny, przemysłowy, powszechny (nieprofesjonalny).
5.7. Informacje o pojawianiu się lub możliwości rozwoju oporności/odporności oraz o odpowiednich procedurach postępowania.
5.8. Przewidywana ilość wprowadzana rocznie do obrotu.
VI. Charakterystyka toksykologiczna substancji czynnej w odniesieniu do zdrowia ludzi i zwierząt, z uwzględnieniem metabolizmu
6.1. Toksyczność ostra.
Dotyczy badań z uwzględnieniem dróg narażenia, o których mowa w pkt 6.1.1–6.1.3. W przypadku substancji niebędących gazami badania z uwzględnieniem dróg narażenia powinny być przeprowadzone co najmniej dwiema drogami, z których jedna powinna obejmować narażenie drogą pokarmową. Wybór drugiej drogi będzie zależał od rodzaju substancji i najbardziej prawdopodobnej drogi narażenia ludzi; gazy i substancje lotne powinny być badane po narażeniu drogą inhalacyjną.
6.1.1. Toksyczność ostra pokarmowa.
6.1.2. Toksyczność ostra skórna.
6.1.3. Toksyczność ostra inhalacyjna.
6.1.4. Drażnienie skóry i oka7).
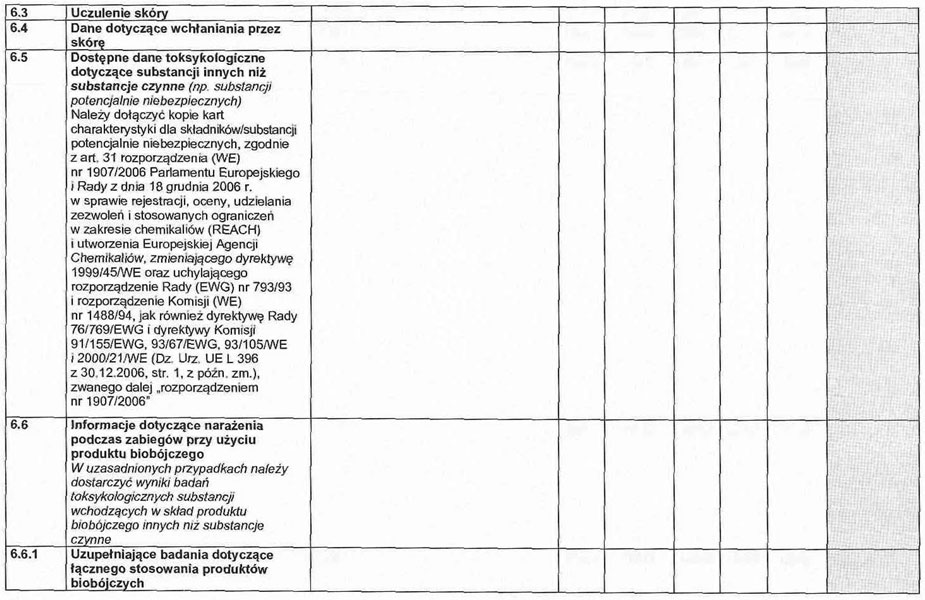
6.1.5. Uczulenie skóry.
6.2. Badanie metabolizmu u ssaków. Podstawowa toksykokinetyka, w tym badania wchłaniania przez skórę.
6.3. Toksyczność krótkoterminowa (28 dni)8).
Wyniki tego badania nie są wymagane, jeżeli dostarczono wyniki badania toksyczności podprzewlekłej 90-dniowej na gryzoniu.
6.4. Toksyczność podprzewlekła 90-dniowa9).
Dwa gatunki ssaków, w tym jeden gryzoń i jeden inny ssak niebędący gryzoniem.
6.5. Toksyczność przewlekła9)' 10).
Na jednym gatunku gryzonia i jednym innym gatunku ssaka niebędącego gryzoniem.
6.6. Badania mutagenności9).
6.6.1. Badania mutacji genowych u bakterii in vitro.
6.6.2. Badania cytogenetyczne na komórkach ssaków in vitro.
6.6.3. Badania mutacji genowych w komórkach ssaków in vitro.
6.6.4. Jeżeli wyniki testów, o których mowa w pkt 6.6.1, 6.6.2 lub 6.6.3, są pozytywne, wymagane są wyniki badań mutagenności w warunkach in vivo (uszkodzenia chromosomów w szpiku kostnym lub test mikrojądrowy).
6.6.5. Jeżeli wyniki testów, o których mowa w pkt 6.6.4, są negatywne, a testów in vitro są pozytywne, należy wykonać kolejne testy in vivo w celu zbadania, czy mutagenność lub dowody na uszkodzenie DNA znajdują potwierdzenie w tkankach innych niż szpik kostny.
6.6.6. Jeżeli wyniki testów, o których mowa w pkt 6.6.4, są pozytywne, może być wymagane badanie na komórkach płciowych.
6.7. Badanie rakotwórczości9), 10).
Badania przeprowadza się na jednym gatunku gryzonia i jednym innym gatunku ssaka. Badania te można połączyć z badaniami, o których mowa w pkt 6.5.
6.8. Badania wpływu na rozrodczość9), 11).
6.8.1. Badanie teratogenności.
Badanie przeprowadza się na królikach i jednym gatunku gryzonia.
6.8.2. Badanie wpływu na rozrodczość – wykonane przynajmniej na dwóch pokoleniach jednego gatunku ssaka, w odniesieniu do samic i do samców.
6.9. Dane medyczne w formie anonimowej.
6.9.1. Dane z badań profilaktycznych pracowników zatrudnionych w zakładzie produkcyjnym (jeżeli są dostępne).
6.9.2. Bezpośrednie obserwacje medyczne, np. przypadki kliniczne, przypadki zatruć (jeżeli są dostępne).
6.9.3. Analizy stanu zdrowia pracowników z zakładu produkcyjnego i dane z innych dostępnych źródeł.
6.9.4. Badania epidemiologiczne dla populacji generalnej (jeżeli są dostępne).
6.9.5. Diagnostyka zatruć, w tym swoiste objawy zatrucia i testy kliniczne (jeżeli są dostępne).
6.9.6. Wyniki obserwacji dotyczących działania uczulającego/alergizującego (jeżeli są dostępne).
6.9.7. Metody swoistego leczenia w przypadku zatruć: zasady pierwszej pomocy, odtrutki i sposoby postępowania lekarskiego (jeżeli są dostępne).
6.9.8. Rokowania w przypadku zatrucia.
6.10. Streszczenie opisów badań toksykologicznych na ssakach wraz z wnioskami, w tym najwyższa dawka lub poziom bez obserwowanego działania szkodliwego (NOAEL), dawka lub poziom bez obserwowanego działania (NOEL), ogólna ocena uwzględniająca wszystkie dane toksykologiczne i wszelkie inne informacje dotyczące substancji czynnej. Jeżeli to możliwe, w streszczeniu należy podać wszelkie sugestie odnośnie do środków ochrony indywidualnej pracowników.
VII. Charakterystyka ekotoksykologiczna substancji czynnej łącznie z losami i zachowaniem się w środowisku
Charakterystyka ekotoksykologiczna substancji czynnej.
7.1. Toksyczność ostra dla ryb.
7.2. Toksyczność ostra dla rozwielitki (Daphnia magna).
7.3.Test inhibicji wzrostu glonów.
7.4. Zahamowanie aktywności mikrobiologicznej.
7.5. Biokoncentracja.
Losy i zachowanie się w środowisku.
7.6. Degradacja.
7.6.1. Degradacja biotyczna.
7.6.1.1. Podatność na biodegradację.
7.6.1.2. Biodegradacja właściwa (w przypadkach, w których znajduje to zastosowanie).
7.6.2. Degradacja abiotyczna.
7.6.2.1. Hydroliza w zależności od pH oraz identyfikacja produktów rozpadu.
7.6.2.2. Fototransformacja w wodzie oraz identyfikacja produktów transformacji5).
7.7. Test przesiewowy adsorpcji/desorpcji.
Jeżeli wyniki testu przesiewowego wskażą na konieczność wykonania testów, o których mowa w pkt 7.1.2 lub 7.2.2 załącznika nr 3 do rozporządzenia, należy te badania wykonać.
7.8. Streszczenie wyników badań ekotoksykologicznych, losów i zachowania w środowisku.
VIII. Środki niezbędne w celu ochrony zdrowia ludzi, zwierząt i środowiska
8.1. Zalecane sposoby i środki ostrożności przy stosowaniu, przechowywaniu, transporcie i zagrożeniu pożarowym.
8.2. Rodzaj produktów reakcji, gazów spalinowych itp. powstających w przypadku pożaru.
8.3. Zalecane środki bezpieczeństwa w przypadku awarii.
8.4. Możliwość rozkładu lub dekontaminacji w przypadku uwolnienia do:
a) powietrza,
b) wody, a w szczególności wody przeznaczonej do spożycia,
c) gleby.
8.5. Sposób postępowania z odpadami substancji czynnej w przemyśle i w zastosowaniach profesjonalnych.
8.5.1. Możliwości ponownego wykorzystania lub przetworzenia (recyklingu).
8.5.2. Możliwości neutralizacji skutków działania.
8.5.3. Warunki utylizacji łącznie z rodzajem odcieków.
8.5.4. Warunki spalania.
8.6. Spostrzeżenia dotyczące niepożądanych lub niezamierzonych skutków ubocznych na organizmy pożyteczne i inne niebędące przedmiotem zwalczania.
IX. Klasyfikacja i oznakowanie substancji czynnej
Propozycje wraz z uzasadnieniem, dotyczące klasyfikacji i oznakowania substancji czynnej zgodnych z art. 44 ustawy z dnia 13 września 2002 r. o produktach biobójczych, uwzględniające w szczególności:
1) znak lub znaki ostrzegawcze;
2) napisy określające znaczenie znaku ostrzegawczego;
3) zwroty wskazujące rodzaj zagrożenia (zwroty R);
4) zwroty określające warunki bezpiecznego stosowania (zwroty S).
X. Streszczenie i ocena części II–IX
Objaśnienia:
1) ISO – International Standard Organization – Międzynarodowa Organizacja Normalizacyjna.
2)IUPAC – International Union of Pure and Applied Chemistry – Międzynarodowa Unia Chemii Czystej i Stosowanej.
3) Nr CAS – oznaczenie numeryczne przypisane substancji chemicznej przez amerykańską organizację Chemical Abstracts Service.
4) Nr WE – numer przypisany substancji chemicznej w Europejskim Wykazie Istniejących Substancji o Znaczeniu Komercyjnym (EINECS) lub numer przypisany substancji w Europejskim Wykazie Notyfikowanych Substancji Chemicznych (ELINCS) lub numer w wykazie substancji chemicznych wymienionych w publikacji „No-longer polymers”.
5) Dane powinny być przedstawione dla oczyszczonej substancji czynnej.
6) Dane powinny być przedstawione dla substancji czynnej.
7) Badanie drażnienia oka nie jest wymagane, jeżeli substancja czynna ma potencjalne właściwości żrące.
8) Dla badań, o których mowa w pkt 6.3, w przypadkach, w których jest to konieczne, wymagana jest pokarmowa droga narażenia, jeżeli nie można uzasadnić, że bardziej odpowiednie jest narażenie drogą alternatywną.
9) Dla badań, o których mowa w pkt 6.4–6.8, wymagana jest pokarmowa droga narażenia, jeżeli nie można uzasadnić, że bardziej odpowiednie jest narażenie drogą alternatywną.
10) Istnieje możliwość odstąpienia od wymagania badań toksyczności przewlekłej i rakotworczości w przypadku w pełni przekonywającego uzasadnienia, że badania takie nie są niezbędne.
11) Jeżeli, w wyjątkowych okolicznościach, zgłaszane są zastrzeżenia odnośnie do konieczności wykonywania tych badań, to zastrzeżenia te należy w pełni uzasadnić.
Załącznik nr 3
WYMAGANIA DODATKOWE, JAKIM POWINNA ODPOWIADAĆ DOKUMENTACJA NIEZBĘDNA DO OCENY SUBSTANCJI CZYNNEJ
Wymagania ogólne
1. Dokumentacja musi zawierać przynajmniej dane, o których mowa w częściach I–X załącznika nr 2 do rozporządzenia. Dokumentacja musi uwzględniać aktualny stan wiedzy naukowej i technicznej.
2. Informacje, które nie są niezbędne ze względu na rodzaj produktu biobójczego lub jego zamierzone wykorzystanie, nie muszą być przedłożone. To samo odnosi się do przypadku, gdy dostarczenie tego rodzaju informacji jest z naukowego punktu widzenia zbyteczne lub technicznie niemożliwe. W takich przypadkach należy przekazać uzasadnienie. Takim uzasadnieniem może być receptura ramowa, do której podmiot odpowiedzialny ma prawo dostępu.
Wymagania szczegółowe
I. Właściwości fizyczne i chemiczne substancji czynnej1)
1.1. Rozpuszczalność w rozpuszczalnikach organicznych, z uwzględnieniem wpływu temperatury na rozpuszczalność2).
1.2. Trwałość w rozpuszczalnikach organicznych stosowanych w produktach biobójczych i identyfikacja produktów rozpadu3).
II. Analityczne metody wykrywania i identyfikacji substancji czynnej4)
2.1. Metody analityczne z uwzględnieniem odzysku i granic oznaczalności substancji czynnej i jej pozostałości w lub na wyrobach, żywności, paszach – w uzasadnionych przypadkach.
III. Charakterystyka toksykologiczna substancji czynnej w odniesieniu do zdrowia ludzi i zwierząt z uwzględnieniem metabolizmu5)
3.1. Badania neurotoksyczności.
Są wymagane w przypadku, gdy substancją czynną jest związek fosforoorganiczny lub jeżeli istnieją inne wskazania, że ma ona właściwości neurotoksyczne. Badania wykonuje się na kurach domowych, jeżeli nie ma uzasadnionych wskazań, że inny gatunek jest bardziej odpowiedni.
W uzasadnionych przypadkach wymagane są badania opóźnionej neurotoksyczności.
W przypadku stwierdzenia działania hamującego aktywność esterazy cholinowej, należy wykonać test odpowiedzi na działanie czynników reaktywujących aktywność tego enzymu.
3.2. Toksyczność dla zwierząt gospodarskich i domowych.
3.3. Badania dotyczące narażenia ludzi na substancję czynną.
3.4. Żywność i pasze.
Jeżeli przewiduje się stosowanie substancji czynnej w produktach biobójczych używanych w miejscach przygotowywania lub przechowywania żywności albo w miejscach przygotowywania, spożywania, przechowywania pasz, przeprowadza się badania, o których mowa w pkt 6.1.
3.5. W przypadku gdy jakiekolwiek inne badanie dotyczące narażenia ludzi na substancję czynną okaże się niezbędne, należy wykonać badania, o których mowa w pkt 6.2.
3.6. W przypadku gdy substancja czynna jest przeznaczona do stosowania w produktach do zwalczania roślin, należy wykonać badania umożliwiające ocenę toksycznego działania jej metabolitów powstających w roślinach, jeżeli różnią się one od metabolitów zidentyfikowanych u zwierząt.
3.7. Badania mechanistyczne – wszelkie badania podejmowane w celu wyjaśnienia skutków działania stwierdzonych w badaniach toksyczności.
IV. Charakterystyka ekotoksykologiczna substancji czynnej łącznie z losami i zachowaniem się w środowisku6)
4.1. Toksyczność ostra na jednym organizmie nienależącym do organizmów wodnych i niebędącym przedmiotem zwalczania.
4.2. Badania, o których mowa w części VII i VIII, są wymagane, jeżeli wyniki badań ekotoksykologicznych i zamierzone stosowanie substancji czynnej wskazują na zagrożenie dla środowiska.
4.3. Jeżeli wyniki badań biodegradacji, o których mowa w pkt 7.6.1.2 załącznika nr 2 do rozporządzenia, są negatywne oraz jeżeli prawdopodobną drogą usuwania substancji czynnej są ścieki, wymagane jest przeprowadzenie badania, o którym mowa w pkt 8.4.1.
4.4. Wszelkie inne badania biodegradacji wynikające z wyników badań, o których mowa w pkt 7.6.1.1 i 7.6.1.2 załącznika nr 2 do rozporządzenia.
4.5. Fototransformacja w powietrzu (metoda szacunkowa), w tym identyfikacja produktów rozkładu2).
4.6. Jeżeli wyniki badań, o których mowa w pkt 7.6.1.2 załącznika nr 2 do rozporządzenia lub w pkt 4.4, wskazują na taką potrzebę albo gdy substancja czynna nie podlega rozkładowi biotycznemu lub rozkład ten jest nieznaczny, wymagane są badania, o których mowa w pkt 7.1.1 i 7.2.1, a w uzasadnionych przypadkach w pkt 7.3.
V. Środki niezbędne w celu ochrony zdrowia ludzi, zwierząt i środowiska7)
5. 1. Wskazanie substancji szczególnie niebezpiecznych dla środowiska wodnego, w rozumieniu ustawy z dnia 18 lipca 2001 r. – Prawo wodne (Dz. U. z 2005 r. Nr 239, poz. 2019, z późn. zm.8)).
VI. Dalsze badania dotyczące wpływu na zdrowie ludzi
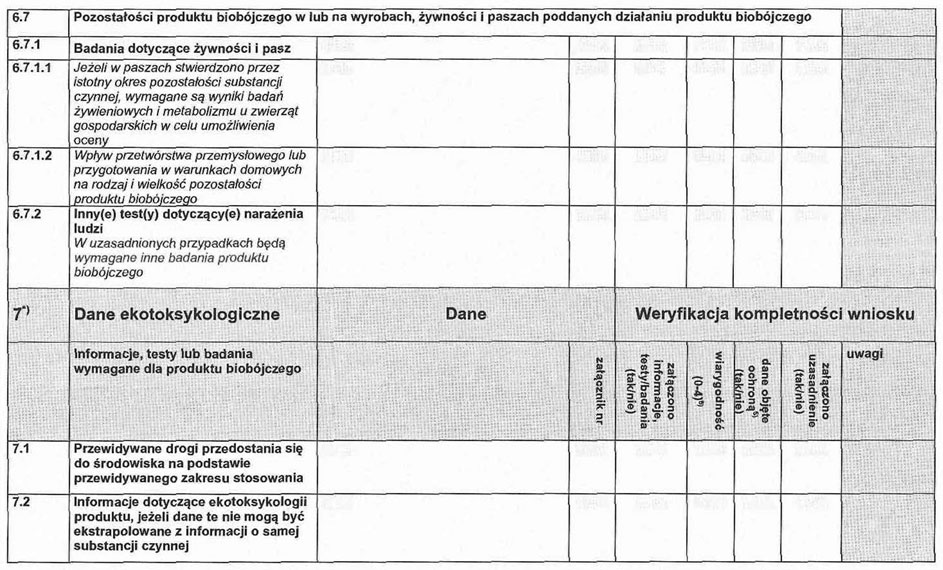
6. 1. Badania dotyczące żywności i pasz.
6. 1.1. Identyfikacja produktów rozkładu, reakcji i metabolitów substancji czynnej w żywności i paszach poddawanych działaniu substancji czynnej lub nią zanieczyszczonych.
6. 1.2. Zachowanie się pozostałości substancji czynnej, produktów jej rozkładu i w uzasadnionych przypadkach jej metabolitów w żywności i paszach poddawanych działaniu lub nimi zanieczyszczonych, w tym kinetyka zanikania substancji czynnej.
6. 1.3. Dane dotyczące pozostałości uzyskane na podstawie badań nadzorowanych umożliwiających stwierdzenie, że pozostałości, jakie wynikną wskutek proponowanego zastosowania produktu biobójczego, nie będą powodowały zagrożenia dla zdrowia ludzi lub zwierząt.
6. 1.4. Oszacowanie potencjalnego lub rzeczywistego narażenia ludzi na substancję czynną w wyniku stosowania różnych sposobów odżywiania.
6. 1.5. Jeżeli w paszach przez istotny okres stwierdza się pozostałości substancji czynnej, wymagane są wyniki badań żywieniowych i metabolizmu u zwierząt gospodarskich w celu oceny pozostałości w żywności pochodzenia zwierzęcego.
6. 1.6. Wyniki badań wpływu przetwórstwa przemysłowego lub przygotowania w warunkach domowych na rodzaj i ilość pozostałości substancji czynnej.
6. 1.7. Proponowane dopuszczalne pozostałości wraz z uzasadnieniem.
6. 1.8. Wszelkie inne odpowiednie informacje.
6. 1.9. Streszczenie i ocena danych zawartych w pkt 6.1.1–6.1.8.
6. 2. Inne badania związane z narażeniem ludzi.
W uzasadnionych przypadkach wymagane będą inne badania.
VII. Dalsze badania losów i zachowania się w środowisku
7. 1. Losy i zachowanie się w glebie.
7. 1.1. Szybkość i drogi rozkładu, w tym wskazanie procesu i wskazanie wszystkich metabolitów i produktów rozkładu w przynajmniej trzech rodzajach gleby, w odpowiednich warunkach.
7. 1.2. Absorpcja i desorpcja w przynajmniej trzech rodzajach gleby oraz, w uzasadnionych przypadkach, absorpcja i desorpcja metabolitów i produktów rozkładu.
7. 1.3. Mobilność w przynajmniej trzech rodzajach gleby oraz, w uzasadnionych przypadkach, mobilność metabolitów i produktów rozkładu.
7. 1.4. Zakres występowania i rodzaj pozostałości związanych.
7. 2. Losy i zachowanie się w wodzie.
7. 2.1. Szybkość i drogi rozkładu w układach wodnych w zakresie nieobjętym w pkt 7.6 załącznika nr 2 do rozporządzenia, w tym identyfikacja metabolitów i produktów rozkładu.
7. 2.2. Adsorpcja i desorpcja w wodzie (system osadów glebowych) oraz, w uzasadnionych przypadkach, absorpcja i desorpcja metabolitów i produktów rozkładu.
7. 3. Losy i zachowanie się w powietrzu.
Jeżeli substancja czynna będzie używana w produktach do zadymiania (fumigacji), zamgławiania, oprysku lub jeżeli jest lotna albo jeżeli inne dane wskazują na taką potrzebę, wymagane są badania szybkości i drogi rozkładu w powietrzu, w zakresie nieobjętym w pkt 4.5.
7. 4. Streszczenie i ocena pkt 7.1–7.3.
VIII. Dalsze badania ekotoksykologiczne
8. 1. Wpływ na ptaki.
8. 1.1. Ostra toksyczność pokarmowa. Badania nie wymaga się, jeżeli do badań określonych w pkt 4.1 został wybrany ptak jako gatunek uzupełniający.
8. 1.2. Toksyczność krótkoterminowa; 8-dniowe badanie połączone z dietą na przynajmniej jednym gatunku innym niż kurczęta.
8. 1.3. Wpływ na rozmnażanie.
8. 2. Wpływ na organizmy wodne.
8. 2.1. Przedłużona toksyczność na odpowiednich gatunkach ryb.
8. 2.2. Wpływ na rozmnażanie i szybkość wzrostu odpowiednich gatunków ryb.
8. 2.3. Bioakumulacja na odpowiednich gatunkach ryb.
8. 2.4. Wpływ na rozmnażanie i szybkość wzrostu rozwielitki (Daphnia magna).
8. 3. Wpływ na inne organizmy niebędące przedmiotem zwalczania.
8. 3.1. Ostra toksyczność dla pszczół i innych pożytecznych stawonogów, np. drapieżnych. Do badań należy użyć innych organizmów niż zastosowane w badaniu, o którym mowa w pkt 4.1.
8. 3.2. Toksyczność dla dżdżownic i innych organizmów glebowych niebędących przedmiotem zwalczania.
8. 3.3. Wpływ na drobnoustroje glebowe niebędące przedmiotem zwalczania.
8. 3.4. Wpływ na inne swoiste, niebędące przedmiotem zwalczania gatunki (rośliny i zwierzęta), dla których istnieje ryzyko związane ze stosowaniem produktu biobójczego.
8. 4. Inne działanie.
8. 4.1. Test zahamowania oddychania osadu czynnego.
8. 5. Streszczenie i ocena pkt 8.1–8.4.
Objaśnienia:
1) Dokumenty należy dołączyć do dokumentacji, o której mowa w części III załącznika nr 2 do rozporządzenia.
2) Dane dotyczą oczyszczonej substancji czynnej zgodnie z przedstawioną specyfikacją.
3) Dane dotyczą substancji czynnej zgodnie z przedstawioną specyfikacją.
4) Dokumenty należy dołączyć do dokumentacji, o której mowa w części IV załącznika nr 2 do rozporządzenia.
5) Dokumenty należy dołączyć do dokumentacji, o której mowa w części VI załącznika nr 2 do rozporządzenia.
6) Dokumenty należy dołączyć do dokumentacji, o której mowa w części VII załącznika nr 2 do rozporządzenia.
7) Dokumenty należy dołączyć do dokumentacji, o której mowa w części VIII załącznika nr 2 do rozporządzenia.
8) Zmiany tekstu jednolitego wymienionej ustawy zostały ogłoszone w Dz. U. z 2005 r. Nr 267, poz. 2255, z 2006 r. Nr 170, poz. 1217 i Nr 227, poz. 1658 oraz z 2007 r. Nr 21, poz. 125, Nr 64, poz. 427, Nr 75, poz. 493, Nr 88, poz. 587, Nr 147, poz. 1033, Nr 176, poz. 1238, Nr 181, poz.1286 i Nr 231, poz. 1704.
Załącznik nr 4
WYMAGANIA PODSTAWOWE, JAKIM POWINNA ODPOWIADAĆ DOKUMENTACJA NIEZBĘDNA DO OCENY PRODUKTU BIOBÓJCZEGO ZAWIERAJĄCEGO SUBSTANCJĘ CZYNNĄ
Wymagania ogólne
1. Dokumentacja musi zawierać przynajmniej dane, o których mowa w częściach I–X. Dokumentacja musi uwzględniać aktualny stan wiedzy naukowej i technicznej.
2. Informacje, które nie są niezbędne ze względu na rodzaj produktu biobójczego lub jego zamierzone wykorzystanie, nie muszą być przedłożone. To samo odnosi się do przypadku, gdy dostarczenie tego rodzaju informacji jest z naukowego punktu widzenia zbyteczne lub technicznie niemożliwe. W takich przypadkach należy przekazać uzasadnienie. Takim uzasadnieniem może być receptura ramowa, do której podmiot odpowiedzialny ma prawo dostępu.
3. Informacje mogą pochodzić z istniejących danych, o ile przedstawi się możliwe do zaakceptowania uzasadnienie. W szczególności, zawsze gdy jest to możliwe, należy ograniczyć do minimum doświadczenia przeprowadzane na zwierzętach.
Dokumentacja obejmuje następujące części:
I. Podmiot odpowiedzialny.
II. Tożsamość produktu biobójczego.
III. Właściwości fizyczne, chemiczne i cechy techniczne produktu biobójczego.
IV. Metody wykrywania i identyfikacji produktu biobójczego.
V. Przewidywany zakres stosowania i skuteczność produktu biobójczego.
VI. Charakterystyka toksykologiczna produktu biobójczego (analogicznie jak do substancji czynnej).
VII. Charakterystyka ekotoksykologiczna produktu biobójczego łącznie z losami i zachowaniem się w środowisku (analogicznie jak do substancji czynnej).
VIII. Środki niezbędne w celu ochrony zdrowia ludzi, zwierząt i środowiska.
IX. Klasyfikacja, opakowanie i oznakowanie.
X. Streszczenie i ocena części II–IX.
Wymagania szczegółowe
I. Podmiot odpowiedzialny
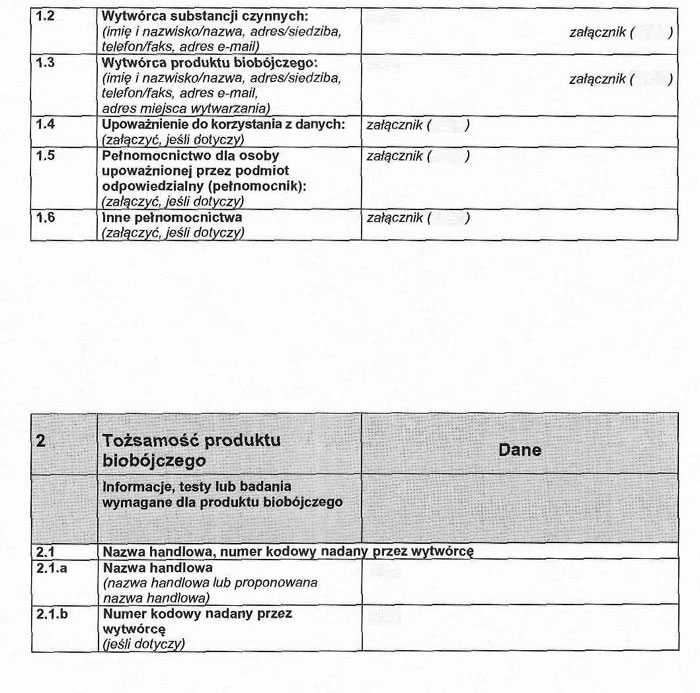
1. 1. Imię i nazwisko lub nazwa oraz adres lub siedziba podmiotu odpowiedzialnego.
1. 2. Wytwórca produktu biobójczego i substancji czynnej (imię i nazwisko lub nazwa oraz adres i siedziba, adres miejsca wytwarzania substancji czynnej).
II. Tożsamość produktu biobójczego
2. 1. Nazwa handlowa lub proponowana nazwa handlowa, numer kodowy nadany przez wytwórcę, jeżeli znajduje to zastosowanie.
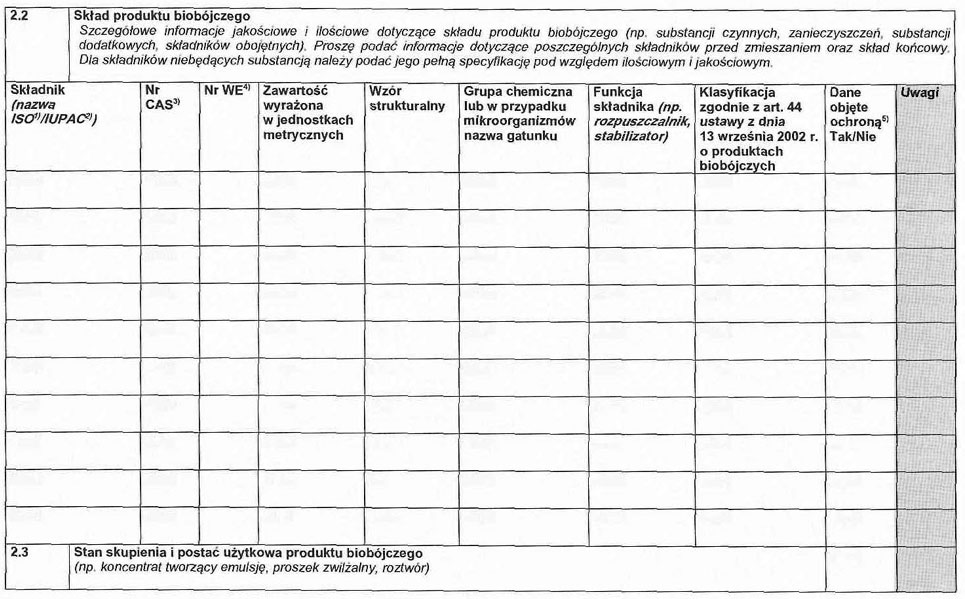
2. 2. Szczegółowe informacje jakościowe i ilościowe dotyczące składu produktu biobójczego (np. substancji czynnej, zanieczyszczeń, substancji dodatkowych, składników obojętnych).
2. 3. Stan skupienia i postać użytkowa produktu biobójczego (np. koncentrat tworzący emulsję, proszek zwilżalny, roztwór).
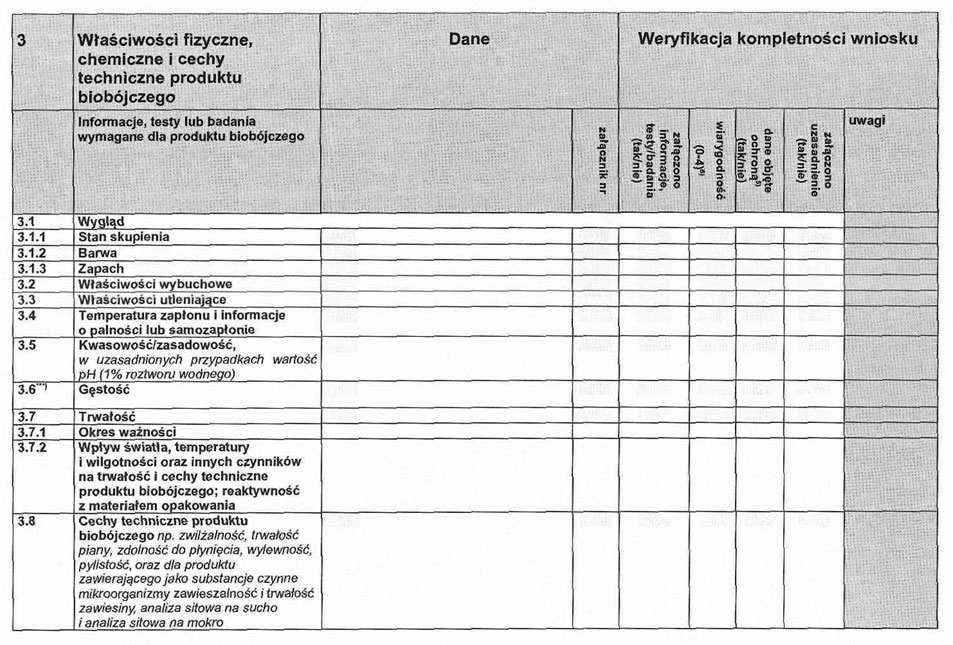
III. Właściwości fizyczne, chemiczne i cechy techniczne produktu biobójczego
3. 1. Wygląd (stan skupienia, barwa).
3. 2. Właściwości wybuchowe.
3. 3. Właściwości utleniające.
3. 4. Temperatura zapłonu i informacje o palności lub samozapłonie.
3. 5. Kwasowość/zasadowość i w uzasadnionych przypadkach wartość pH 1 % roztworu wodnego.
3. 6. Gęstość.
3. 7. Trwałość w czasie przechowywania – trwałość i okres ważności. Wpływ światła, temperatury i wilgotności na cechy techniczne produktu biobójczego; reaktywność z materiałem opakowania.
3. 8. Cechy techniczne produktu biobójczego (np. zwilżalność, trwałość piany, zdolność do płynięcia, wylewność, zdolność do pylenia).
3. 9. Zgodność chemiczna i fizyczna z innymi produktami, w tym z innymi produktami biobójczymi, z którymi przewiduje się łączne stosowanie.
IV. Metody wykrywania i identyfikacji produktu biobójczego
4. 1. Metody analityczne oznaczania stężenia substancji czynnych w produkcie biobójczym.
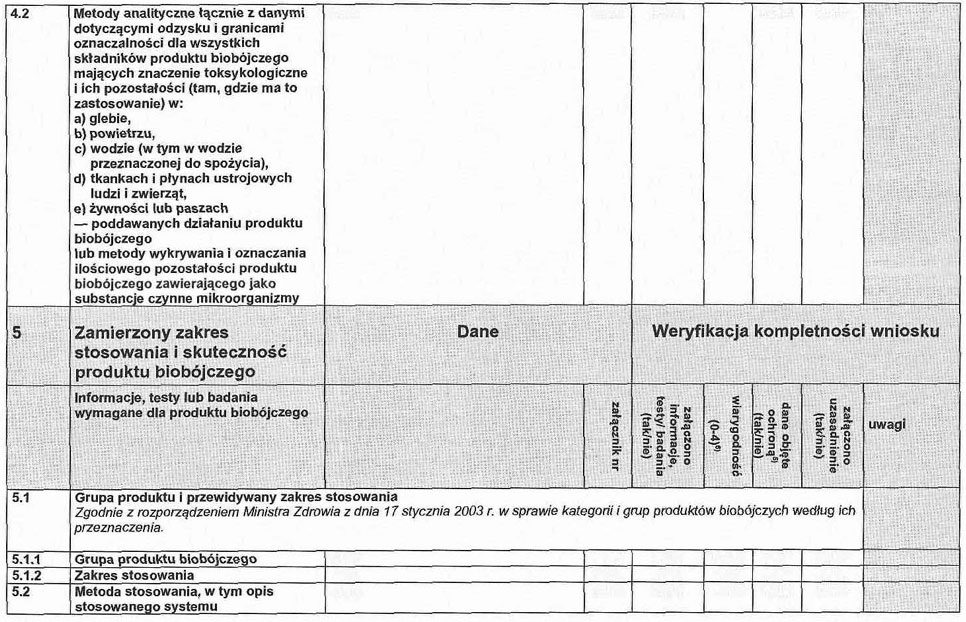
4. 2. Metody analityczne niewymienione w dokumentacji określonej w pkt 4.2 załącznika nr 2 do rozporządzenia, łącznie z danymi dotyczącymi odzysku i granicami oznaczalności dla wszystkich składników produktu biobójczego mających znaczenie toksykologiczne i ich pozostałości (tam, gdzie ma to zastosowanie) w lub na:
a) glebie,
b) powietrzu,
c) wodzie (w tym w wodzie przeznaczonej do spożycia),
d) tkankach i płynach ustrojowych ludzi i zwierząt,
e) żywności lub paszach poddawanych działaniu produktu biobójczego.
V. Przewidywany zakres stosowania i skuteczność produktu biobójczego
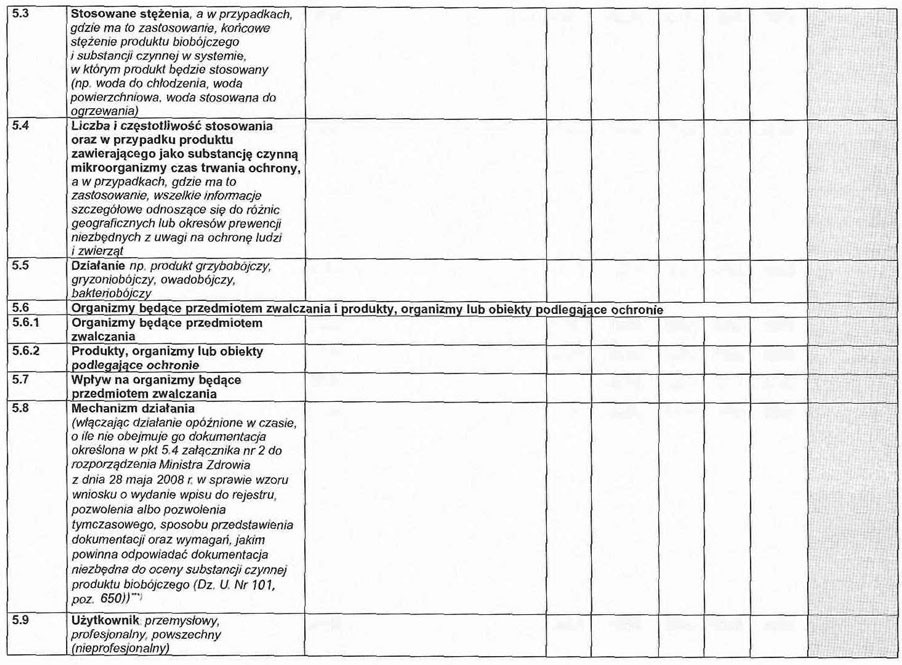
5. 1. Grupa produktu i przewidywany zakres stosowania.
5. 2. Metoda stosowania, w tym opis stosowanego systemu.
5. 3. Stosowane stężenia i ilości, a w przypadkach, w których ma to zastosowanie, końcowe stężenie produktu biobójczego i substancji czynnej w systemie, w którym produkt będzie stosowany (np. woda do chłodzenia, woda stosowana do ogrzewania).
5. 4. Liczba i częstotliwość zabiegów, a w przypadkach, w których ma to zastosowanie, wszelkie informacje szczegółowe odnoszące się do różnic geograficznych lub okresów prewencji niezbędnych z uwagi na ochronę zdrowia ludzi i zwierząt.
5. 5. Działanie (np. produkt bakteriobójczy, grzybobójczy, do zwalczania gryzoni i owadów).
5. 6. Organizmy będące przedmiotem zwalczania i produkty, organizmy lub obiekty podlegające ochronie.
5. 7. Wpływ na organizmy będące przedmiotem zwalczania.
5. 8. Mechanizm działania, włączając działanie opóźnione w czasie (o ile nie obejmuje go dokumentacja określona w pkt 5.4 załącznika nr 2 do rozporządzenia).
5. 9. Użytkownik: przemysłowy, profesjonalny, powszechny (nieprofesjonalny).
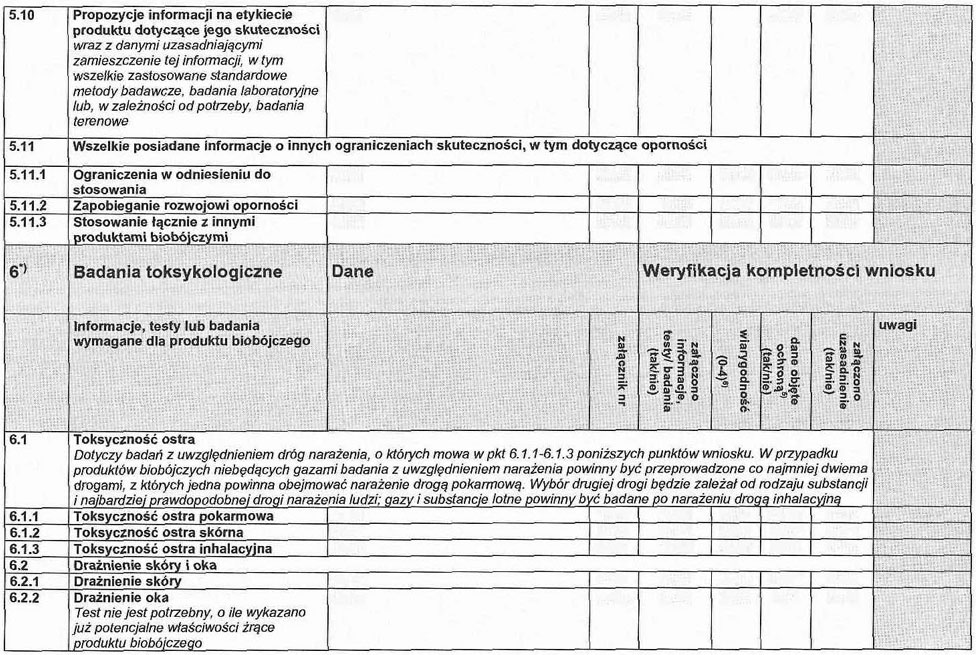
5. 10. Propozycje informacji na etykiecie produktu dotyczące jego skuteczności wraz z danymi uzasadniającymi zamieszczenie tej informacji, w tym wszelkie zastosowane standardowe metody badawcze, badania laboratoryjne lub, w zależności od potrzeby, badania terenowe.
5. 11. Wszelkie posiadane informacje o innych ograniczeniach skuteczności, w tym dotyczące oporności.
VI. Charakterystyka toksykologiczna produktu biobójczego (analogicznie jak do substancji czynnej)
6. 1. Toksyczność ostra.
Dotyczy badań z uwzględnieniem dróg narażenia, o których mowa w pkt 6.1.1–6.1.3. W przypadku produktów biobójczych niebędących gazami badania z uwzględnieniem narażenia powinny być przeprowadzone co najmniej dwiema drogami, z których jedna powinna obejmować narażenie drogą pokarmową. Wybór drugiej drogi będzie zależał od rodzaju produktu i najbardziej prawdopodobnej drogi narażenia ludzi. Gazy i substancje lotne powinny być badane po narażeniu drogą inhalacyjną.
6. 1.1. Toksyczność ostra pokarmowa.
6. 1.2. Toksyczność ostra skórna.
6. 1.3. Toksyczność ostra inhalacyjna.
6. 1.4. W przypadku produktów biobójczych zalecanych do stosowania łącznie z innymi produktami biobójczymi, jeżeli to możliwe, należy mieszaninę tych produktów poddać badaniom toksyczności ostrej oraz drażnienia skóry i oka, tam gdzie ma to zastosowanie.
6. 2. Drażnienie skóry i oka1).
6. 3. Uczulenie skóry.
6. 4. Dane dotyczące wchłaniania przez skórę.
6. 5. Dostępne dane toksykologiczne dotyczące substancji innych niż substancje czynne (np. substancji potencjalnie niebezpiecznych).
6. 6. Informacje dotyczące narażenia ludzi, w tym w szczególności osób przeprowadzających zabiegi z użyciem produktu biobójczego.
W uzasadnionych przypadkach należy dostarczyć wyniki badań toksykologicznych substancji wchodzących w skład produktu biobójczego innych niż substancje czynne.
VII. Charakterystyka ekotoksykologiczna produktu biobójczego łącznie z losami i zachowaniem się w środowisku (analogicznie jak do substancji czynnej)
7. 1. Przewidywane drogi przedostania się do środowiska na podstawie proponowanego zakresu stosowania.
7. 2. Informacje dotyczące ekotoksyko logicznych właściwości substancji czynnej w produkcie biobójczym, jeżeli dane te nie mogą być ekstrapolowane z informacji o samej substancji czynnej.
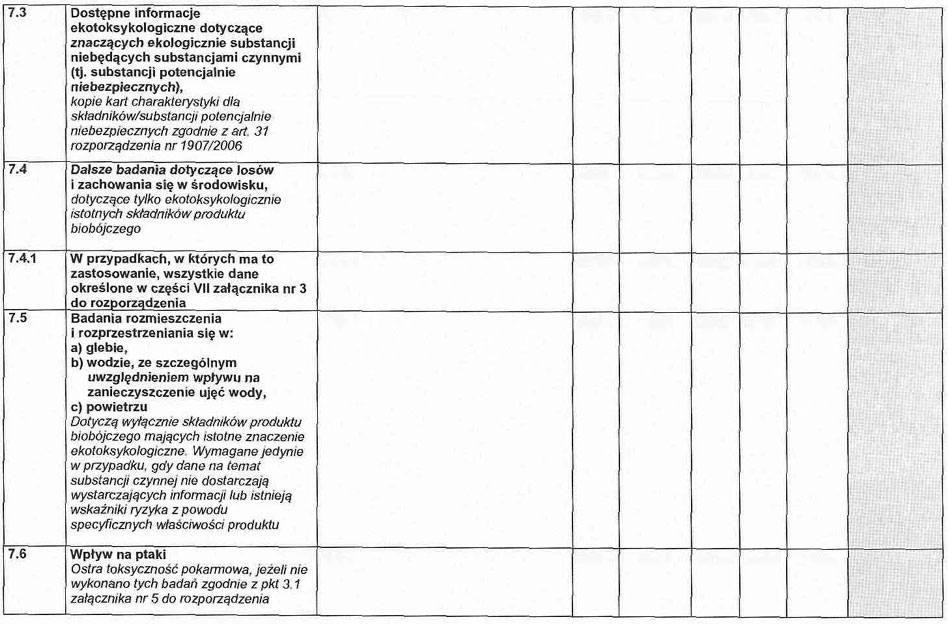
7. 3. Dostępne informacje ekotoksykologiczne dotyczące niebezpiecznych ekologicznie składników produktu biobójczego innych niż substancja czynna (np. substancji potencjalnie niebezpiecznych), o których mowa w karcie charakterystyki.
VIII. Środki niezbędne w celu ochrony zdrowia ludzi, zwierząt i środowiska
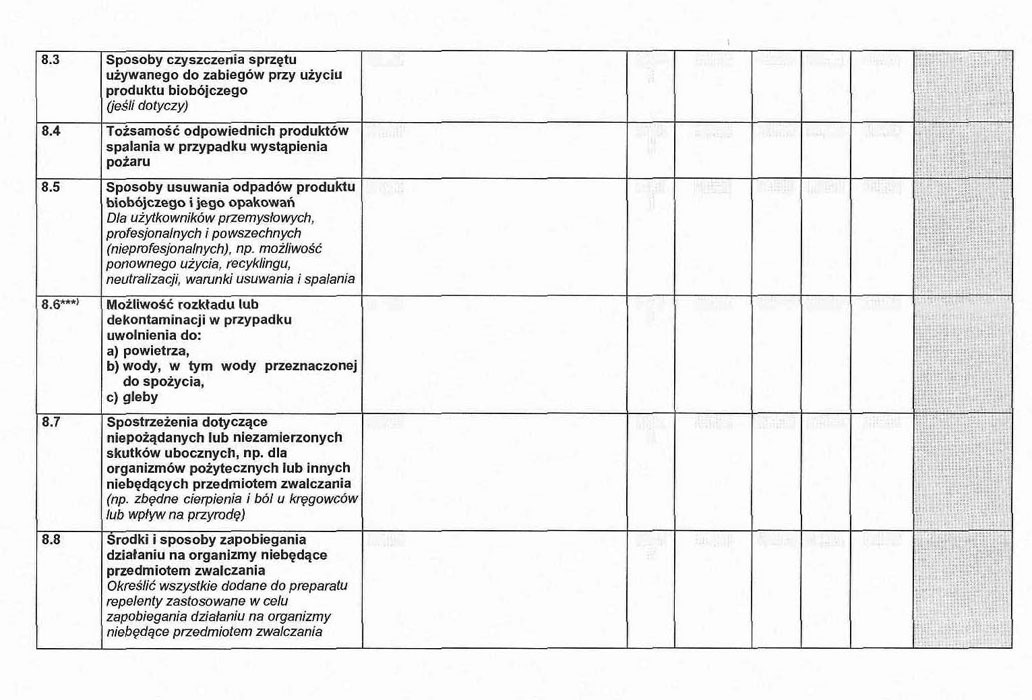
8. 1. Zalecane sposoby i środki ostrożności podczas stosowania, przechowywania, transportu i zagrożenia pożarowego.
8. 2. Szczególne postępowanie w razie awarii (np. pierwsza pomoc, odtrutki, pomoc lekarska, sposoby awaryjnego zabezpieczania środowiska, których nie wskazano w dokumentacji określonej w pkt 8.3 załącznika nr 2 do rozporządzenia).
8.3. Sposoby czyszczenia sprzętu używanego do zabiegów z użyciem produktu biobójczego.
8. 4. Tożsamość odpowiednich produktów spalania w przypadku wystąpienia pożaru.
8. 5. Sposoby usuwania odpadów produktu biobójczego i jego opakowań w przypadku użytkowników powszechnych, przemysłowych i profesjonalnych, np. możliwość ponownego użycia, recyklingu, neutralizacji, warunki usuwania i spalania.
8. 6. Możliwość rozkładu lub dekontaminacji w przypadku uwolnienia do:
a) powietrza,
b) wody, w tym wody przeznaczonej do spożycia,
c) gleby.
8. 7. Spostrzeżenia dotyczące niepożądanych lub niezamierzonych skutków ubocznych, np. dla organizmów pożytecznych lub niebędących przedmiotem zwalczania.
8. 8. Repelenty dodawane do opakowania preparatu lub inne sposoby zapobiegające szkodliwemu działaniu produktu biobójczego na organizmy niebędące przedmiotem zwalczania.
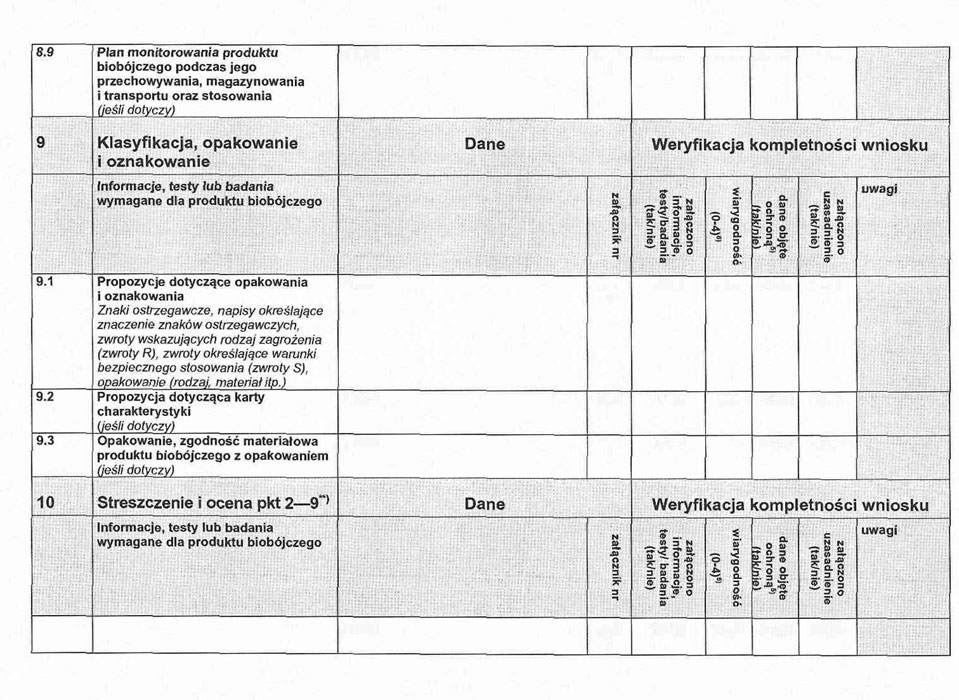
IX. Klasyfikacja, opakowanie i oznakowanie
9. 1. Propozycje dotyczące opakowania i oznakowania.
9. 2. Karta(y) charakterystyki (w przypadkach, w których ma to zastosowanie).
9. 3. Uzasadnienie dla klasyfikacji i oznakowania zgodnych z art. 44 ustawy z dnia 13 września 2002 r. o produktach biobójczych, dotyczące:
a) znaku lub znaków ostrzegawczych,
b) napisów określających znaczenie znaku ostrzegawczego,
c) zwrotów wskazujących rodzaj zagrożenia (zwroty R),
d) zwrotów określających warunki bezpiecznego stosowania (zwroty S),
e) opakowania (rodzaj, użyte materiały, rozmiar itp.), zgodności materiałowej produktu z opakowaniem.
X. Streszczenie i ocena części II–IX
Objaśnienie:
1) Badanie drażnienia oka nie jest wymagane, jeżeli produkt biobójczy ma potencjalne właściwości żrące.
Załącznik nr 5
WYMAGANIA DODATKOWE, JAKIM POWINNA ODPOWIADAĆ DOKUMENTACJA NIEZBĘDNA DO OCENY PRODUKTU BIOBÓJCZEGO ZAWIERAJĄCEGO SUBSTANCJĘ CZYNNĄ
Wymagania ogólne
1. Dokumentacja musi zawierać przynajmniej dane, o których mowa w częściach I–X załącznika nr 4 do rozporządzenia. Dokumentacja musi uwzględniać aktualny stan wiedzy naukowej i technicznej.
2. Informacje, które nie są niezbędne ze względu na rodzaj produktu biobójczego lub jego zamierzone wykorzystanie, nie muszą być przedłożone. To samo odnosi się do przypadku, gdy dostarczenie tego rodzaju informacji jest z naukowego punktu widzenia zbyteczne lub technicznie niemożliwe. W takich przypadkach należy przekazać uzasadnienie. Takim uzasadnieniem może być receptura ramowa, do której podmiot odpowiedzialny ma prawo dostępu.
3. Informacje mogą pochodzić z istniejących danych, o ile przedstawi się możliwe do zaakceptowania uzasadnienie. W szczególności, zawsze gdy jest to możliwe, należy ograniczyć do minimum doświadczenia przeprowadzane na zwierzętach.
Wymagania szczegółowe
I. Dalsze badania dotyczące wpływu na zdrowie ludzi
1. 1. Badania dotyczące żywności i pasz.
1. 1.1. Jeżeli w paszach przez istotny okres stwierdza się pozostałości substancji czynnej, wymagane są wyniki badań żywieniowych i metabolizmu u zwierząt gospodarskich w celu oceny pozostałości w żywności pochodzenia zwierzęcego.
1. 1.2. Wpływ przetwórstwa przemysłowego i przygotowania w warunkach domowych na rodzaj i ilość pozostałości substancji czynnej.
1. 2. Inne badania odnoszące się do narażenia ludzi.
W uzasadnionych przypadkach będą wymagane inne badania produktu biobójczego.
II. Dalsze badania losów i zachowania się w środowisku
2. 1. W przypadkach, w których ma to zastosowanie, wszystkie dane wymagane w części VII załącznika nr 3 do rozporządzenia.
2. 2. Badanie rozmieszczenia i rozprzestrzeniania się w glebie, wodzie, powietrzu.
2. 3. Wymagania, o których mowa w pkt 2.1 i 2.2, dotyczą wyłącznie składników produktu biobójczego mających istotne znaczenie ekotoksykologiczne.
III. Dalsze badania ekotoksykołogiczne
3.1. Wpływ na ptaki.
3. 1.1. Toksyczność ostra pokarmowa, jeżeli nie wykonano tych badań zgodnie z częścią VII załącznika nr 4 do rozporządzenia.
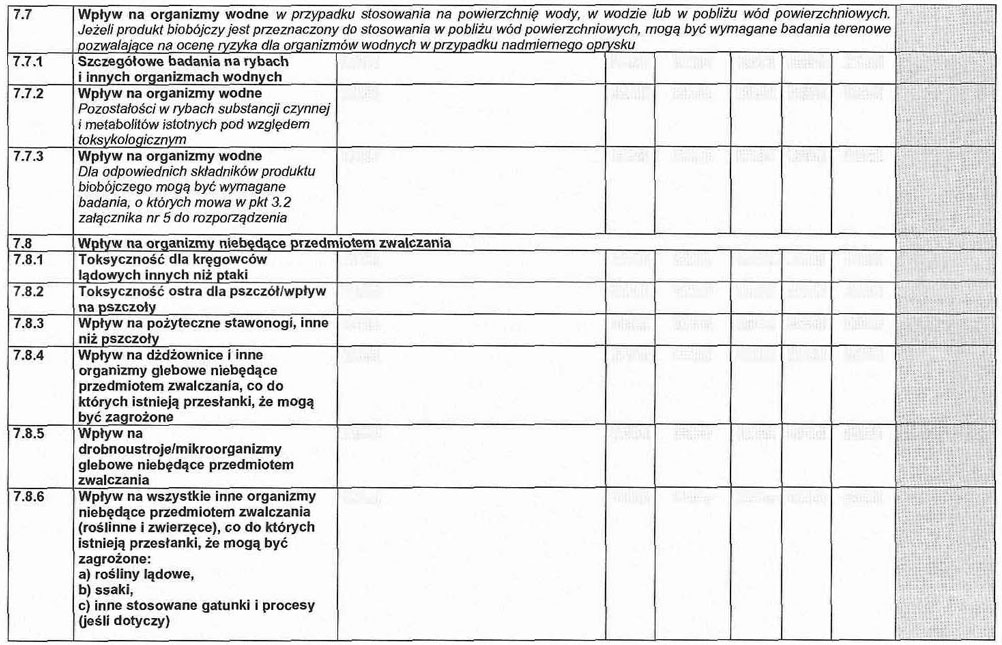
3. 2. Wpływ na organizmy wodne.
3. 2.1. W przypadku stosowania na powierzchnię wody, w wodzie lub w pobliżu wód powierzchniowych.
3. 2.1.1. Szczegółowe badania na rybach i innych organizmach wodnych.
3. 2.1.2. Pozostałości w rybach substancji czynnej i metabolitów istotnych pod względem toksykologicznym.
3. 2.1.3. Dla odpowiednich składników produktu biobójczego mogą być wymagane badania, o których mowa w pkt 8.1–8.4 załącznika nr 3 do rozporządzenia.
3. 2.2. Jeżeli produkt biobójczy jest przeznaczony do stosowania w pobliżu wód powierzchniowych, mogą być wymagane badania terenowe pozwalające na ocenę ryzyka dla organizmów wodnych w przypadku nadmiernego oprysku.
3. 3. Wpływ na organizmy niebędące przedmiotem zwalczania.
3. 3.1. Toksyczność dla kręgowców lądowych innych niż ptaki.
3. 3.2. Toksyczność ostra dla pszczół.
3. 3.3. Wpływ na pożyteczne stawonogi inne niż pszczoły.
3. 3.4. Wpływ na dżdżownice i inne organizmy glebowe niebędące przedmiotem zwalczania, co do których istnieją przesłanki, że mogą być zagrożone.
3. 3.5. Wpływ na drobnoustroje glebowe niebędące przedmiotem zwalczania.
3. 3.6. Wpływ na wszystkie inne organizmy niebędące przedmiotem zwalczania (rośliny i zwierzęta), co do których istnieją przesłanki, że mogą być zagrożone.
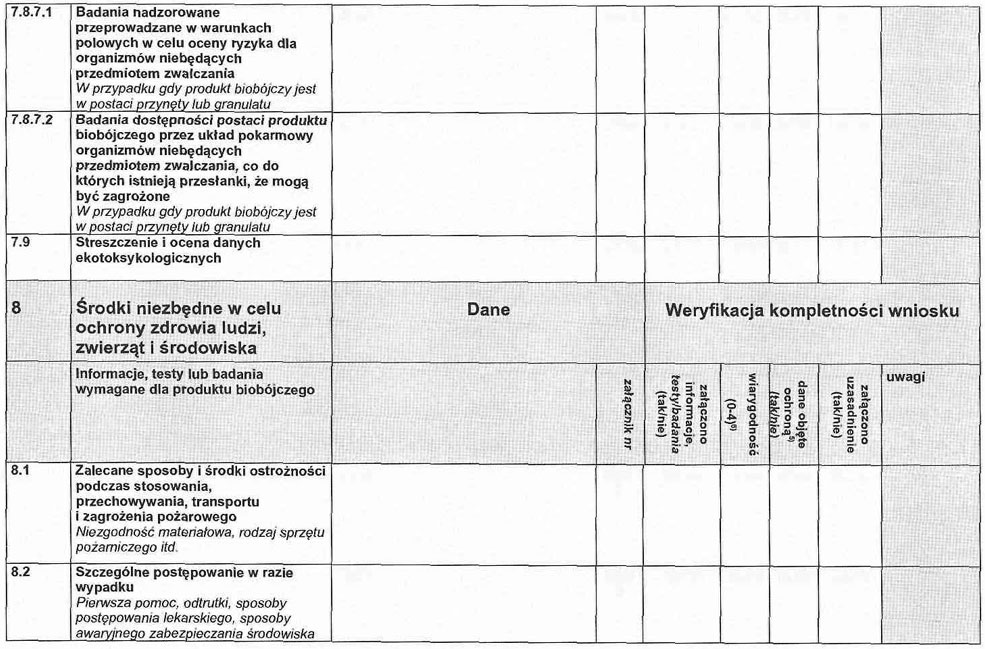
3. 3.7. Produkt biobójczy w postaci przynęty lub granulatu.
3. 3.7.1. Badania nadzorowane przeprowadzane w warunkach polowych w celu oszacowania ryzyka dla organizmów niebędących przedmiotem zwalczania.
3. 3.7.2. Badania dostępności produktu biobójczego przez układ pokarmowy organizmów niebędących przedmiotem zwalczania, co do których istnieją przesłanki, że mogą być zagrożone.
3. 4. Streszczenie i ocena pkt 3.1–3.3.
Załącznik nr 6
WYMAGANIA, JAKIM POWINNA ODPOWIADAĆ DOKUMENTACJA NIEZBĘDNA DO OCENY SUBSTANCJI CZYNNEJ, JAKĄ SĄ MIKROORGANIZMY, W TYM TAKŻE WIRUSY I GRZYBY, ZAWARTE W PRODUKCIE BIOBÓJCZYM
Wymagania ogólne
1. Dokumentacja musi zawierać przynajmniej dane, o których mowa w częściach I–X. W przypadku wszystkich mikroorganizmów objętych wymogiem złożenia wniosku o włączenie do ewidencji substancji czynnych należy dostarczyć wszelkie dostępne informacje, w tym zawarte w literaturze fachowej. Ilekroć w niniejszym załączniku jest mowa o mikroorganizmach, rozumie się przez to również wirusy i grzyby.
2. Dokumentację należy przygotowywać na poziomie szczepu mikroorganizmu, chyba że przedłożono informacje, z których wynika, że dany gatunek jest znany jako wystarczająco jednorodny pod względem właściwości lub podmiot odpowiedzialny przedstawił inne argumenty.
3. Jeśli mikroorganizm został genetycznie zmodyfikowany w rozumieniu art. 3 pkt 2 ustawy z dnia 22 czerwca 2001 r. o organizmach genetycznie zmodyfikowanych (Dz. U. z 2007 r. Nr 36, poz. 233), należy również przedłożyć kopię oceny danych na temat oceny ryzyka dla środowiska.
4. Jeśli wiadomo, że działanie produktu biobójczego wynika częściowo lub w całości z wpływu toksyny/metabolitu, lub jeśli można spodziewać się znacznych pozostałości toksyn/metabolitów niezwiązanych z działaniem czynnego mikroorganizmu, należy dla danej toksyny/danego metabolitu przedłożyć dokumentację zgodną z wymogami określonymi w załączniku nr 2 do rozporządzenia oraz przewidzianymi dla odpowiednich części dokumentacji określonej w załączniku nr 3 do rozporządzenia.
Dokumentacja obejmuje następujące części:
I. Tożsamość mikroorganizmu.
II. Właściwości biologiczne mikroorganizmu.
III. Dalsze informacje dotyczące mikroorganizmu.
IV. Metody analityczne.
V. Wpływ na zdrowie ludzi.
VI. Pozostałości w lub na wyrobach, żywności i paszach poddanych działaniu produktu biobójczego.
VII. Losy i zachowanie się w środowisku.
VIII. Wpływ na organizmy niebędące przedmiotem zwalczania.
IX. Klasyfikacja i oznakowanie.
X. Streszczenie i ocena części I–IX wraz z wnioskami z oceny ryzyka i zaleceniami.
Wymagania szczegółowe
I. Tożsamość mikroorganizmu
1. 1. Podmiot odpowiedzialny.
1. 2. Wytwórca mikroorganizmu.
1. 3. Nazwa i opis gatunku, charakterystyka szczepu.
1. 3.1. Nazwa zwyczajowa mikroorganizmu (łącznie z dawnymi i alternatywnymi nazwami).
1. 3.2. Nazwa taksonomiczna i szczep ze wskazaniem, czy chodzi o odmianę, mutację szczepu lub organizm zmodyfikowany genetycznie (GMO); w przypadku wirusów – grupa taksonomiczna, serotyp, szczep lub mutant.
1. 3.3. Nazwa kolekcji i numer referencyjny kolekcji, w której znajduje się zdeponowana hodowla.
1. 3.4. Metody, procedury i kryteria wykorzystywane do stwierdzenia obecności oraz określenia tożsamości mikroorganizmu (np.: morfologiczne, biochemiczne, serologiczne itp.).
1. 4. Specyfikacja materiału wykorzystywanego do wytwarzania gotowych produktów.
1. 4.1. Zawartość mikroorganizmu.
1. 4.2. Identyfikacja i zawartość zanieczyszczeń, dodatków i innych mikroorganizmów.
1. 4.3. Profil analityczny serii.
II. Właściwości biologiczne mikroorganizmu
2. 1. Historia mikroorganizmu i jego zastosowań. Występowanie w warunkach naturalnych i rozmieszczenie geograficzne.
2. 1.1. Historia mikroorganizmu i jego zastosowań.
2. 1.2. Pochodzenie i występowanie w warunkach naturalnych.
2. 2. Informacje dotyczące organizmów będących przedmiotem zwalczania.
2. 2.1. Opis organizmów będących przedmiotem zwalczania.
2. 2.2. Sposób działania.
2. 3. Zakres swoistości żywiciela i wpływ na gatunki inne niż organizm(y) będący(e) przedmiotem zwalczania.
2. 4. Stadia rozwoju/cykl życiowy mikroorganizmu.
2. 5. Zakaźność, zdolność do rozprzestrzeniania się i kolonizacji.
2.6. Pokrewieństwo ze znanymi patogenami roślin, zwierząt lub ludzi.
2. 7. Stabilność genetyczna i wpływające na nią czynniki.
2. 8. Informacje dotyczące wytwarzania metabolitów (w szczególności toksyn).
2. 9. Antybiotyki i inne środki zwalczające mikroorganizmy.
2. 10. Odporność na czynniki środowiskowe.
2. 11. Działanie na materiały, substancje i produkty.
III. Dalsze informacje na temat mikroorganizmu
3. 1. Funkcja.
3. 2. Przewidziany obszar stosowania.
3. 3. Grupa(y) produktów i rodzaje użytkowników, w odniesieniu do których mikroorganizm powinien zostać wpisany do ewidencji substancji czynnych.
3. 4. Metoda produkcji i kontrola jakości.
3. 5. Informacje dotyczące występowania lub możliwości wystąpienia odporności organizmów będących przedmiotem zwalczania.
3. 6. Metody zapobiegania spadkowi wirulencji hodowli macierzystej mikroorganizmu.
3. 7. Zalecane metody i środki ostrożności dotyczące sposobu postępowania podczas przechowywania, transportu lub zagrożenia pożarowego.
3. 8. Sposoby niszczenia i dekontaminacji.
3. 9. Sposób postępowania w razie wypadku.
3. 10. Sposób postępowania z odpadami.
3. 11. Plan monitorowania mikroorganizmu podczas jego przechowywania, magazynowania i transportu oraz stosowania.
IV. Metody analityczne
4. 1. Metody analizy stosowane wobec mikroorganizmu w postaci, w jakiej został wyprodukowany.
4. 2. Metody oznaczania ilościowego pozostałości zdolnych i niezdolnych do przeżycia.
V. Wpływ na zdrowie ludzi
5. 1. Informacje podstawowe.
5. 1.1. Dane medyczne.
5. 1.2. Kontrola stanu zdrowia pracowników zatrudnionych w miejscu wytwarzania mikroorganizmu.
5. 1.3. Obserwacje dotyczące działania uczulającego/alergizującego.
5. 1.4. Obserwacje bezpośrednie, np. przypadki kliniczne.
5. 2. Badania podstawowe.
5. 2.1. Działanie uczulające.
5. 2.2. Toksyczność ostra, chorobotwórczość i zakaźność.
5. 2.2.1. Toksyczność ostra pokarmowa, chorobotwórczość i zakaźność.
5. 2.2.2. Toksyczność ostra inhalacyjna, chorobotwórczość i zakaźność.
5. 2.2.3. Jednorazowa dawka podana dootrzewnowo/podskórnie.
5. 2.3. Badanie genotoksyczności in vitro.
5. 2.4. Badanie hodowli komórkowych.
5. 2.5. Informacje dotyczące toksyczności krótkoterminowej i chorobotwórczości.
5. 2.5.1. Wpływ powtarzalnego narażenia drogą inhalacyjną.
5. 2.6. Proponowane leczenie: udzielanie pierwszej pomocy, postępowanie medyczne.
5. 2.7. Wszelka chorobotwórczość i zakaźność dla ludzi i innych ssaków w warunkach immunosupresji.
5. 3. Specyficzne badania toksyczności, chorobotwórczości i zakaźności.
5. 4. Genotoksyczność – badania in vivo w komórkach somatycznych.
5. 5. Genotoksyczność – badania in vivo w komórkach płciowych.
5. 6. Streszczenie dotyczące toksyczności, chorobotwórczości i zakaźności dla ssaków oraz ocena ogólna.
VI. Pozostałości w lub na wyrobach, żywności i paszach poddanych działaniu produktu biobójczego
6. 1. Trwałość i prawdopodobieństwo namnażania w lub na wyrobach, żywności i paszach poddanych działaniu produktu biobójczego.
6. 2. Dalsze wymagania.
6. 2.1. Pozostałości niewykazujące zdolności do życia.
6. 2.2. Pozostałości wykazujące zdolność do życia.
6. 3. Streszczenie i ocena pozostałości w lub na wyrobach, żywności i paszach poddanych działaniu produktu biobójczego.
VII. Losy i zachowanie się w środowisku
7. 1. Trwałość i namnażanie.
7. 1.1. Gleba.
7. 1.2. Woda.
7.1.3. Powietrze.
7.2. Mobilność.
7.3. Streszczenie i ocena losów oraz zachowania w środowisku.
VIII. Wpływ na organizmy niebędące przedmiotem zwalczania
8.1. Wpływ na ptaki.
8.2. Wpływ na organizmy wodne.
8.2.1. Wpływ na ryby.
8.2.2. Wpływ na kręgowce słodkowodne.
8.2.3. Wpływ na wzrost glonów.
8.2.4. Wpływ na rośliny inne niż glony.
8.3. Wpływ na pszczoły.
8.4. Wpływ na stawonogi inne niż pszczoły.
8.5. Wpływ na dżdżownice.
8.6. Wpływ na mikroorganizmy glebowe.
8.7. Dalsze badania.
8.7.1. Roślin lądowych.
8.7.2. Ssaków.
8.7.3. Innych stosownych gatunków i procesów.
8.8. Streszczenie i ocena wpływu na organizmy niebędące przedmiotem zwalczania.
IX. Klasyfikacja i oznakowanie
Dokumentacja musi obejmować propozycje przypisania substancji czynnej będącej mikroorganizmem do jednej z grup zagrożenia określonych w rozporządzeniu Ministra Zdrowia z dnia 22 kwietnia 2005 r. w sprawie szkodliwych czynników biologicznych dla zdrowia w środowisku pracy oraz ochrony zdrowia pracowników zawodowo narażonych na te czynniki (Dz. U. Nr 81, poz. 716 oraz z 2008 r. Nr 48, poz. 288) wraz ze wskazaniami dotyczącymi wymogów oznaczenia produktów znakiem zagrożenia biologicznego.
X. Streszczenie i ocena części I–IX wraz z wnioskami z oceny ryzyka i zaleceniami
Załącznik nr 7
WYMAGANIA, JAKIM POWINNA ODPOWIADAĆ DOKUMENTACJA NIEZBĘDNA DO OCENY PRODUKTU BIOBÓJCZEGO ZAWIERAJĄCEGO JAKO SUBSTANCJĘ CZYNNĄ MIKROORGANIZMY, W TYM TAKŻE WIRUSY I GRZYBY
Wymagania ogólne
1. Dokumentacja musi zawierać przynajmniej dane, o których mowa w częściach I–XII. W przypadku wszystkich produktów biobójczych zawierających mikroorganizmy, objętych wymogiem złożenia wniosku, należy dostarczyć wszelkie dostępne informacje, w tym zawarte w literaturze fachowej. Ilekroć w niniejszym załączniku jest mowa o mikroorganizmach, rozumie się przez to również wirusy i grzyby.
2. Informacje mogą pochodzić z istniejących danych, o ile przedstawi się możliwe do zaakceptowania uzasadnienie. W szczególności, zawsze gdy jest to możliwe, należy ograniczyć do minimum doświadczenia przeprowadzane na zwierzętach.
3. W przypadku wykonywania badania należy zgodnie z wymaganiami określonymi w części II przedstawić szczegółowy opis (specyfikację) użytego materiału i zawartych w nim zanieczyszczeń. W razie konieczności wymagane są dane określone w załącznikach nr 4 i 5 do rozporządzenia dotyczące wszystkich składników chemicznych produktu biobójczego mających znaczenie z punktu widzenia toksyczności/ekotoksyczności, zwłaszcza jeśli składniki te są substancjami potencjalnie niebezpiecznymi.
4. W przypadku badania nowego preparatu dopuszczalna jest ekstrapolacja danych z załącznika nr 6 do rozporządzenia, pod warunkiem że ocenie zostanie poddany każdy możliwy rodzaj wpływu składników, w szczególności w zakresie patogeniczności i infekcyjności.
Dokumentacja obejmuje następujące części:
I. Tożsamość produktu biobójczego.
II. Właściwości fizyczne, chemiczne i cechy techniczne produktu biobójczego.
III. Dane dotyczące stosowania.
IV. Dalsze informacje na temat produktu biobójczego.
V. Metody analityczne.
VI. Dane dotyczące skuteczności.
VII. Wpływ na zdrowie ludzi.
VIII. Pozostałości w lub na wyrobach, żywności i paszach poddanych działaniu produktu biobójczego.
IX. Losy i zachowanie się w środowisku.
X. Wpływ na organizmy niebędące przedmiotem zwalczania.
XI. Klasyfikacja, opakowanie i oznakowanie produktu biobójczego.
XII. Streszczenie i ocena części I–XI wraz z wnioskami z oceny ryzyka i zaleceniami.
Wymagania szczegółowe
I. Tożsamość produktu biobójczego
1.1. Podmiot odpowiedzialny.
1.2. Wytwórca produktu biobójczego i mikroorganizmów.
1.3. Nazwa handlowa lub proponowana nazwa handlowa oraz numer kodowy produktu biobójczego.
1.4. Szczegółowe informacje ilościowe i jakościowe dotyczące składu produktu biobójczego.
1.5. Stan skupienia i postać użytkowa produktu biobójczego.
1.6. Działanie (np. produkt bakteriobójczy, grzybobójczy, do zwalczania gryzoni i owadów).
II. Właściwości fizyczne, chemiczne i cechy techniczne produktu biobójczego
2.1. Wygląd (barwa i zapach).
2.2. Trwałość i okres ważności.
2.2.1. Wpływ światła, temperatury i wilgotności na cechy techniczne produktu biobójczego.
2.2.2. Inne czynniki mające wpływ na trwałość.
2.3. Właściwości wybuchowe i utleniające.
2.4. Temperatura zapłonu i inne informacje o palności lub samozapłonie.
2.5. Kwasowość/zasadowość, wartość pH.
2.6. Lepkość i napięcie powierzchniowe.
2.7. Cechy techniczne produktu biobójczego.
2.7.1. Zwilżalność.
2.7.2. Trwałość piany.
2.7.3. Zawieszalność i trwałość zawiesiny.
2.7.4. Analiza sitowa na sucho i analiza sitowa na mokro.
2.7.5. Rozkład wielkości cząstek (proszki do opylania, sporządzania zawiesiny wodnej, granule), udział pyłu drobnego (granule), ścieranie i kruszenie (granule).
2.7.6. Zdolność emulgowania, reemulgowania, trwałość emulsji.
2.7.7. Zdolność do płynięcia, wylewność i pylistość.
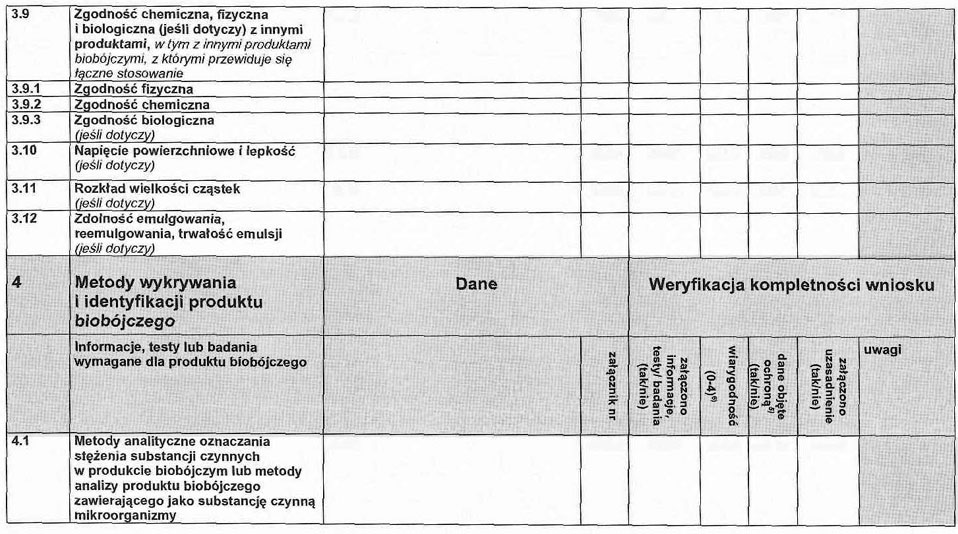
2.8. Zgodność fizyczna, chemiczna i biologiczna z innymi produktami, włączając inne produkty biobójcze, z którymi użycie produktu jest dopuszczone.
2.8.1. Zgodność fizyczna.
2.8.2. Zgodność chemiczna.
2.8.3. Zgodność biologiczna.
2.9. Streszczenie i ocena właściwości fizycznych, chemicznych i technicznych produktu biobójczego.
III. Dane dotyczące stosowania
3.1. Zakres stosowania.
3.2. Mechanizm działania.
3.3. Szczegółowe dane dotyczące zamierzonego stosowania.
3.4. Dawka.
3.5. Zawartość mikroorganizmu w stosowanym materiale (np. w urządzeniu aplikującym lub przynęcie).
3.6. Metoda stosowania.
3.7. Liczba i terminy zastosowań oraz czas trwania ochrony.
3.8. Niezbędne okresy karencji lub inne środki ostrożności stosowane w celu zapobieżenia szkodliwemu wpływowi na zdrowie ludzi, zwierząt i środowisko.
3.9. Proponowany sposób użycia.
3.10. Rodzaj użytkownika.
3.11. Informacje dotyczące możliwości wystąpienia wzrostu oporności.
3.12. Wpływ na materiały lub produkty poddane działaniu produktu biobójczego.
IV. Dalsze informacje na temat produktu biobójczego
4.1. Opakowanie i zgodność materiałowa produktu biobójczego z opakowaniem.
4.2. Procedury czyszczenia stosowanego sprzętu.
4.3. Okresy pomiędzy kolejnymi zastosowaniami produktu biobójczego, okres ochronny lub inne środki ostrożności mające na celu ochronę zdrowia ludzi, zwierząt gospodarskich i środowiska.
4.4. Zalecane metody i środki ostrożności dotyczące postępowania z produktem, jego przechowywania, transportu lub na wypadek pożaru.
4.5. Środki podejmowane w razie awarii.
4.6. Procedury dotyczące niszczenia lub dekontaminacji produktu biobójczego i jego opakowania.
4.6.1. Kontrolowane spalanie.
4.6.2. Inne.
4.7. Plan monitorowania produktu biobójczego podczas jego przechowywania, magazynowania i transportu oraz stosowania.
V. Metody analityczne
5.1. Metody analizy produktu biobójczego.
5.2. Metody wykrywania i oznaczania ilościowego pozostałości.
VI. Dane dotyczące skuteczności
VII. Wpływ na zdrowie ludzi
7.1. Podstawowe badania toksyczności ostrej.
7.1.1. Toksyczność ostra pokarmowa.
7.1.2. Toksyczność ostra inhalacyjna.
7.1.3. Toksyczność ostra skórna.
7.2. Dodatkowe badania toksyczności ostrej.
7.2.1. Drażnienie skóry.
7.2.2. Drażnienie oka.
7.2.3. Uczulenie skóry.
7.3. Dane dotyczące narażenia.
7.4. Dostępne dane toksykologiczne dotyczące substancji innych niż substancje czynne.
7.5. Uzupełniające badania dotyczące łącznego stosowania produktów biobójczych.
7.6. Streszczenie i ocena wpływu na zdrowie ludzi.
VIII. Pozostałości w lub na wyrobach, żywności i paszach poddanych działaniu produktu biobójczego
IX. Losy i zachowanie się w środowisku
X. Wpływ na organizmy niebędące przedmiotem zwalczania
10.1. Wpływ na ptaki.
10.2. Wpływ na organizmy wodne.
10.3. Wpływ na pszczoły.
10.4. Wpływ na stawonogi inne niż pszczoły.
10.5. Wpływ na dżdżownice.
10.6. Wpływ na mikroorganizmy glebowe.
10.7. Dodatkowe badania nad innymi gatunkami lub inne specjalistyczne badania nad wybranymi organizmami niebędącymi przedmiotem zwalczania.
10.7.1. Rośliny lądowe.
10.7.2. Ssaki.
10.7.3. Inne stosowne gatunki i procesy.
10.8. Streszczenie i ocena wpływu na organizmy niebędące przedmiotem zwalczania.
XI. Klasyfikacja, opakowanie i oznakowanie produktu biobójczego
Wnioski zawierające uzasadnienie klasyfikacji i oznakowania produktu biobójczego należy składać zgodnie z art. 44 ustawy z dnia 13 września 2002 r. o produktach biobójczych. Klasyfikacja musi zawierać opis kategorii zagrożenia oraz zwroty wskazujące rodzaj zagrożenia w odniesieniu do wszystkich niebezpiecznych właściwości. Na podstawie klasyfikacji należy złożyć propozycję oznakowania obejmującą znaki ostrzegawcze, zwroty wskazujące rodzaj zagrożenia (zwroty R) oraz zwroty określające warunki bezpiecznego stosowania (zwroty S). Klasyfikacja i oznakowanie powinny dotyczyć substancji chemicznych zawartych w produkcie biobójczym. W razie konieczności należy przedłożyć próbki proponowanego opakowania. Dokumentacji musi towarzyszyć uzasadniona propozycja dotycząca przypisania do jednej z grup ryzyka określonych w rozporządzeniu Ministra Zdrowia z dnia 22 kwietnia 2005 r. w sprawie szkodliwych czynników biologicznych dla zdrowia w środowisku pracy oraz ochrony zdrowia pracowników zawodowo narażonych na te czynniki (Dz. U. Nr 81, poz. 716 oraz z 2008 r. Nr 48, poz. 288) wraz ze wskazaniami dotyczącymi wymogów oznaczenia produktów znakiem zagrożenia biologicznego.
XII. Streszczenie i ocena części I–XI wraz z wnioskami z oceny ryzyka i zaleceniami
Załącznik nr 8
SPOSÓB PRZEDSTAWIENIA DOKUMENTACJI, O KTÓREJ MOWA W ART. 8 UST. 2 I 3 USTAWY Z DNIA 13 WRZEŚNIA 2002 R. O PRODUKTACH BIOBÓJCZYCH
1. Dokumentację, o której mowa w art. 8 ust. 2 ustawy z dnia 13 września 2002 r. o produktach biobójczych, przedstawia się w następujących częściach:
1) część I – dokumentacja niezbędna do oceny skuteczności produktu biobójczego, w tym:
a) wyniki badań skuteczności produktu biobójczego, określone w części V załącznika nr 4 do rozporządzenia,
b) opis metod analitycznych dotyczących produktu biobójczego, określonych w części IV załącznika nr 4 do rozporządzenia,
c) rodzaj jednostkowego opakowania bezpośredniego, klasyfikację i oznakowanie produktu biobójczego, określone w części IX załącznika nr 4 do rozporządzenia,
d) projekt etykiety i ulotki informacyjnej produktu biobójczego, jeżeli dotyczy;
2) część II – dokumentacja substancji czynnych wchodzących w skład produktu biobójczego niskiego ryzyka, określona w załącznikach nr 2 i 3 do rozporządzenia, oraz karty charakterystyki substancji czynnych wchodzących w skład produktu biobójczego, jeżeli dotyczy;
3) część III – upoważnienie do korzystania z danych, jeżeli podmiot odpowiedzialny nie jest ich właścicielem.
2. Dokumentację, o której mowa w art. 8 ust. 3 ustawy z dnia 13 września 2002 r. o produktach biobójczych, przedstawia się w następujących częściach:
1) część I – dokumentacja niezbędna do oceny produktu biobójczego, w tym także rodzaj jednostkowego opakowania bezpośredniego, klasyfikacja i oznakowanie produktu biobójczego, określone w części IX załącznika nr 4 do rozporządzenia, oraz projekt etykiety i ulotki informacyjnej produktu biobójczego, jeżeli dotyczy;
2) część II – dokumentacja niezbędna do oceny substancji czynnych wchodzących w skład produktu biobójczego, w tym także karty charakterystyki substancji czynnych wchodzących w skład produktu biobójczego, jeżeli dotyczy;
3) część III – upoważnienie do korzystania z danych, o których mowa w częściach I i II, jeżeli podmiot odpowiedzialny nie jest ich właścicielem.
- Data ogłoszenia: 2008-06-12
- Data wejścia w życie: 2008-06-27
- Data obowiązywania: 2008-06-27
- Dokument traci ważność: 2015-12-05
REKLAMA
