REKLAMA
Dziennik Ustaw - rok 2005 nr 225 poz. 1937
ROZPORZĄDZENIE MINISTRA ZDROWIA1)
z dnia 3 listopada 2005 r.
w sprawie wzoru wniosku o wydanie zezwolenia na wytwarzanie produktów leczniczych i wzoru wniosku o wydanie zezwolenia na import produktów leczniczych
Na podstawie art. 39 ust. 4 pkt 3 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne (Dz. U. z 2004 r. Nr 53, poz. 533, z późn. zm.2)) zarządza się, co następuje:
2. Do wniosku, o którym mowa w ust. 1, dołącza się następujące dokumenty:
1) informację o zakresie wytwarzania i rodzajach produktów leczniczych, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 2 do rozporządzenia;
2) listę produktów leczniczych wytwarzanych w miejscu wytwarzania, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 3 do rozporządzenia;
3) informację zawierającą dane osób wykwalifikowanych, odpowiedzialnych za zapewnienie przed wprowadzeniem na rynek, że każda seria produktu leczniczego została wytworzona i skontrolowana zgodnie z przepisami ustawy oraz wymaganiami zawartymi w specyfikacjach i dokumentach stanowiących podstawę dopuszczenia do obrotu produktu leczniczego sporządzoną zgodnie z wzorem stanowiącym załącznik nr 4 do rozporządzenia;
4) Dokumentację Główną Wytwórni, zawierającą szczegółowe dane o zapewnieniu jakości, w tym spełnieniu wymagań Dobrej Praktyki Wytwarzania oraz o pomieszczeniach, urządzeniach technicznych i kontrolnych niezbędnych do wytwarzania, kontroli i przechowywania produktów leczniczych, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 5 do rozporządzenia, aktualną w dniu składania wniosku;
5) zaświadczenie o nadanym numerze identyfikacyjnym w krajowym rejestrze urzędowym podmiotów gospodarki narodowej (REGON).
2. Do wniosku, o którym mowa w ust. 1, dołącza się następujące dokumenty:
1) informację o zakresie importu i rodzajach produktów leczniczych, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 7 do rozporządzenia;
2) listę produktów leczniczych importowanych, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 8 do rozporządzenia;
3) informację zawierającą dane osób wykwalifikowanych, odpowiedzialnych za zapewnienie przed wprowadzeniem na rynek, że każda seria produktu leczniczego została skontrolowana zgodnie z przepisami ustawy oraz wymaganiami zawartymi w specyfikacjach i dokumentach stanowiących podstawę dopuszczenia do obrotu produktu leczniczego, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 9 do rozporządzenia;
4) Dokumentację Główną Importera, zawierającą szczegółowe dane o zapewnieniu jakości, w tym spełnieniu wymagań Dobrej Praktyki Wytwarzania oraz o pomieszczeniach, urządzeniach technicznych i kontrolnych niezbędnych do wytwarzania, kontroli i przechowywania produktów leczniczych, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 10 do rozporządzenia, aktualną w dniu składania wniosku;
5) zaświadczenie o nadanym numerze identyfikacyjnym w krajowym rejestrze urzędowym podmiotów gospodarki narodowej (REGON).
Minister Zdrowia: Z. Religa
|
|
1) Minister Zdrowia kieruje działem administracji rządowej – zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 31 października 2005 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. Nr 220, poz. 1901).
2) Zmiany tekstu jednolitego wymienionej ustawy zostały ogłoszone w Dz. U. z 2004 r. Nr 69, poz. 625, Nr 91, poz. 877, Nr 92, poz. 882, Nr 93, poz. 896, Nr 173, poz. 1808, Nr 210, poz. 2135 i Nr 273, poz. 2703 oraz z 2005 r. Nr 94, poz. 787, Nr 163, poz. 1362, Nr 179, poz. 1485 i Nr 184, poz. 1539.
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 3 listopada 2005 r. (poz. 1937)
Załącznik nr 1

Załącznik nr 2


Załącznik nr 3

Załącznik nr 4

Załącznik nr 5




Załącznik nr 6

Załącznik nr 7


Załącznik nr 8
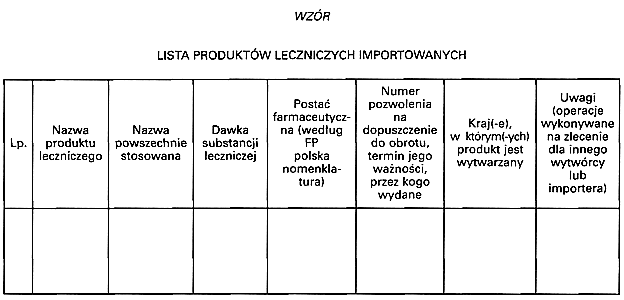
Załącznik nr 9

Załącznik nr 10




[1] Rozporządzenie wchodzi w życie 1 grudnia 2005 r.
- Data ogłoszenia: 2005-11-16
- Data wejścia w życie: 2005-12-01
- Data obowiązywania: 2005-12-01
- Dokument traci ważność: 2008-09-04
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
