REKLAMA
Dziennik Ustaw - rok 2004 nr 125 poz. 1316
ROZPORZĄDZENIE MINISTRA ZDROWIA1)
z dnia 30 kwietnia 2004 r.
w sprawie sposobu zgłaszania incydentów medycznych oraz dalszego postępowania po ich zgłoszeniu2)
Na podstawie art. 68 ustawy z dnia 20 kwietnia 2004 r. o wyrobach medycznych (Dz. U. Nr 93, poz. 896) zarządza się, co następuje:
2. Każda osoba lub każdy podmiot, niewymienione w ust. 1, mogą zgłosić incydent medyczny za pomocą faksu lub e-mailem, a następnie w formie pisemnej przesyłką pocztową lub osobiście.
1) datę, miejsce i opis incydentu medycznego, w tym jego rodzaj, rozmiar i skutki;
2) dane identyfikujące wyrób medyczny związany z incydentem, w szczególności nazwę, typ, wytwórcę, numer seryjny lub numer partii wyrobu medycznego oraz miejsce jego nabycia;
3) nazwisko, imię, zawód oraz adres osoby zgłaszającej oraz jej podpis;
4) dane osoby, która może udzielić dodatkowych informacji.
2. Zgłoszenie może być dokonane na formularzu, którego wzór określa załącznik nr 2 do rozporządzenia.
2. W celu ustalenia związku przyczynowego między wyrobem medycznym a incydentem medycznym bierze się pod uwagę następujące informacje:
1) opinię specjalistów podmiotu udzielającego świadczeń zdrowotnych, u którego wystąpił incydent medyczny;
2) wyniki wstępnej oceny incydentu medycznego dokonanej przez specjalistów;
3) zgłoszenia o dotychczas zaistniałych incydentach medycznych;
4) stwierdzone wady konstrukcyjne oraz montażowe wyrobu medycznego;
5) niedokładności w oznaczeniach, etykietach, instrukcjach używania i materiałach promocyjnych wyrobu medycznego;
6) nieprawidłowości działania spowodowane niewłaściwą obsługą, niewłaściwą konserwacją wyrobu medycznego lub jego niewłaściwym montażem;
7) inne posiadane informacje.
3. Podmiot zgłaszający incydent udziela niezbędnej pomocy wytwórcy, w tym – jeżeli jest użytkownikiem wyrobu medycznego – udostępnia go, w celu:
1) ustalenia związku przyczynowego pomiędzy wyrobem medycznym a incydentem medycznym;
2) dokonania oceny wyrobu medycznego.
4. Przeprowadzane oględziny i badania odbywają się, w miarę możliwości, w obecności przedstawiciela podmiotu, u którego wystąpił incydent medyczny, z zachowaniem należytej staranności, w taki sposób, aby nie usunąć dowodów świadczących o ewentualnym związku przyczynowym pomiędzy wyrobem medycznym a incydentem medycznym.
5. Jeżeli przeprowadzenie oględzin i badań jest niemożliwe, wytwórca niezwłocznie powiadamia o tym Prezesa Urzędu, podając przyczyny niepodjęcia tych czynności.
2. Raport Wstępny sporządza się w następujących terminach:
1) w przypadku incydentu medycznego, który doprowadził do poważnego pogorszenia zdrowia lub śmierci pacjenta lub użytkownika – w terminie nie dłuższym niż 10 dni od dnia zaistnienia;
2) w przypadku incydentu medycznego, który mógłby doprowadzić do poważnego pogorszenia zdrowia lub śmierci pacjenta lub użytkownika – w terminie nie dłuższym niż 30 dni od dnia zaistnienia.
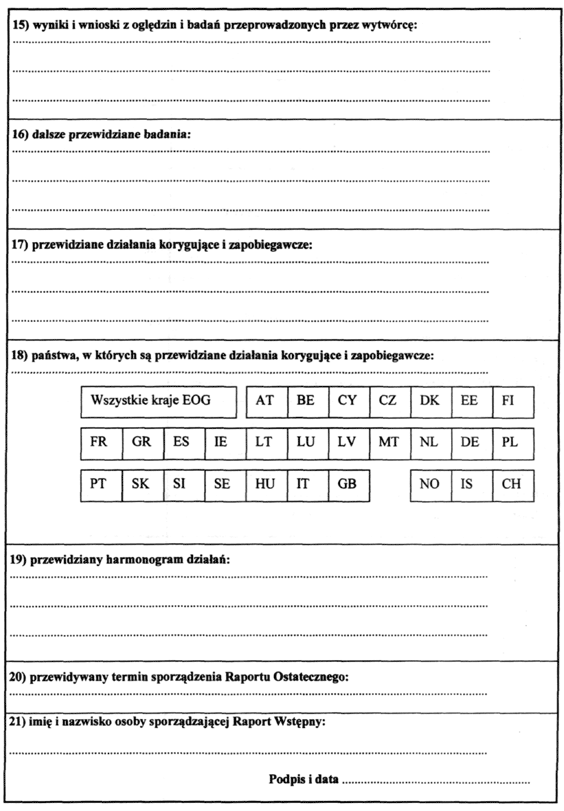
3. Wytwórca, po ustaleniu przyczyny zaistnienia incydentu medycznego, podejmuje w miarę potrzeby działania korygujące lub zapobiegawcze obejmujące w szczególności:
1) wstrzymanie w obrocie wyrobu medycznego na czas niezbędny do ustalenia wszystkich okoliczności incydentu medycznego;
2) wycofanie z obrotu lub używania wyrobu medycznego;
3) wystawienie notatki doradczej;
4) zastosowanie dodatkowego nadzoru nad wyrobami medycznymi w używaniu, w tym przeprowadzenie odpowiedniego przeszkolenia;
5) niezbędną modyfikację wyrobu medycznego w dokumentacji konstrukcyjnej i procesowej;
6) modyfikację instrukcji używania lub oznakowania wyrobu medycznego.
2. Jeżeli zastosowane przez wytwórcę działania nie są wystarczające, Prezes Urzędu, w miarę potrzeby, podejmuje czynności mające na celu wyjaśnienie przyczyn incydentu medycznego, a w szczególności:
1) współuczestniczy w nawiązaniu kontaktu pomiędzy wytwórcą a użytkownikiem, u którego wystąpił incydent medyczny;
2) zażąda od wytwórcy wykonania wybranych badań, analiz i weryfikacji przez niezależne jednostki badawcze;
3) występuje do jednostek notyfikowanych z prośbą o udzielenie informacji;
4) występuje o opinię do Komisji do Spraw Wyrobów Medycznych;
5) udziela wytycznych wytwórcy, w szczególności dotyczących:
a) wskazania zakresu badań, analiz, weryfikacji wyrobu medycznego,
b) zmiany klasyfikacji wyrobu medycznego oraz przeprowadzenia oceny zgodności,
c) wskazania terminów wykonania poszczególnych działań korygujących i zapobiegawczych,
d) wskazania zakresu wycofywania z obrotu i używania wyrobu medycznego.
2. Prezes Urzędu w przypadku stwierdzenia, że Raport Ostateczny nie zawiera wszystkich danych lub dane zawarte w Raporcie Ostatecznym nie są zgodne z informacjami przedłożonymi w Raporcie Wstępnym, wzywa wytwórcę do wyjaśnienia zaistniałej sytuacji i wyznacza termin do wprowadzenia niezbędnych zmian i uzupełnień.
3. Fakt zakończenia działań wyjaśniających po Raporcie Wstępnym lub po Raporcie Ostatecznym potwierdza się odpowiednim wpisem w Rejestrze Incydentów Medycznych.
2. Wzór formularza raportu, o którym mowa w ust. 1, określa:
1) w języku polskim – załącznik nr 5 do rozporządzenia;
2) w języku angielskim – załącznik nr 6 do rozporządzenia.
3. Fakt sporządzenia przez Prezesa Urzędu Raportu Organu Kompetentnego potwierdza się poprzez dokonanie odpowiedniego wpisu do Rejestru Incydentów Medycznych.
2. Korespondencja dotycząca incydentu medycznego prowadzona jest z zachowaniem ochrony informacji stanowiących tajemnicę służbową w rozumieniu przepisów o ochronie informacji niejawnych oraz informacji stanowiących tajemnicę przedsiębiorstw w rozumieniu przepisów o zwalczaniu nieuczciwej konkurencji.
Minister Zdrowia: L. Sikorski
|
|
1) Minister Zdrowia kieruje działem administracji rządowej – zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 28 czerwca 2002 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. Nr 93, poz. 833 oraz z 2003 r. Nr 199, poz. 1941).
2) Przepisy niniejszego rozporządzenia wdrażają postanowienia dyrektyw: Rady 90/385/EWG z dnia 20 czerwca 1990 r. w sprawie aktywnych wyrobów medycznych do implantacji (Dz. Urz. WE L 189 z 20.07.1990); Rady 93/42/EWG z dnia 14 czerwca 1992 r. w sprawie wyrobów medycznych (Dz. Urz. WE L 169 z 12.07.1993); Parlamentu Europejskiego i Rady 98/79/WE z dnia 27 października 1998 r. w sprawie wyrobów medycznych do diagnostyki in vitro (Dz. Urz. WE L 331 z 7.12.1998). Dane dotyczące ogłoszenia aktów prawa Unii Europejskiej, zamieszczone w niniejszym rozporządzeniu, z dniem uzyskania przez Rzeczpospolitą Polską członkostwa w Unii Europejskiej dotyczą ogłoszenia tych aktów w Dzienniku Urzędowym Unii Europejskiej – wydanie specjalne.
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 30 kwietnia 2004 r. (poz. 1316)
Załącznik nr 1



Załącznik nr 2


Załącznik nr 3


Załącznik nr 4



Załącznik nr 5



Załącznik nr 6

- Data ogłoszenia: 2004-06-02
- Data wejścia w życie: 2004-06-02
- Data obowiązywania: 2004-06-02
- Dokument traci ważność: 2010-09-18
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
