REKLAMA
Dziennik Ustaw - rok 2004 nr 104 poz. 1094
ROZPORZĄDZENIE MINISTRA ZDROWIA1)
z dnia 26 kwietnia 2004 r.
w sprawie środków spożywczych specjalnego przeznaczenia żywieniowego2)
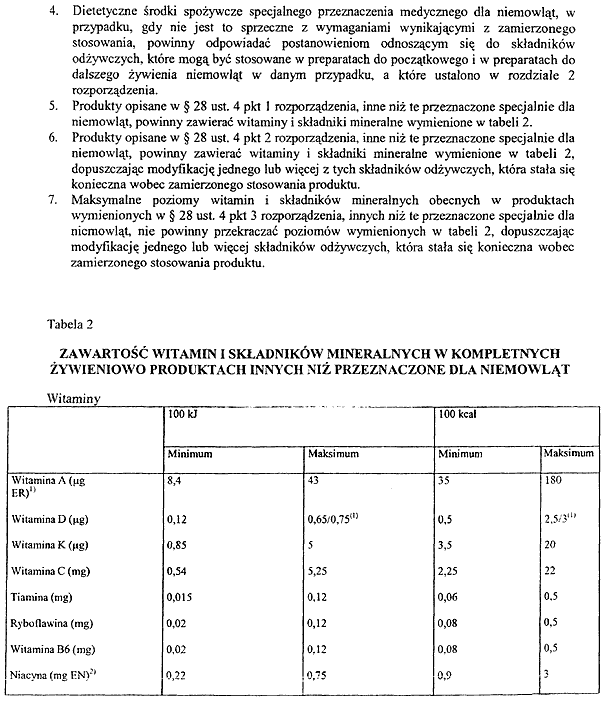
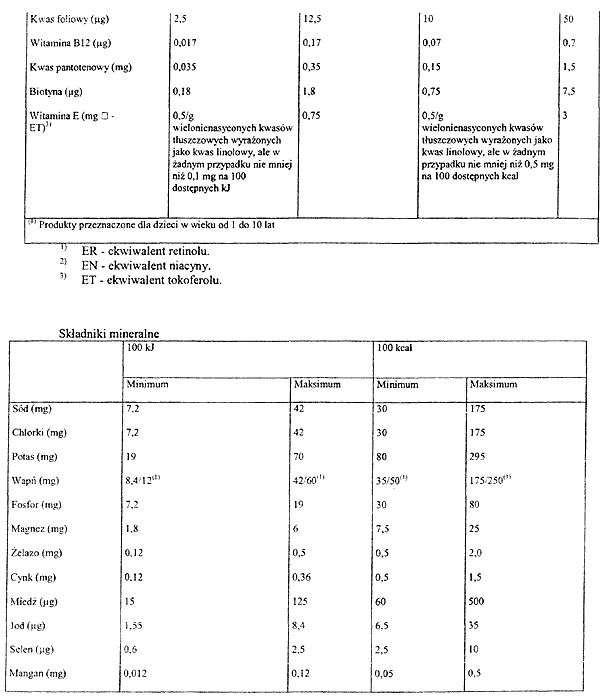
Na podstawie art. 10 ust. 3 ustawy z dnia 11 maja 2001 r. o warunkach zdrowotnych żywności i żywienia (Dz. U. Nr 63, poz. 634, z późn. zm.3)) zarządza się, co następuje:
Rozdział 1
Przepisy ogólne
§ 1.
1) grupy środków spożywczych specjalnego przeznaczenia żywieniowego;
2) szczegółowe wymagania, jakie powinny spełniać te środki;
3) sposób i formy reklamy i informacji;
4) szczegółowe wymagania dla preparatów do początkowego żywienia niemowląt i przedmiotów służących do karmienia niemowląt, w zakresie sposobu i formy reklamy i przekazywania informacji, a w szczególności:
a) niezbędne dane, jakie reklama ma zawierać, informacje, których reklama nie może przekazywać,
b) sposób przekazywania informacji,
c) sposób znakowania.
1) niemowlęta – dzieci do dwunastego miesiąca życia włącznie;
2) małe dzieci – dzieci pomiędzy pierwszym a trzecim rokiem życia włącznie.
1) preparaty do początkowego żywienia niemowląt, w tym mleko początkowe, oraz preparaty do dalszego żywienia niemowląt, w tym mleko następne;
2) środki spożywcze uzupełniające, obejmujące produkty zbożowe przetworzone i inne środki spożywcze dla niemowląt i małych dzieci;
3) środki spożywcze stosowane w dietach o ograniczonej zawartości energii, w celu redukcji masy ciała;
4) dietetyczne środki spożywcze specjalnego przeznaczenia medycznego;
5) środki spożywcze zaspokajające zapotrzebowanie organizmu przy intensywnym wysiłku fizycznym, zwłaszcza sportowców;
6) środki spożywcze dla osób z zaburzeniami metabolizmu węglowodanów (cukrzyca);
7) środki spożywcze niskosodowe, w tym sole dietetyczne o niskiej zawartości sodu lub bezsodowe;
8) środki spożywcze bezglutenowe.
1) nazwa środka spożywczego specjalnego przeznaczenia żywieniowego jest uzupełniona informacją dotyczącą szczególnych cech żywieniowych tej żywności; w przypadku żywności przeznaczonej dla niemowląt i małych dzieci w miejsce tej informacji zamieszcza się informację na temat przeznaczenia produktu;
2) w przypadku znakowania środków spożywczych specjalnego przeznaczenia żywieniowego, dla których rozporządzenie nie określa szczegółowych wymagań w zakresie jakości zdrowotnej –również:
a) skład ilościowy i jakościowy lub informacje dotyczące specjalnego procesu produkcji, nadającego produktowi szczególne wartości żywieniowe,
b) wartość dostępnej energii wyrażoną w kJ i kcal, zawartość węglowodanów, białka i tłuszczu w 100 g lub 100 ml bądź w określonej porcji produktu proponowanej do spożycia.
2. Jeżeli wartość energetyczna, o której mowa w ust. 1 pkt 2 lit. b, nie przekracza 50 kJ (12 kcal) na 100 g lub 100 ml, znakowanie może być zastąpione słowami „wartość energetyczna mniej niż 50 kJ (12 kcal) na 100 g" lub „wartość energetyczna mniej niż 50 kJ (12 kcal) na 100 ml".
3. W zakresie nieuregulowanym w rozporządzeniu do znakowania środków spożywczych specjalnego przeznaczenia żywieniowego stosuje się przepisy w sprawie znakowania środków spożywczych i dozwolonych substancji dodatkowych.
2. Środki spożywcze specjalnego przeznaczenia żywieniowego mogą być wprowadzane do obrotu w sprzedaży detalicznej w innych opakowaniach niż opakowania jednostkowe, pod warunkiem że produkt jest znakowany zgodnie z § 4.
Rozdział 2
Wymagania dla preparatów do początkowego żywienia niemowląt i preparatów do dalszego żywienia niemowląt
§ 6.
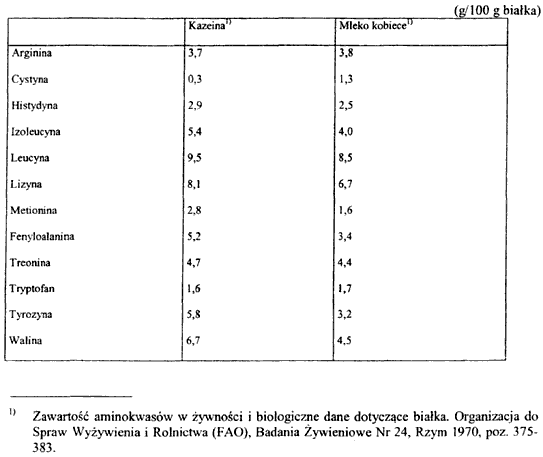
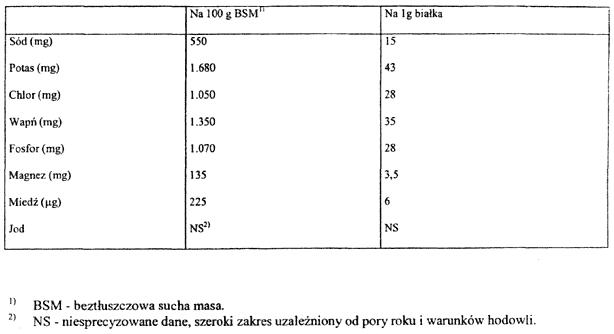
2. Podstawowy skład preparatów do dalszego żywienia niemowląt, przygotowywanych zgodnie z instrukcją producenta określa załącznik nr 4 do rozporządzenia; skład tych preparatów musi uwzględniać zawartość niezbędnych aminokwasów w mleku kobiecym określonych w załączniku nr 2 do rozporządzenia oraz skład aminokwasowy kazeiny i białka mleka kobiecego, określone w załączniku nr 3 do rozporządzenia, i składniki mineralne w mleku krowim, określone w załączniku nr 5 do rozporządzenia.
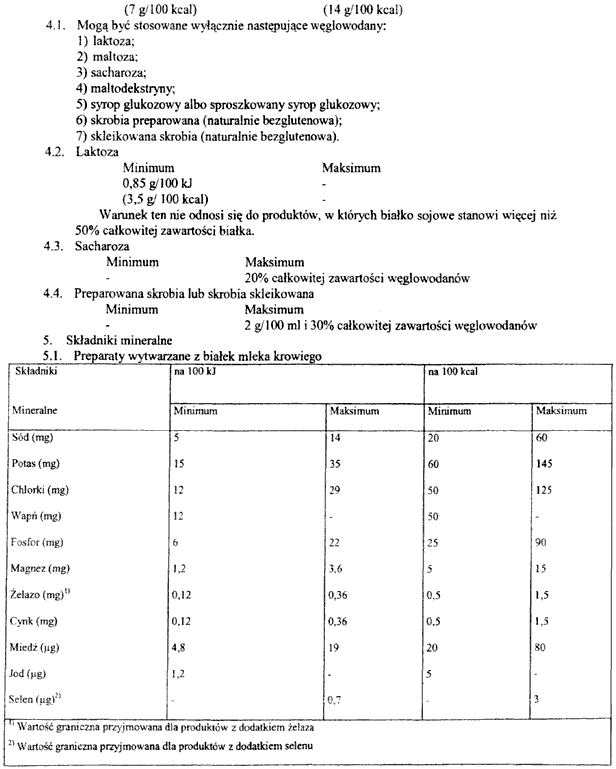
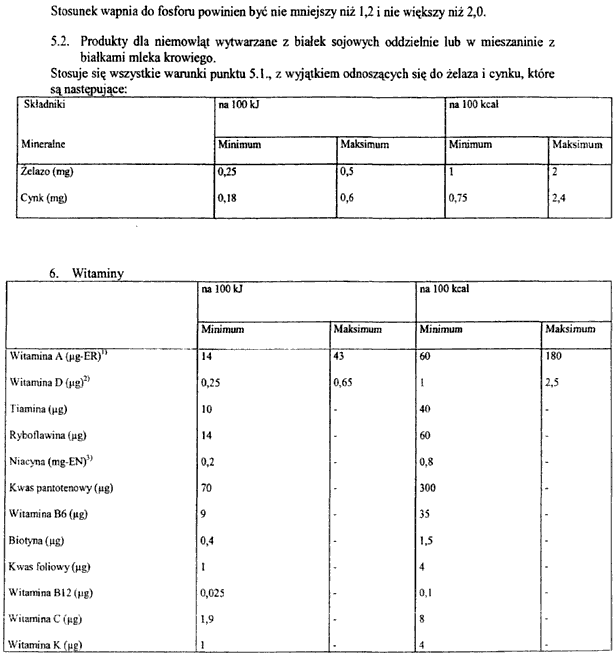
3. Składniki odżywcze, które mogą być stosowane do początkowego żywienia niemowląt oraz preparatów do dalszego żywienia niemowląt, określa załącznik nr 6 do rozporządzenia.
1) składniki mineralne,
2) witaminy,
3) aminokwasy i inne związki azotu,
4) inne substancje o szczególnym znaczeniu żywieniowym
– do produkcji preparatów do początkowego żywienia niemowląt i preparatów do dalszego żywienia niemowląt są stosowane wyłącznie składniki odżywcze wymienione w załączniku nr 6 do rozporządzenia.
2. Warunki dotyczące stosowania w preparatach do początkowego żywienia niemowląt i preparatach do dalszego żywienia niemowląt dozwolonych substancji dodatkowych określają przepisy wydane na podstawie art. 9 ust. 4 pkt 1 ustawy z dnia 11 maja 2001 r. o warunkach zdrowotnych żywności i żywienia, zwanej dalej „ustawą".
2. Maksymalne dopuszczalne poziomy takich substancji oraz kryteria czystości mikrobiologicznej określają przepisy wydane na podstawie art. 9 ust. 4a ustawy.
2. Preparaty do początkowego żywienia niemowląt i preparaty do dalszego żywienia niemowląt, wytwarzane wyłącznie z białka mleka krowiego, są wprowadzane do obrotu pod nazwami, odpowiednio: „mleko początkowe" i „mleko następne".
3. Znakowanie opakowań jednostkowych preparatów do początkowego żywienia niemowląt i preparatów do dalszego żywienia niemowląt zawiera, oprócz informacji, o których mowa w art. 24 ustawy, dodatkowo:
1) w odniesieniu do preparatu do początkowego żywienia niemowląt – informację, że produkt jest odpowiedni dla niemowląt od urodzenia, w przypadku, gdy nie są one karmione piersią;
2) w odniesieniu do preparatu do początkowego żywienia niemowląt, który nie jest wzbogacany w żelazo – informację, iż w przypadku, gdy produkt ten jest podawany niemowlętom powyżej czwartego miesiąca życia, należy uzupełnić żelazo z innych źródeł;
3) w odniesieniu do preparatu do dalszego żywienia niemowląt – informację, że produkt jest odpowiedni wyłącznie dla niemowląt powyżej czwartego miesiąca życia i że powinien stanowić tylko część zróżnicowanej diety niemowlęcia oraz że nie może zastępować mleka matki przez pierwsze cztery miesiące życia niemowlęcia;
4) w odniesieniu do preparatów do początkowego żywienia niemowląt i preparatów do dalszego żywienia niemowląt:
a) informację o wartości dostępnej energii dostarczanej przez 100 ml produktu gotowego do spożycia, wyrażonej w kJ i kcal, oraz podaną liczbowo zawartość białka, tłuszczu i węglowodanów w 100 ml tego produktu gotowego do spożycia,
b) informację o średniej zawartości każdego składnika mineralnego i każdej witaminy wymienionych odpowiednio w załącznikach nr 1 i 4 do rozporządzenia oraz podaną liczbowo zawartość choliny, inozytolu, karnityny i tauryny w 100 ml produktu gotowego do spożycia,
c) instrukcję dotyczącą odpowiedniego przygotowania produktu oraz ostrzeżenie, że niewłaściwe przygotowanie może stanowić zagrożenie dla zdrowia dziecka;
5) znakowanie preparatów do początkowego żywienia niemowląt i preparatów do dalszego żywienia niemowląt może również zawierać:
a) średnią ilość składników odżywczych wymienionych w załączniku nr 6 do rozporządzenia, jeżeli taka informacja nie została podana zgodnie z pkt 4; ilość ta powinna być podana w postaci liczbowej w 100 ml produktu gotowego do spożycia,
b) w odniesieniu do preparatów do dalszego żywienia niemowląt oprócz informacji o zawartości witamin i składników mineralnych podanych w postaci liczbowej – procent realizacji zalecanego dziennego spożycia każdej witaminy i każdego składnika mineralnego w 100 ml produktu gotowego do spożycia, zgodnie z wartościami odniesienia do znakowania żywności przeznaczonej dla niemowląt i małych dzieci określonymi wzałączniku nr 7 do rozporządzenia, pod warunkiem że zawartość ta stanowi przynajmniej 15 % zalecanego dziennego spożycia.
4. Znakowanie preparatów do początkowego żywienia niemowląt i preparatów do dalszego żywienia niemowląt obejmuje niezbędne informacje dotyczące odpowiedniego zastosowania tych produktów niezniechęcające równocześnie do karmienia piersią. Znakowanie nie powinno zawierać określeń takich, jak: „humanizowane", „umatczynione" lub podobnych. Określenie „adaptowane" może być stosowane tylko zgodnie z wymogiem zawartym w pkt 1 załącznika nr 8 do rozporządzenia określającego wymagania dotyczące składu preparatów do początkowego żywienia niemowląt i preparatów do dalszego żywienia niemowląt, uprawniające do odpowiedniej informacji żywieniowej.
5. Znakowanie preparatów do początkowego żywienia niemowląt jest dodatkowo rozszerzone o następujące informacje, poprzedzone wyrazami „Ważna informacja" lub równoważnymi:
1) informacja o wyższości karmienia piersią nad karmieniem sztucznym;
2) zalecenie stosowania preparatów do początkowego żywienia niemowląt wyłącznie po zasięgnięciu porady niezależnych osób posiadających kwalifikacje z zakresu medycyny, żywienia lub farmacji lub innych osób profesjonalnie odpowiedzialnych za opiekę nad matką i dzieckiem.
6. Znakowanie preparatów do początkowego żywienia niemowląt nie zawiera wizerunków niemowląt, jak również innych wizerunków lub tekstów zachęcających do stosowania tych produktów.
7. Znakowanie preparatów do początkowego żywienia niemowląt może zawierać znaki graficzne pozwalające na łatwą identyfikację tego produktu i ilustrację metody przygotowania produktu do spożycia.
8. Znakowanie preparatów do początkowego żywienia niemowląt może być rozszerzone o informacje dotyczące specjalnego składu tych produktów, jeżeli spełniają warunki określone w załączniku nr 8 do rozporządzenia.
9. Wymagania, zakazy i ograniczenia, o których mowa w ust. 4–8, dotyczą również:
1) prezentacji produktów, których dotyczą, a w szczególności ich kształtu, wyglądu lub opakowania, zastosowanego materiału opakowaniowego, sposobu, w jaki są rozmieszczane i wystawiane;
2) reklamy.
10. Preparaty do początkowego żywienia niemowląt znakuje się w sposób zapewniający odróżnienie tych preparatów od preparatów do dalszego żywienia niemowląt.
2. Preparaty do początkowego żywienia niemowląt i preparaty do dalszego żywienia niemowląt wywożone do państw niebędących członkami Unii Europejskiej spełniają wymagania dla tych preparatów określone w § 6–13.
2. Reklama zawiera wyłącznie informacje sprawdzone i o charakterze naukowym. Informacje takie nie mogą dawać do zrozumienia lub sugerować, że karmienie butelką jest równoważne lub lepsze od karmienia piersią.
3. W punktach sprzedaży nie można prowadzić reklamy, rozdawać próbek oraz wykonywać innych działań promocyjnych zachęcających do nabycia preparatów do początkowego żywienia niemowląt i przedmiotów służących do karmienia niemowląt, takich jak specjalne wystawy, kupony rabatowe, premie, specjalne wyprzedaże i sprzedaż wiązana.
4. Producenci i dystrybutorzy preparatów do początkowego żywienia niemowląt oraz przedmiotów służących do karmienia niemowląt nie mogą dostarczać, bezpłatnie lub po obniżonej cenie, tych preparatów i przedmiotów oraz ich próbek lub innych przedmiotów w formie upominków, do powszechnego stosowania, bezpośrednio kobietom ciężarnym, matkom niemowląt lub członkom ich rodzin, a także pośrednio poprzez podmioty udzielające świadczeń zdrowotnych, z zastrzeżeniem § 16 ust. 3.
1) korzyści płynących z karmienia naturalnego i wyższości tego karmienia nad karmieniem sztucznym;
2) właściwego żywienia kobiet karmiących oraz przygotowania do karmienia piersią i utrzymania tego procesu;
3) możliwych negatywnych skutków dla karmienia piersią w przypadku częstego dokarmiania butelką;
4) trudności w powrocie do karmienia piersią, jeżeli zostanie podjęta decyzja o karmieniu sztucznym;
5) odpowiedniego stosowania preparatu do początkowego żywienia niemowląt zarówno wyprodukowanego przemysłowo, jak i przygotowanego domowym sposobem, jeżeli jest to konieczne ze względu na prawidłowe żywienie niemowląt.
2. W przypadku gdy materiały, o których mowa w ust. 1, zawierają informacje o stosowaniu preparatów do początkowego żywienia niemowląt, powinny również informować o socjalnych i ekonomicznych skutkach ich stosowania, ryzyku, jakie niesie dla zdrowia niemowlęcia niewłaściwa żywność lub metoda karmienia i w szczególności niewłaściwe zastosowanie preparatów do początkowego żywienia niemowląt. Takie materiały nie powinny zawierać rycin propagujących karmienie sztuczne.
3. Dostarczanie materiałów informacyjnych i edukacyjnych lub przedmiotów służących do karmienia niemowląt przez przedsiębiorców produkujących lub wprowadzających do obrotu takie materiały lub przedmioty odbywa się wyłącznie na wniosek oraz na podstawie pisemnej zgody organów urzędowej kontroli żywności lub zakładów opieki zdrowotnej działających zgodnie z zaleceniami tych organów. Dostarczane materiały lub przedmioty mogą nosić znak lub logo producenta, ale bez znaku i nazwy produktu dla niemowląt.
4. Darowizna lub sprzedaż po obniżonej cenie preparatów do początkowego żywienia niemowląt i przedmiotów do karmienia niemowląt na użytek instytucji lub organizacji sprawujących opiekę nad niemowlętami mogą być dokonywane pod warunkiem jednoczesnego podania informacji o ich przeznaczeniu wyłącznie dla niemowląt karmionych sztucznie.
Rozdział 3
Wymagania dla środków spożywczych uzupełniających obejmujących produkty zbożowe przetworzone i inne środki spożywcze przeznaczone dla niemowląt i małych dzieci
§ 17.
2. Środki spożywcze, o których mowa w ust. 1, obejmują:
1) produkty zbożowe przetworzone:
a) proste produkty zbożowe, które są lub muszą być przygotowane do spożycia po dodaniu mleka lub innych odpowiednio odżywczych płynów,
b) produkty zbożowe z dodatkiem składników wysokobiałkowych, które są lub muszą być przygotowane do spożycia z dodatkiem wody lub innego płynu niezawierającego białka,
c) makarony stosowane w żywieniu po ugotowaniu w wodzie lub innych odpowiednich płynach,
d) sucharki i biszkopty, które mogą być stosowane zarówno do bezpośredniego spożycia, jak i po rozdrobnieniu, z dodatkiem wody, mleka lub innego stosownego płynu;
2) środki spożywcze uzupełniające inne niż produkty zbożowe przetworzone.
2. Podstawowy skład środków spożywczych uzupełniających innych niż produkty zbożowe przetworzone, przeznaczonych dla niemowląt i małych dzieci, określa załącznik nr 10 do rozporządzenia.
2. Maksymalne zawartości witamin i składników mineralnych dodawanych do środków spożywczych uzupełniających obejmujących produkty zbożowe przetworzone i inne środki spożywcze przeznaczone dla niemowląt i małych dzieci określa załącznik nr 12 do rozporządzenia.
1) informacje dotyczące odpowiedniego wieku dziecka, od którego produkt może być stosowany, biorąc pod uwagę jego skład, postać produktu lub inne szczególne właściwości, przy czym podany wiek dziecka nie może być niższy niż ukończone cztery miesiące życia; produkty zalecane do stosowania po ukończeniu czwartego miesiąca życia dziecka mogą być stosowane od tego wieku, chyba że osoby mające kwalifikacje z zakresu medycyny, żywienia i farmacji lub inne osoby profesjonalnie odpowiedzialne za opiekę nad matką i dzieckiem zalecą inne ich stosowanie;
2) informację o obecności lub nieobecności glutenu, jeśli wskazany wiek, od którego produkt może być stosowany, jest określony poniżej szóstego miesiąca życia dziecka;
3) średnią zawartość każdego składnika mineralnego i każdej witaminy, w oparciu o ich poziomy określone odpowiednio w załącznikach nr 9 i 10 do rozporządzenia, wyrażone w postaci liczbowej w 100 g lub 100 ml produktu wprowadzonego do obrotu oraz w odpowiedniej ilości produktu proponowanego do spożycia;
4) instrukcję właściwego przygotowania do spożycia oraz podkreślenie ważności przestrzegania tej instrukcji.
2. Znakowanie może zawierać:
1) średnie zawartości składników odżywczych określonych w załączniku nr 11 do rozporządzenia, jeżeli nie są one podane zgodnie z ust. 1 pkt 3, wyrażone w postaci liczbowej w 100 g lub 100 ml produktu wprowadzonego do obrotu oraz w odpowiedniej ilości produktu proponowanego do spożycia;
2) obok informacji liczbowej również informację o zawartości witamin i składników mineralnych określonych w załączniku nr 7 do rozporządzenia, wyrażonych jako procent realizacji zalecanego dziennego spożycia w 100 g lub 100 ml produktu wprowadzonego do obrotu oraz w odpowiedniej ilości produktu proponowanego do spożycia, jeżeli zawartość witamin i składników mineralnych wynosi co najmniej 15 % zalecanego dziennego spożycia.
Rozdział 4
Wymagania dla środków spożywczych stosowanych w dietach o ograniczonej zawartości energii w celu redukcji masy ciała
§ 24.
1) produkty przedstawiane jako zamienniki całodziennej diety;
2) produkty przedstawiane jako zamienniki jednego posiłku lub większej liczby posiłków w ciągu dnia.
1) dla produktów, o których mowa w § 24 pkt 1: „Środek spożywczy zastępujący całodzienną dietę, do kontroli masy ciała"
2) dla produktów, o których mowa w § 24 pkt 2: „Środek spożywczy zastępujący posiłek, do kontroli masy ciała".
2. Środki spożywcze, o których mowa w § 24, znakuje się zgodnie z § 4, przy czym znakowanie zawiera dodatkowo następujące informacje:
1) wartość dostępnej energii wyrażoną w kJ i kcal oraz zawartość białka, węglowodanów i tłuszczu wyrażoną liczbowo na określoną ilość produktu gotowego do spożycia, proponowanego do konsumpcji;
2) średnią zawartość każdego składnika mineralnego i każdej witaminy, dla których obowiązkowe wymagania są określone w ust. 5 załącznika nr 13 do rozporządzenia; zawartość ta jest wyrażona liczbowo, na określoną ilość produktu gotowego do spożycia proponowanego do konsumpcji; w odniesieniu do produktów wymienionych w § 24 pkt 2, informacja o witaminach i składnikach mineralnych wymienionych w tabeli zawartej w ust. 5 załącznika nr 13 do rozporządzenia powinna także być wyrażona jako procent realizacji zalecanego dziennego spożycia, zgodnie z załącznikiem nr 15 do rozporządzenia określającym witaminy i składniki mineralne, które mogą być deklarowane, oraz ich zalecane dzienne spożycie (RDA);
3) instrukcję właściwego przygotowania do spożycia oraz stwierdzenie ważności przestrzegania tej instrukcji;
4) jeżeli dany produkt, zastosowany zgodnie z zaleceniami producenta, dostarcza dzienną dawkę polioli (alkoholi wielowodorotlenowych) przekraczającą 20 g – zamieszczana jest informacja, że produkt ten może mieć działanie przeczyszczające;
5) o ważności przyjmowania odpowiedniej ilości płynów w ciągu dnia;
6) dla produktów wymienionych w § 24 pkt 1 informację, że produkt:
a) dostarcza odpowiednie, dzienne ilości wszystkich niezbędnych składników odżywczych,
b) nie powinien być stosowany przez okres dłuższy niż trzy tygodnie bez zasięgnięcia porady lekarskiej;
7) w odniesieniu do produktów wymienionych w § 24 pkt 2 – informację o tym, że produkty te stanowią tylko część diety o ograniczonej ilości energii oraz że niezbędną częścią takiej diety są inne środki spożywcze.
3. Znakowanie, reklama i prezentacja środków spożywczych, o których mowa w § 24, nie mogą dotyczyć tempa lub ilości ubytku masy ciała, które mogłyby wynikać ze stosowania tych produktów lub ich oddziaływania na zmniejszenie uczucia głodu lub wzrost uczucia sytości.
Rozdział 5
Wymagania dla dietetycznych środków spożywczych specjalnego przeznaczenia medycznego
§ 28.
2. Środki spożywcze, o których mowa w ust. 1, są przeznaczone do wyłącznego lub częściowego żywienia pacjentów z ograniczoną, upośledzoną lub zaburzoną zdolnością przyjmowania, trawienia, wchłaniania, metabolizowania lub wydalania zwykłych produktów żywnościowych lub niektórych składników odżywczych w nich zawartych, lub metabolitów.
3. Środki spożywcze, o których mowa w ust. 1, są stosowane również w odżywianiu dietetycznym pacjentów z innymi wymaganiami żywieniowymi wynikającymi z ich stanu zdrowia, jeżeli odżywianie dietetyczne nie może być stosowane tylko przez modyfikację normalnej diety, przez podawanie innych środków spożywczych specjalnego przeznaczenia żywieniowego lub przez połączenie obu tych metod.
4. Dietetyczne środki spożywcze specjalnego przeznaczenia medycznego obejmują:
1) środki spożywcze o standardowym składzie, kompletne pod względem odżywczym, które przy stosowaniu zgodnie z instrukcją producenta mogą stanowić wyłączne źródło pożywienia osób, dla których są przeznaczone (diety standardowe);
2) środki spożywcze kompletne pod względem odżywczym o składzie dostosowanym do danej choroby, zaburzenia stanu zdrowia lub wskazań lekarskich, które przy stosowaniu zgodnie z instrukcją producenta mogą stanowić wyłączne źródło pożywienia osób, dla których są przeznaczone (diety zmodyfikowane);
3) środki spożywcze niekompletne pod względem odżywczym o składzie standardowym lub o składzie dostosowanym do choroby, zaburzenia stanu zdrowia lub wskazań lekarskich, które jednak nie mogą być stosowane jako jedyne źródło pożywienia osób, dla których są przeznaczone.
5. Dietetyczne środki spożywcze specjalnego przeznaczenia medycznego wymienione w ust. 4 pkt 1 i 2 mogą być również stosowane jako uzupełnienie diety pacjenta lub jej częściowe zastępowanie.
2. Podstawowy skład środków spożywczych, o których mowa w § 28 ust. 1, określa załącznik nr 16 do rozporządzenia.
2. Środki spożywcze, o których mowa w § 28 ust. 1, znakuje się zgodnie z § 4, przy czym znakowanie zawiera dodatkowo:
1) wartość dostępnej energii wyrażoną w kJ i kcal oraz zawartość białka, węglowodanów i tłuszczu, wyrażoną w postaci liczbowej w 100 g lub 100 ml produktu wprowadzanego do obrotu oraz w 100 g lub 100 ml produktu gotowego do spożycia przygotowanego zgodnie z instrukcją producenta; informacje te mogą być dodatkowo podane na dawkę, jeżeli jej ilość jest określona na etykiecie, lub na porcję, jeżeli na etykiecie podaje się liczbę porcji w opakowaniu;
2) średnią zawartość każdego składnika mineralnego i każdej witaminy wymienionych w załączniku nr 16 do rozporządzenia, wyrażonych liczbowo w 100 g lub 100 ml produktu wprowadzanego do obrotu oraz w 100 g lub 100 ml produktu gotowego do spożycia, przygotowanego zgodnie z instrukcją producenta; informacje te mogą być dodatkowo podane na dawkę, jeżeli jej ilość jest określona na etykiecie, lub na porcję, jeżeli na etykiecie podaje się liczbę porcji w opakowaniu;
3) zawartość składników białka, węglowodanów i tłuszczu lub innych składników odżywczych i ich składników, jeżeli podanie ich jest potrzebne do właściwego stosowania produktu, przy czym dane te powinny być wyrażone liczbowo w 100 g lub 100 ml produktu wprowadzanego do obrotu, lub w 100 g lub 100 ml produktu gotowego do spożycia przygotowanego zgodnie z instrukcją producenta; informacje te mogą być dodatkowo podane na dawkę, jeżeli jej ilość jest określona na etykiecie, lub na porcję, jeżeli na etykiecie podaje się liczbę porcji w opakowaniu;
4) informację o osmolalności lub osmolarności produktu;
5) informację o pochodzeniu i charakterze białka lub hydrolizatów białka obecnych w produkcie;
6) informacje, poprzedzone wyrazami „ważna informacja" lub innymi równoważnymi:
a) że produkt jest przyjmowany pod nadzorem lekarza,
b) czy produkt jest odpowiedni do stosowania jako jedyne źródło pożywienia,
c) że produkt przeznaczony jest dla określonej grupy wiekowej,
d) że produkt stanowi zagrożenie dla zdrowia, jeżeli jest spożywany przez osoby niemające określonej choroby, zaburzenia stanu zdrowia, lub brak jest wskazań lekarskich, dla których produkt jest przeznaczony;
7) informację: „Do postępowania dietetycznego", obok której należy wskazać wolne miejsce do uzupełnienia o nazwę choroby, zaburzenia stanu zdrowia lub wskazania lekarskie dotyczące stosowania środka spożywczego;
8) informację o odpowiednich środkach ostrożności i przeciwwskazaniach;
9) opis właściwości lub cech charakterystycznych, ze względu na które stosowanie produktu jest uzasadnione, w szczególności ze względu na składniki odżywcze, których zawartość zwiększono, zmniejszono, wyeliminowano lub w inny sposób zmodyfikowano, oraz uzasadnienie stosowania produktu;
10) ostrzeżenie, że produkt nie jest przeznaczony do stosowania pozajelitowego;
11) instrukcję właściwego przygotowania, sposobu użycia i przechowywania produktu po otworzeniu opakowania.
Rozdział 6
Substancje, które mogą być dodawane w określonych celach odżywczych do środków spożywczych specjalnego przeznaczenia żywieniowego
§ 31.
2. Do produkcji środków spożywczych specjalnego przeznaczenia żywieniowego mogą być stosowane inne substancje chemiczne dodawane w określonych celach odżywczych, nienależące do kategorii wymienionych w załączniku nr 17 do rozporządzenia, pod warunkiem że spełniają wymagania dotyczące nowej żywności i nowych składników żywności określone w rozporządzeniu (WE) nr 258/97 Parlamentu Europejskiego i Rady z dnia 27 stycznia 1997 r. dotyczącego nowej żywności i nowych składników żywności (Dz. Urz. WE L 43 z 14.02.1997, z późn. zm.).
3. Stosowanie substancji odżywczych do produkcji środków spożywczych specjalnego przeznaczenia żywieniowego powinno być zgodne z ogólnie przyjętymi danymi naukowymi oraz uwzględniać przeznaczenie tych środków jako spełniających szczególne wymogi odżywcze.
Rozdział 7
Przepisy przejściowe i końcowe
§ 32.
Minister Zdrowia: L. Sikorski
|
|
1) Minister Zdrowia kieruje działem administracji rządowej – zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 28 czerwca 2002 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. Nr 93, poz. 833 oraz z 2003 r. Nr 199, poz. 1941).
2) Przepisy niniejszego rozporządzenie wdrażają postanowienia:
1) dyrektywy 89/398/EWG z dnia 3 maja 1989 r. w sprawie zbliżenia ustawodawstw państw członkowskich odnoszących się do środków spożywczych specjalnego przeznaczenia żywieniowego (Dz. Urz. WE L 186 z 30.06.1989),
2) dyrektywy 91/321/EWG z dnia 14 maja 1991 r. w sprawie preparatów dla niemowląt i preparatów pochodnych (Dz. Urz. WE L175z04.07.1991),
3) dyrektywy 92/52/EWG z dnia 18 czerwca 1992 r. w sprawie preparatów dla niemowląt i receptur przeznaczonych na wywóz do państw trzecich (Dz. Urz. WE L 179 z 01.07.1992),
4) dyrektywy 96/4/WE z dnia 16 lutego 1996 r. poprawiającej dyrektywę 91/321/EWG w sprawie preparatów dla niemowląt i preparatów pochodnych (Dz. Urz. WE L 49 z 28.02.1996),
5) dyrektywy 96/5/WE z dnia 16 lutego 1996 r. w sprawie przetworzonej żywności na bazie zbóż oraz żywności dla niemowląt i małych dzieci (Dz. Urz. WE L 49 z 28.02.1996),
6) dyrektywy 96/8/WE z dnia 26 lutego 1996 r. w sprawie żywności przeznaczonej do użycia w dietach o obniżonej energetyczności (Dz. Urz. WE L 55 z 06.03.1996),
7) dyrektywy 96/84/WE z dnia 19 grudnia 1996 r. zmieniającej dyrektywę 89/398/EWG w sprawie zbliżenia ustawodawstw Państw Członkowskich odnoszących się do środków spożywczych specjalnego przeznaczenia żywieniowego (Dz. Urz. WE L 48 z 19.02.1997),
8) dyrektywy 98/36/WE z dnia 2 czerwca 1998 r. zmieniającej dyrektywę 96/5/WE w sprawie przetworzonej żywności na bazie zbóż oraz odżywek dla niemowląt i małych dzieci (Dz. Urz. WE L 167 z 12.06.1998),
9) dyrektywy 1999/21/WE z 25 marca 1999 r. w sprawie dietetycznych środków spożywczych specjalnego przeznaczenia medycznego (Dz. Urz. WE L 91 z 07.04.1999),
10) dyrektywy 1999/41/WE z dnia 7 czerwca 1999 r. zmieniającej dyrektywę 89/398/EWG w sprawie zbliżenia ustawodawstw państw członkowskich odnoszących się do środków spożywczych specjalnego przeznaczenia żywieniowego (Dz. Urz. WE L 172z08.07.1999),
11) dyrektywy 2001/15/WE z dnia 15 lutego 2001 r. w sprawie substancji, które mogą być dodawane w szczególnych celach odżywczych do żywności specjalnego przeznaczenia żywieniowego (Dz. Urz. WE L 52 z 22.02.2001),
12) dyrektywy 2004/5/WE z dnia 20 stycznia 2004 r. zmieniającej Dyrektywę 2001/15/WE w zakresie włączenia niektórych substancji do załącznika (Dz. Urz. WE L 14 z 21.01.2004),
13) dyrektywy 2004/6/WE z dnia 20 stycznia 2004 r. usuwającej z Dyrektywy 2001/15/EC przesunięcie terminu wdrożenia przepisów zakazujących handlu niektórymi produktami (Dz. Urz. WE L 15 z 22.01.2004). Dane dotyczące ogłoszenia aktów prawa Unii Europejskiej, zamieszczone w niniejszym rozporządzeniu, z dniem uzyskania przez Rzeczpospolitą Polską członkostwa w Unii Europejskiej dotyczą ogłoszenia tych aktów w Dzienniku Urzędowym Unii Europejskiej – wydanie specjalne.
3) Zmiany wymienionej ustawy zostały ogłoszone w Dz. U. z 2001 r. Nr 128, poz. 1408, z 2002 r. Nr 135, poz. 1145 i Nr 166, poz. 1362. z 2003 r. Nr 52, poz. 450, Nr 122, poz. 1144, Nr 130, poz. 1187, Nr 199, poz. 1938 i Nr 208, poz. 2020 oraz z 2004 r. Nr 33, poz. 288 i Nr 96, poz. 959.
4) Niniejsze rozporządzenie było poprzedzone rozporządzeniem Ministra Zdrowia z dnia 23 grudnia 2002 r. w sprawie środków spożywczych specjalnego przeznaczenia żywieniowego (Dz. U. Nr 239, poz. 2050), które traci moc z dniem wejścia w życie niniejszego rozporządzenia.
Załączniki do rozporządzenia Ministra
Zdrowia z 26 kwietnia 2004 r. (poz. 1094)
Załącznik nr 1



Załącznik nr 2
NIEZBĘDNE1) AMINOKWASY W MLEKU KOBIECYM

Załącznik nr 3
SKŁAD AMINOKWASOWY KAZEINY I BIAŁKA MLEKA KOBIECEGO
Załącznik nr 4
PODSTAWOWY SKŁAD PREPARATÓW DO DALSZEGO ZYWIENIA NIEMOWLĄT, PRZYGOTOWANYCH ZGODNIE Z INSTRUKCJĄ PRODUCENTA




Załącznik nr 5
SKŁADNIKI MINERALNE W MLEKU KROWIM
Załącznik nr 6
SKŁADNIKI ODŻYWCZE





Załącznik nr 7
WARTOŚCI ODNIESIENIA DO ZNAKOWANIA ŻYWNOŚCI PRZEZNACZONEJ DLA NIEMOWLĄT I MAŁYCH DZIECI

Załącznik nr 8
WYMAGANIA DOTYCZĄCE SKŁADU PREPARATÓW DO POCZĄTKOWEGO ŻYWIENIA NIEMOWLĄT UPRAWNIAJĄCE DO ODPOWIEDNIEJ INFORMACJI ŻYWIENIOWEJ
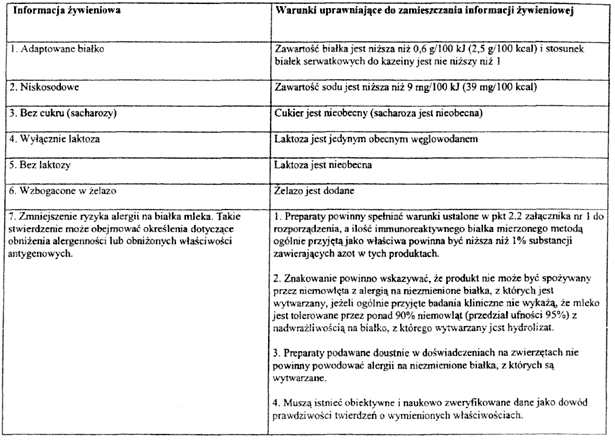
Załącznik nr 9
PODSTAWOWY SKŁAD PRODUKTÓW ZBOŻOWYCH PRZEZNACZONYCH DLA NIEMOWLĄT I MAŁYCH DZIECI


Załącznik nr 10
PODSTAWOWY SKŁAD ŚRODKÓW SPOŻYWCZYCH UZUPEŁNIAJĄCYCH INNYCH NIŻ PRODUKTY ZBOŻOWE PRZETWORZONE, PRZEZNACZONYCH DLA NIEMOWLĄT I MAŁYCH DZIECI


Załącznik nr 11
SKŁADNIKI ODŻYWCZE




Załącznik nr 12
MAKSYMALNE ZAWARTOŚCI WITAMIN I SKŁADNIKÓW MINERALNYCH DODAWANYCH DO ŚRODKÓW SPOŻYWCZYCH UZUPEŁNIAJĄCYCH OBEJMUJĄCYCH PRODUKTY ZBOŻOWE PRZETWORZONE I INNE ŚRODKI SPOŻYWCZE PRZEZNACZONE DLA NIEMOWLĄT I MAŁYCH DZIECI


Załącznik nr 13
PODSTAWOWY SKŁAD ŚRODKÓW SPOŻYWCZYCH STOSOWANYCH W DIETACH O OGRANICZONEJ ZAWARTOŚCI ENERGII W CELU REDUKCJI MASY CIAŁA

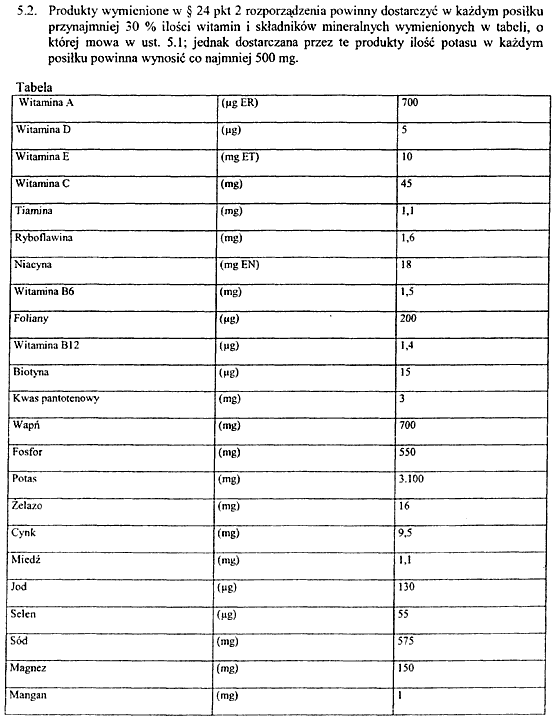
Załącznik nr 14
SKŁAD AMINOKWASOWY BIAŁKA WZORCOWEGO1)

Załącznik nr 15
WITAMINY I SKŁADNIKI MINERALNE, KTÓRE MOGĄ BYĆ DEKLAROWANE ORAZ ICH ZALECANE DZIENNE SPOŻYCIE (RDA)

Załącznik nr 16
PODSTAWOWY SKŁAD DIETETYCZNYCH ŚRODKÓW SPOŻYWCZYCH SPECJALNEGO PRZEZNACZENIA MEDYCZNEGO
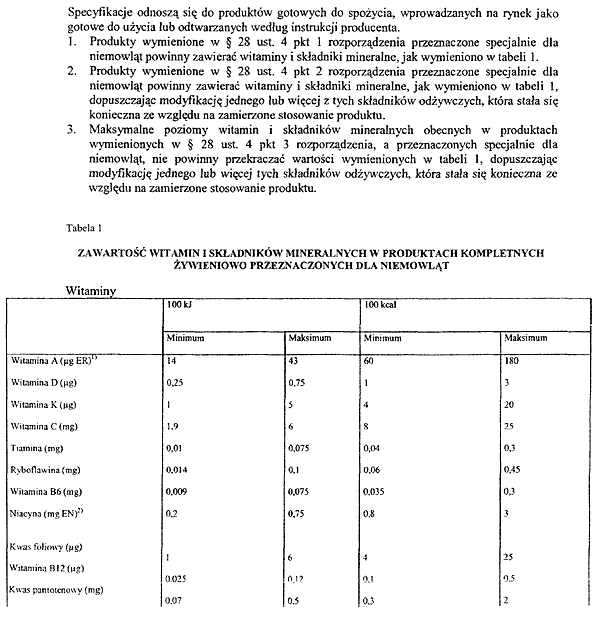
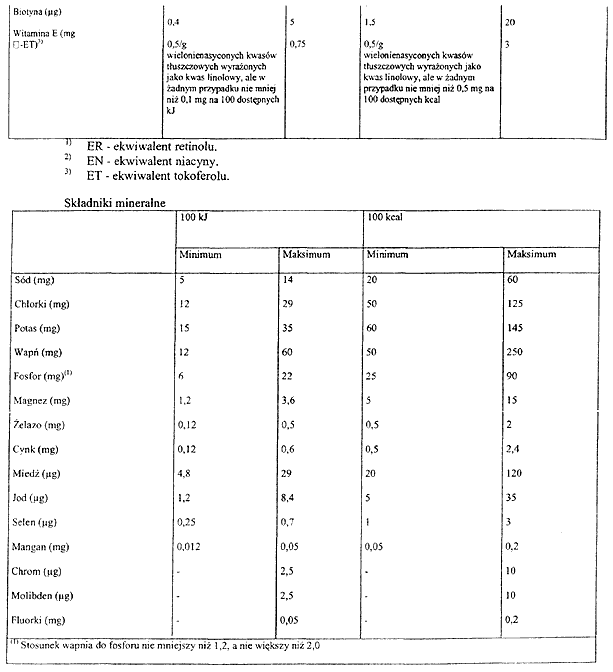

Załącznik nr 17
SUBSTANCJE CHEMICZNE, KTÓRE MOGĄ BYĆ DODAWANE W OKREŚLONYCH CELACH ODŻYWCZYCH DO ŚRODKÓW SPOŻYWCZYCH SPECJALNEGO PRZEZNACZENIA ŻYWIENIOWEGO








- Data ogłoszenia: 2004-05-01
- Data wejścia w życie: 2004-05-01
- Data obowiązywania: 2007-11-28
- Dokument traci ważność: 2008-01-01
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
