REKLAMA
Dziennik Ustaw - rok 2004 nr 76 poz. 722
ROZPORZĄDZENIE MINISTRA ROLNICTWA I ROZWOJU WSI1)
z dnia 15 kwietnia 2004 r.
w sprawie warunków weterynaryjnych wymaganych przy wytwarzaniu pasz leczniczych
Na podstawie art. 5 ust. 4 ustawy z dnia 24 kwietnia 1997 r. o zwalczaniu chorób zakaźnych zwierząt, badaniu zwierząt rzeźnych i mięsa oraz o Inspekcji Weterynaryjnej (Dz. U. z 1999 r. Nr 66, poz. 752, z późn. zm.2)) zarządza się, co następuje:
2. Dopuszcza się wytwarzanie paszy leczniczej, bez zlecenia wystawionego przez lekarza weterynarii, na podstawie receptury na produkcję paszy leczniczej.
3. Pasza lecznicza, o której mowa w ust. 2, wprowadzana jest do obrotu na postawie zlecenia lekarza weterynarii.
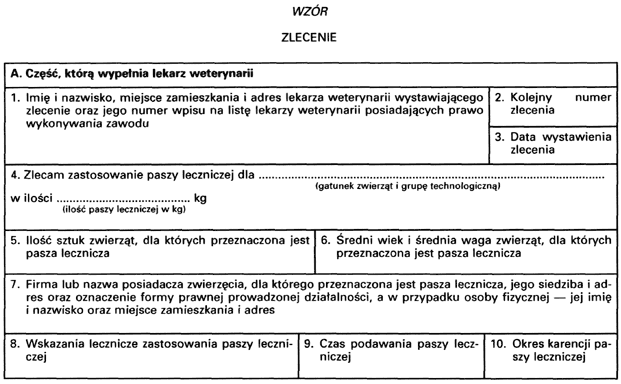
4. Zlecenie wystawia lekarz weterynarii w:
1) czterech egzemplarzach – w przypadku zwierząt,
z których pozyskiwane tkanki lub produkty są przeznaczone do spożycia przez ludzi;
2) dwóch egzemplarzach – w przypadku pozostałych zwierząt.
5. Oryginał zlecenia przechowuje podmiot, który wytworzył paszę leczniczą, zwany dalej „wytwórcą paszy leczniczej”.
6. Kopię zlecenia przechowuje lekarz weterynarii, który wystawił zlecenie.
7. Lekarz weterynarii, który wystawił zlecenie, przekazuje wytwórcy paszy leczniczej oryginał tego zlecenia i pozostałe kopie.
8. Po wytworzeniu paszy leczniczej wytwórca tej paszy odsyła lekarzowi weterynarii kopię zlecenia, a w przypadku zwierząt, których pozyskiwane tkanki lub produkty są przeznaczone do spożycia przez ludzi, drugą kopię zlecenia odsyła powiatowemu lekarzowi weterynarii sprawującemu nadzór nad wytwarzaniem paszy leczniczej, zaś trzecią kopię zlecenia – posiadaczowi leczonych zwierząt.
9. Oryginał zlecenia i jego kopie przechowuje się przez 3 lata od ich wystawienia.
2. Zlecenie jest ważne przez 3 miesiące od dnia wystawienia.
1) instaluje się urządzenia wentylacyjne;
2) podłogi i ściany wykonuje się ze zmywalnego, gładkiego, niepękającego materiału, łatwego do czyszczenia i odkażania;
3) zapewnia się oświetlenie naturalne lub sztuczne dostosowane do rodzaju wykonywanych czynności;
4) instaluje się pułapki służące do wyłapywania szkodników.
2. Przed wystawieniem zlecenia lekarz weterynarii upewnia się, czy:
1) pasze lecznicze i pasze aktualnie stosowane w żywieniu leczonych zwierząt nie zawierają tego samego antybiotyku lub tego samego kokcydiostatyku jako substancji czynnych;
2) zastosowanie określonej w zleceniu paszy leczniczej jest uzasadnione w odniesieniu do wskazanych w zleceniu gatunków zwierząt;
3) podawanie produktu leczniczego zawartego w paszy leczniczej nie jest sprzeczne z wcześniej zastosowanym leczeniem.
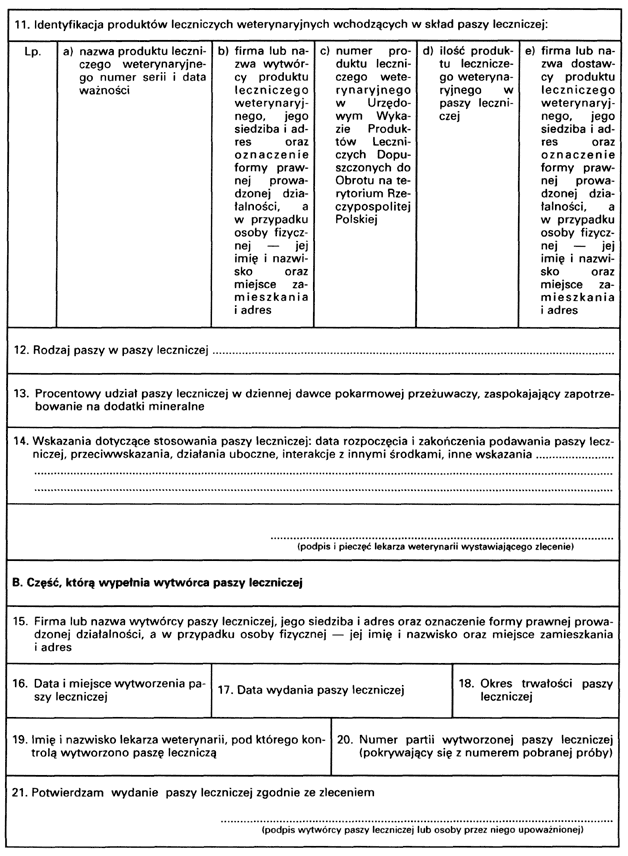
2. Badania, o których mowa w ust. 1, przeprowadza się zgodnie z przyjętą metodą badań laboratoryjnych w celu kontroli zawartości substancji czynnych znajdujących się w paszach leczniczych, ustalenia stopnia wymieszania składników i trwałości paszy leczniczej, a także ustalenia czasu przechowywania tej paszy.
3. Po wykonaniu badań, o których mowa w ust. 1, wytwórca paszy leczniczej prowadzi dokumentację zawierającą informację o:
1) zastosowanej do tych badań metodzie badań laboratoryjnych;
2) wynikach tych badań.
4. Dokumentację, o której mowa w ust. 3, przechowuje się przez 2 lata od dnia wykonania badań.
2. Sposób pobierania i przechowywania próbek archiwalnych, o których mowa w ust. 1, określają przepisy o środkach żywienia zwierząt.
2. Premiks leczniczy, o którym mowa w ust. 1, stosuje się w procesie wytwarzania pasz leczniczych zgodnie z warunkami pozwolenia na dopuszczanie do obrotu.
1) w trakcie wytwarzania paszy leczniczej nie zachodzą niepożądane interakcje między weterynaryjnymi produktami leczniczymi, dodatkami paszowymi i paszami;
2) pasze wykorzystane do wytwarzania pasz leczniczych nie zawierają tego samego antybiotyku lub kokcydiostatyku, który jest używany jako substancja czynna w premiksach leczniczych;
3) pasze lecznicze przechowuje się:
a) w pomieszczeniach odizolowanych od źródeł ciepła,
b) tak, aby zabezpieczyć je przed działaniem światła słonecznego i wahaniami temperatury.
1) bieżącą i okresową ocenę jakości wytworzonych pasz leczniczych, pod względem równomierności rozprowadzenia produktów leczniczych weterynaryjnych w paszy;
2) ocenę prawidłowości i skuteczności stosowanych wewnętrznych procedur obejmujących w szczególności:
a) pobieranie prób do badań laboratoryjnych,
b) określenie badań laboratoryjnych,
c) analizę wyników badań laboratoryjnych i postępowanie z paszami leczniczymi niespełniającymi wymagań,
d) zabezpieczenie przed nieprawidłowym cyklem produkcyjnym,
e) opracowanie procedur zwalczania szkodników oraz mycia i odkażania urządzeń i pomieszczeń produkcyjnych,
f) określenie dróg przemieszczania pracowników i sprzętu części produkcyjnej wytwórni,
g) opracowanie systemu zabezpieczeń przed wtórnym zanieczyszczeniem produktu;
3) ocenę poprawności stosowanych metod wytwarzania zabezpieczających przed błędnym wymieszaniem lub dawkowaniem składników paszy leczniczej, skażeniem krzyżowym oraz metod służących zmniejszeniu pozostałości produktów leczniczych weterynaryjnych;
4) kontrolę czystości i sprawności urządzenia mieszającego (mieszadła).
2. W przypadku przeżuwaczy wytworzona pasza lecznicza zawiera dawkę substancji czynnej odpowiadającą co najmniej połowie dziennego zapotrzebowania leczonego zwierzęcia na niemineralną paszę uzupełniającą.
2. Pasze lecznicze niezużyte lub których termin trwałości upłynął oraz odpady powstałe w procesie wytwarzania tych pasz, traktuje się jako materiał kategorii 1 w rozumieniu przepisów o materiałach niskiego, wysokiego i szczególnego ryzyka.
Minister Rolnictwa i Rozwoju Wsi: W. Olejniczak
|
|
1) Minister Rolnictwa i Rozwoju Wsi kieruje działem administracji rządowej – rolnictwo, na podstawie § 1 ust. 2 pkt 1 rozporządzenia Prezesa Rady Ministrów z dnia 29 marca 2002 r. w sprawie szczegółowego zakresu działania Ministra Rolnictwa i Rozwoju Wsi (Dz. U. Nr 32, poz. 305).
2) Zmiany tekstu jednolitego wymienionej ustawy zostały ogłoszone w Dz. U. z 2001 r. Nr 29, poz. 320, Nr 123, poz. 1350 i Nr 129, poz. 1438, z 2002 r. Nr 112, poz. 976, z 2003 r. Nr 52, poz. 450, Nr 122, poz.1144, Nr 165, poz.1590 i Nr 208, poz. 2020 oraz z 2004 r. Nr 33, poz. 288.
3) Niniejsze rozporządzenie było poprzedzone rozporządzeniem Ministra Rolnictwa i Rozwoju Wsi z dnia 26 marca 2003 r. w sprawie szczegółowych warunków weterynaryjnych wymaganych przy wytwarzaniu pasz leczniczych (Dz. U. Nr 61, poz. 543), które utraci moc z dniem wejścia w życie niniejszego rozporządzenia na podstawie art. 6 pkt 3 ustawy z dnia 13 czerwca 2003 r. o zmianie ustawy o środkach żywienia zwierząt oraz o zmianie niektórych ustaw (Dz. U. Nr 122, poz. 1144).
Załącznik do rozporządzenia Ministra Rolnictwa i Rozwoju Wsi
z dnia 15 kwietnia 2004 r. (poz. 722)
- Data ogłoszenia: 2004-04-23
- Data wejścia w życie: 2004-04-23
- Data obowiązywania: 2004-04-23
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
