REKLAMA
Dziennik Ustaw - rok 2002 nr 209 poz. 1783
ROZPORZĄDZENIE MINISTRA ZDROWIA1)
z dnia 29 listopada 2002 r.
w sprawie Centralnej Ewidencji Badań Klinicznych.
Na podstawie art. 6 ust. 5 pkt 1, 3 i 4 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne (Dz. U. Nr 126, poz. 1381 oraz z 2002 r. Nr 113, poz. 984, Nr 141, poz. 1181 i Nr 152, poz. 1265) zarządza się, co następuje:
1) sposób i tryb prowadzenia Centralnej Ewidencji Badań Klinicznych;
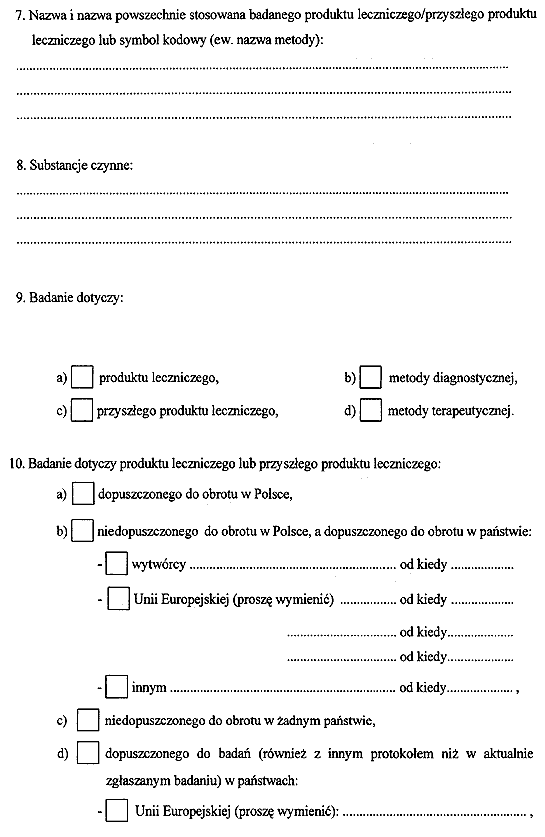
2) wzór zgłoszenia badań klinicznych produktu leczniczego lub przyszłego produktu leczniczego do Centralnej Ewidencji Badań Klinicznych;
3) wysokość opłat ponoszonych za dokonanie wpisu do Centralnej Ewidencji Badań Klinicznych.
1) „ustawie” – rozumie się przez to ustawę z dnia 6 września 2001 r. – Prawo farmaceutyczne;
2) „Ewidencji” – rozumie się przez to Centralną Ewidencję Badań Klinicznych;
3) „podmiocie uprawnionym” – rozumie się przez to podmiot, o którym mowa w art. 6 ust. 2 ustawy;
4) „Urzędzie” – rozumie się przez to Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych.
2. Jeżeli zgłoszenie nie spełnia wymagań określonych w rozporządzeniu lub podmiot uprawniony nie dołączył do zgłoszenia niezbędnych dokumentów, Prezes Urzędu wzywa do uzupełnienia danych lub dokumentów w terminie określonym w Kodeksie postępowania administracyjnego, pod rygorem pozostawienia zgłoszenia bez rozpoznania, z zastrzeżeniem ust. 3.
3. Dopuszcza się złożenie opinii komisji bioetycznej – w rozumieniu ustawy z dnia 5 grudnia 1996 r. o zawodzie lekarza (Dz. U. z 2002 r. Nr 21, poz. 204, Nr 76, poz. 691, Nr 152, poz. 1266 i Nr 153, poz. 1271) przez podmiot uprawniony w terminie późniejszym. Brak opinii komisji bioetycznej w odniesieniu do poszczególnych ośrodków badawczych nie wstrzymuje wydania decyzji na prowadzenie badania w odniesieniu do pozostałych ośrodków badawczych, które uzyskały pozytywną opinię komisji bioetycznej.
4. Zgłoszenie składane jest w języku polskim; dopuszcza się złożenie załączników do zgłoszenia w języku angielskim, z wyłączeniem tekstów przeznaczonych do wiadomości pacjenta, które zawsze muszą być przedstawione w języku polskim.
2. Oceny merytorycznej, o której mowa w ust. 1, nie wymaga badanie kliniczne, o którym mowa w § 8.
1) datę zgłoszenia badania klinicznego do Ewidencji;
2) tytuł badania klinicznego;
3) datę i numer protokołu badania klinicznego;
4) dotyczące fazy badania albo badania biorównoważności;
5) nazwę sponsora i podmiotu uprawnionego;
6) datę otrzymania opinii recenzenta oraz jego stanowisko dotyczące badania klinicznego;
7) przewidywany okres prowadzenia badania;
8) datę wydania przez ministra właściwego do spraw zdrowia decyzji, o której mowa w art. 6 ust. 3 ustawy;
9) adnotacje związane z przebiegiem badania klinicznego, w szczególności okresy przerw lub zaprzestania badania.
1) fazę l badania klinicznego – polegającą na pierwszym podaniu przyszłego produktu leczniczego człowiekowi, zwykle przeprowadzaną z udziałem zdrowych ochotników; celem badania jest dokonanie wstępnej oceny bezpieczeństwa i zebrania pierwszych danych farmakokinetycznych, a jeżeli to możliwe, również określenie profilu farmakodynamicznego substancji czynnej u ludzi;
2) fazę II badania klinicznego – polegającą na badaniu pilotażowym mającym wykazać działanie i określić bezpieczeństwo krótkotrwałego stosowania przyszłego produktu leczniczego u pacjentów cierpiących na określoną chorobę; próby te przeprowadza się na ograniczonej grupie chorych; ta faza badań ma na celu ustalenie właściwego sposobu dawkowania, dawki terapeutycznej (o ile to możliwe) oraz określenie związku między dawką a reakcją pacjenta; dostarcza również niezbędnych danych do zaplanowania badań III fazy;
3) fazę III badania klinicznego – polegającą na badaniu obejmującym większą grupę pacjentów; ma ono na celu zbadanie skuteczności terapeutycznej oraz bezpieczeństwa w odniesieniu do krótkotrwałego stosowania, określenie współczynnika korzyść/ryzyko, ocenę wartości terapeutycznej przyszłego produktu leczniczego, zbadanie częstości oraz rodzaju działań niepożądanych; są to badania randomizowane, prowadzone na ogół metodą podwójnie ślepej próby, z zastosowaniem placebo lub rzadziej preparatu o zbliżonym działaniu terapeutycznym;
4) fazę IV badania klinicznego – polegającą na badaniu, w którym podaje się produkt leczniczy zgodnie ze wskazaniami zawartymi w Charakterystyce Produktu Leczniczego; ma ona zwykle na celu ocenę bezpieczeństwa długoterminowego stosowania po dopuszczeniu produktu leczniczego do obrotu.
1) na podstawie zgłoszenia podmiotu uprawnionego po uzyskaniu decyzji ministra właściwego do spraw zdrowia, o której mowa w art. 6 ust. 3 ustawy;
2) z urzędu, na podstawie decyzji ministra właściwego do spraw zdrowia, o której mowa w art. 6 ust. 3e ustawy;
3) w przypadkach innych, niż wymienione w pkt 1 i 2, na wniosek podmiotu uprawnionego.
2. Wniosek, o którym mowa w ust. 1 pkt 3, może obejmować wyłącznie zmiany niemające wpływu na przebieg badania klinicznego lub zmiany, w których natychmiastowe działanie jest konieczne, aby wyeliminować ryzyko zagrażające uczestnikom badania, oraz gdy zmiany dotyczą jedynie zagadnień technicznych lub administracyjnych.
3. Wpisów w Ewidencji dokonuje się pod kolejnym numerem.
4. Jeżeli dane, o których mowa w § 6 albo § 8, nie mogą być ze względu na swój zakres ujęte w Ewidencji, stanowią one załącznik do Ewidencji. Osoba prowadząca Ewidencję obowiązana jest sporządzić w Ewidencji adnotację dotyczącą załącznika.
5. Treść wpisu, zmiany wpisu lub jego skreślenie muszą być zgodne z dokumentami, o których mowa w ust. 1 i 4, stanowiącymi akta ewidencyjne.
2. Osoba dokonująca poprawek obowiązana jest opatrzyć poprawkę własnoręcznym podpisem oraz dokonać stosownej zmiany w Ewidencji prowadzonej w formie systemu informatycznego.
2. Księgę ewidencyjną i akta ewidencyjne przechowuje się zgodnie z przepisami dotyczącymi klasyfikacji dokumentów do celów archiwalnych.
Minister Zdrowia: M. Łapiński
|
|
1) Minister Zdrowia kieruje działem administracji rządowe – zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 28 czerwca 2002 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. Nr 93, poz. 833).
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 29 listopada 2002 r. (poz. 1783)
Załącznik nr 1












Załącznik nr 2
WYSOKOŚĆ OPŁAT PONOSZONYCH ZA DOKONANIE WPISU DO CENTRALNEJ EWIDENCJI BADAŃ KLINICZNYCH
| Lp. | Wyszczególnienie | Wysokość opłat w PLN |
| 1 | Wpis do Ewidencji badania klinicznego oryginalnego produktu leczniczego lub przyszłego produktu leczniczego | 5000 |
| 2 | Wpis do Ewidencji badania biorównoważności przyszłego produktu leczniczego, będącego odpowiednikiem referencyjnego produktu leczniczego | 2500 |
| 3 | Wpis do Ewidencji badania klinicznego produktu leczniczego dopuszczonego do obrotu, przeprowadzonego zgodnie z zatwierdzoną Charakterystyką Produktu Leczniczego | 2500 |
| 4 | Zmiana w dokumentach, wymagająca ponownej oceny wniosku | 500 |
- Data ogłoszenia: 2002-12-12
- Data wejścia w życie: 2002-12-27
- Data obowiązywania: 2002-12-27
- Dokument traci ważność: 2005-05-02
REKLAMA
