REKLAMA
Dziennik Ustaw - rok 2002 nr 155 poz. 1296
ROZPORZĄDZENIE MINISTRA ROLNICTWA l ROZWOJU WSI1)
z dnia 11 września 2002 r.
w sprawie sposobu badania zwierząt rzeźnych i mięsa tych zwierząt oraz mięsa zwierząt łownych.
Na podstawie art. 32 pkt 1 ustawy z dnia 24 kwietnia 1997 r. o zwalczaniu chorób zakaźnych zwierząt, badaniu zwierząt rzeźnych i mięsa oraz o Inspekcji Weterynaryjnej (Dz. U. z 1999 r. Nr 66, poz. 752, z 2001 r. Nr 29, poz. 320, Nr 123, poz. 1350 i Nr 129, poz. 1438 oraz z 2002 r. Nr 112, poz. 976) zarządza się, co następuje:
Rozdział 1
Przepisy ogólne
§ 1.
1) sposób badania zwierząt rzeźnych;
2) sposób badania mięsa zwierząt rzeźnych i łownych;
3) sposób oceny mięsa;
4) znakowanie mięsa po zbadaniu;
5) sposób wykorzystania mięsa warunkowo zdatnego do spożycia i mięsa niezdatnego do spożycia;
6) sposób prowadzenia dokumentacji;
7) wzory świadectw zdrowia:
a) dla zwierząt rzeźnych przeznaczonych do uboju,
b) dla drobiu przeznaczonego do uboju,
c) dla zwierząt poddanych ubojowi z konieczności.
2. Ilekroć w rozporządzeniu jest mowa o:
1) tuszy (tuszce) – rozumie się przez to ubite lub odstrzelone zwierzę, przedstawione do badania po wykonaniu określonych zabiegów technologicznych;
2) mięsie zdatnym do spożycia – rozumie się przez to mięso po zbadaniu i oznakowaniu dopuszczone do spożycia;
3) mięsie warunkowo zdatnym do spożycia – rozumie się przez to mięso zbadane, oznakowane i dopuszczone do spożycia po poddaniu go zabiegom uzdatniającym, które są określone w odrębnych przepisach;
4) mięsie niezdatnym do spożycia – rozumie się przez to mięso zbadane i niedopuszczone do spożycia, oznakowane jako nienadające się do spożycia.
Rozdział 2
Badanie przedubojowe
§ 2.
1) kontrolę dokumentów towarzyszących zwierzętom przeznaczonym do uboju, w tym świadectw zdrowia;
2) ocenę stanu zdrowia zwierząt przed skierowaniem ich do uboju.
2. Wzór świadectwa zdrowia dla zwierząt rzeźnych przeznaczonych do uboju zawiera załącznik nr 1 do rozporządzenia.
1) wykazują objawy chorobowe charakterystyczne dla chorób zakaźnych zwierząt lub podejrzewa się je o zakażenie tymi chorobami;
2) wykazują inne objawy chorobowe, zaburzenia ogólne lub objawy wskazujące, że są pod wpływem działania środków farmaceutycznych bądź innych substancji mających wpływ na ocenę mięsa;
3) są zmęczone, zranione lub nadmiernie pobudzone, w szczególności dotyczyło bydła, świń, owiec, kóz, koni i ich mieszańców;
4) nie wykazują śladów podania środków farmaceutycznych.
2. Ocena stanu zdrowia zwierząt, o którym mowa w ust. 1, obejmuje ponadto sprawdzenie:
1) powierzchni ciała, a w szczególności obrażeń, obrzęków, opuchlizn;
2) układu oddechowego;
3) układu pokarmowego, przeżuwania, konsystencji i barwy wydalin;
4) układu moczowo-płciowego;
5) gruczołu mlekowego;
6) stanu odżywienia;
7) wypływów z naturalnych otworów ciała;
8) sposobu reagowania zwierzęcia na bodźce zewnętrzne;
9) sposobu zachowania się zwierząt w spoczynku i ruchu;
10) ciepłoty ciała w przypadkach podejrzenia o chorobę.
3. Zmęczone, zranione lub nadmiernie pobudzone zwierzęta, o których mowa w ust. 1 pkt 3, przed ubojem powinny odpoczywać przez 24 godziny.
2. Badanie przedubojowe partii drobiu można ograniczyć do zbadania urazów mechanicznych powstałych w czasie transportu do rzeźni, jeżeli od badania drobiu w celu wystawienia świadectwa zdrowia upłynęły nie więcej niż 24 godziny.
3. Jeżeli w ciągu 72 godzin od dnia wystawienia świadectwa zdrowia dla drobiu przeznaczonego do uboju ubój nie będzie przeprowadzony, należy powtórzyć badanie przedubojowe w celu wydania nowego świadectwa.
2. Badanie, o którym mowa w ust. 1, w razie potrzeby może być uzupełnione o badania laboratoryjne, w tym na obecność pozostałości środków farmaceutycznych.
Rozdział 3
Badanie poubojowe
§ 8.
1) zmian chorobowych stanowiących zagrożenie dla zdrowia ludzi;
2) obecności w mięsie czynników chorobotwórczych, wpływających na ocenę mięsa;
3) zmian, takich jak niedostateczne wykrwawienie, niedojrzałość, wodnistość, konsystencja, zapach, smak;
4) zmian wskazujących, że zwierzę otrzymywało środki farmaceutyczne lub inne substancje pozostające w mięsie i wpływające na jego ocenę.
2. Narządy wewnętrzne, w których w czasie oględzin lub omacywania stwierdzono zmiany anatomopatologiczne, nacina się w taki sposób, aby nie dopuszczać do zanieczyszczenia tusz, wyposażenia lub pomieszczeń.
1) oględziny poddanego ubojowi zwierzęcia oraz jego narządów;
2) omacywanie narządów wewnętrznych;
3) nacinanie niektórych narządów wewnętrznych i węzłów chłonnych;
4) badanie konsystencji, zabarwienia i zapachu tuszy oraz smaku w uzasadnionych przypadkach;
5) badanie na obecność wągrów u świń i przeżuwaczy poprzez oględziny mięśni międzyżebrowych, serca, języka, mięśni okołogardłowych i uwolnionych z tłuszczu mięśni lędźwiowych; u bydła w wieku powyżej 6 tygodni oraz u danieli i jeleni utrzymywanych w warunkach fermowych oględziny powierzchniowych warstw mięśni odnóg przepony i naciętych mięśni żwaczy i mięśni skrzydłowych;
6) badanie w kierunku nosacizny zwierząt jednokopytnych poprzez oględziny błony śluzowej tchawicy, krtani, jam nosowych i przegrody nosowej po podłużnym przepołowieniu głowy;
7) badanie na wiośnie mięsa świń, nutrii i koni;
8) w razie konieczności badania laboratoryjne.
2. Badanie na włośnie części tuszy, elementu mięsnego lub wyrobów z mięsa przeprowadza się, jeżeli istnieje podejrzenie, że mięso to nie było poddane badaniu na włośnie.
3. Szczegółowy sposób badania poubojowego bydła, świń, owiec, kóz, zwierząt jednokopytnych oraz jeleni i danieli utrzymywanych w warunkach fermowych określa załącznik nr 3 do rozporządzenia.
2. Wynik badania, o którym mowa w § 10 ust. 2, dotyczy badanej tuszy, części tuszy, elementu mięsnego lub partii wyrobu mięsnego, z której pobrano próby.
2. Znakowania, o którym mowa w ust. 1, można również dokonać za pomocą okrągłego znaku umieszczonego na etykiecie wykonanej z trwałego materiału, przymocowanej do każdej tuszy lub każdej jej części, w sposób uniemożliwiający powtórne jej użycie.
1) zwierzę pochodzi z gospodarstwa, w którym nie występują choroby zakaźne zwierząt;
2) zwierzę przed ubojem zostało zbadane przez lekarza weterynarii;
3) zwierzę po uboju zostało wykrwawione, a jeżeli to możliwe wytrzewione i jak najszybciej przewiezione do rzeźni;
4) w przypadku gdy zwierzę, o którym mowa w pkt 3, nie może być przewiezione do rzeźni w ciągu godziny, powinno być przewożone w kontenerze lub innym środkiem transportu w temperaturze od 0° do 4°C;
5) zwierzęciu, o którym mowa w pkt 4, towarzyszy wystawione przez lekarza weterynarii, kierującego zwierzę do uboju z konieczności, świadectwo zdrowia dla zwierząt poddanych ubojowi z konieczności, potwierdzające wykonanie badania przedubojowego, czas uboju oraz nazwę zastosowanych środków farmaceutycznych;
6) do czasu przeprowadzenia badania poubojowego, tuszę przetrzymuje się w oddzielnym pomieszczeniu lub miejscu wyznaczonym dla tusz tymczasowo zajętych.
2. Wzór świadectwa zdrowia, o którym mowa w ust. 1 pkt 5, zawiera załącznik nr 5 do rozporządzenia.
1) oględziny tuszki i narządów wewnętrznych;
2) omacywanie i nacinanie tuszki i narządów wewnętrznych w razie konieczności;
3) określenie konsystencji, zabarwienia, zapachu, ewentualnie smaku tuszki;
4) badania laboratoryjne w razie konieczności.
2. W przypadku patroszenia częściowego (kuropatwy, przepiórki) bada się 5% ptaków z każdej partii po całkowitym wypatroszeniu, w sposób określony w ust. 1.
3. Jeżeli w wyniku badania, o którym mowa w ust. 2, stwierdzi się zmiany chorobowe, przeprowadza się badanie całej partii ptaków, w sposób określony w ust. 1.
4. W badaniu poubojowym strusi przepis ust. 1 stosuje się odpowiednio.
1) oględziny tuszki i narządów wewnętrznych;
2) omacywanie lub w razie konieczności nacinanie płuc, wątroby, śledziony, nerek oraz części tuszki, w których występują zmiany;
3) określenie zmian w konsystencji, zabarwieniu, zapachu tuszki;
4) badania laboratoryjne w razie konieczności.
2. Badanie po odstrzeleniu obejmuje:
1) oględziny nieskórowanej zwierzyny grubej i jej narządów wewnętrznych;
2) oględziny oskórowanej zwierzyny grubej i jej narządów wewnętrznych, przy czym jeżeli wyniki oględzin nie pozwalają na dokonanie oceny, przeprowadza się badania laboratoryjne;
3) oględziny oskórowanej lub pozbawionej piór tuszy i narządów wewnętrznych drobnych zwierząt łownych;
4) określenie zmian w konsystencji, zabarwieniu i ewentualnie zapachu tuszy;
5) badanie na włośnie mięsa dzików lub innych gatunków zwierząt łownych podatnych na włośnie (niedźwiedzie);
6) badanie na włośnie, o którym mowa w pkt 5, przeprowadza się w zakładzie rozbioru mięsa lub innym miejscu badania tuszy i narządów wewnętrznych jedną z metod określonych w załączniku nr 4 do rozporządzenia.
3. Lekarz weterynarii może wykonać także inne badania konieczne do dokonania oceny mięsa.
Rozdział 4
Znakowanie mięsa
§ 19.
2. Znak weterynaryjny jest umieszczany:
1) przy użyciu stempla;
2) poprzez wypalenie;
3) w formie etykiet lub wykonanych z trwałego materiału zawieszek.
3. Znak, o którym mowa w ust. 2 pkt 1, powinien być umieszczony w taki sposób, aby był czytelny i trwały.
4. Tusz używany do znakowania mięsa powinien spełniać wymagania określone w przepisach o warunkach zdrowotnych żywności i żywienia.
5. Narzędzia i przyrządy do znakowania mięsa wydane przez powiatowego lekarza weterynarii przechowuje urzędowy lekarz weterynarii uprawniony do badania mięsa.
1) dla mięsa zdatnego do spożycia:
a) pozyskanego w rzeźni posiadającej uprawnienia do produkcji na rynek państw Unii Europejskiej
– znak weterynaryjny owalny o wymiarach 4,5 cm x 6,5 cm, zawierający:
– w górnej części – litery PL,
– w środku – weterynaryjny numer identyfikacyjny,
– w dolnej części – litery IW,
b) pozyskanego w rzeźni nieposiadającej uprawnień, o których mowa w lit. a – znak weterynaryjny okrągły o średnicy 6 cm, zawierający:
– w górnej części – litery PL,
– w środku – weterynaryjny numer identyfikacyjny,
– w dolnej części – litery IW,
c) znak weterynaryjny, o którym mowa w lit. b, stosuje się do mięsa pochodzącego ze zwierząt poddanych ubojowi z konieczności,
d) pozyskanego ze zwierzęcia poddanego ubojowi w gospodarstwie na własne potrzeby – znak weterynaryjny okrągły o średnicy 6 cm, zawierający:
– w górnej części – napis „UBÓJ DOMOWY”,
– w środku – numer statystyczny lekarza weterynarii przeprowadzającego badanie,
– w dolnej części – litery IW;
ponadto znak weterynaryjny w kształcie prostokąta o wymiarach 3 cm x 5 cm z napisem „MIĘSO DO WŁASNEGO UŻYTKU”
2) dla mięsa warunkowo zdatnego do spożycia – znak weterynaryjny o kształcie prostokąta o wymiarach 4 cm x 6 cm, zawierający:
– w górnej części – litery PL,
– w środku – weterynaryjny numer identyfikacyjny,
– w dolnej części – litery IW;
3) dla mięsa niezdatnego do spożycia – znak weterynaryjny o kształcie trójkąta równobocznego skierowanego wierzchołkiem do góry o długości boku 5 cm, zawierający:
– w górnej części – litery PL,
– w dolnej części – litery IW.
2. Do znakowania mięsa zwierząt łownych stosuje się następujący znak weterynaryjny:
1) dla mięsa zdatnego do spożycia – znak weterynaryjny o kształcie pięciokąta o wymiarach: podstawa o długości 6,5 cm, bok o wysokości 2,5 cm, wysokość pięciokąta od podstawy 4,5 cm, zawierający:
– w górnej części – litery PL,
– w środku – weterynaryjny numer identyfikacyjny,
– w dolnej części – litery IW;
2) dla mięsa niezdatnego do spożycia – znak, o którym mowa w ust. 1 pkt 3.
3. Do znakowania mięsa drobiu, królików i nutrii stosuje się następujące znaki weterynaryjne:
1) dla mięsa zdatnego do spożycia:
a) pozyskanego w rzeźni posiadającej uprawnienia do produkcji na rynek państw Unii Europejskiej
– znak weterynaryjny owalny o wymiarach 4,5 cm x 6,5 cm, zawierający:
– w górnej części – litery PL,
– w środku – weterynaryjny numer identyfikacyjny,
– w dolnej części – litery IW,
b) pozyskanego w rzeźni nieposiadającej uprawnień, o których mowa w lit. a – znak weterynaryjny okrągły o średnicy 3 cm, zawierający:
– w górnej części – litery PL,
– w środku – weterynaryjny numer identyfikacyjny,
– w dolnej części – litery IW;
2) dla mięsa warunkowo zdatnego do spożycia – znak weterynaryjny o kształcie prostokąta o wymiarach 4 cm x 6 cm, zawierający:
– w górnej części – litery PL,
– w środku – weterynaryjny numer identyfikacyjny,
– w dolnej części – litery IW;
3) dla mięsa niezdatnego do spożycia – znak weterynaryjny o kształcie trójkąta równobocznego skierowanego wierzchołkiem do góry o boku o długości 2,5 cm, zawierający:
– w górnej części – litery PL,
– w dolnej części – litery IW.
4. W znakach weterynaryjnych, o których mowa w ust. 1–3, wysokość liter wynosi 0,8 cm, a cyfr – 1 cm.
5. Wysokość liter i cyfr w znakach weterynaryjnych, o których mowa w ust. 3 pkt 1, umieszczanych na opakowaniach jednostkowych zawierających mięso drobiu, królików i nutrii może być zmniejszona, z tym że nie powinna być mniejsza niż 0,2 cm.
6. Znakowanie mięsa drobiu, królików i nutrii polega na:
1) umocowaniu zawieszki ze znakiem weterynaryjnym, o którym mowa w ust. 3 pkt 1, w części grzbietowej każdej nieopakowanej tuszki;
2) umieszczeniu znaku weterynaryjnego, o którym mowa w ust. 3 pkt 1, na opakowaniu zbiorczym lub transportowym w przypadku nieopakowanych jednostkowo tuszek lub ich elementów;
3) umieszczeniu na opakowaniu jednostkowym znaku weterynaryjnego, o którym mowa w ust. 3 pkt 1.
7. Wymiary znaków weterynaryjnych, w tym liter i cyfr, mogą być zmniejszone w przypadku znakowania tusz jagniąt, cieląt, koźląt i prosiąt; znakowanie tych tusz może być również dokonane poprzez umieszczenie znaku weterynaryjnego na etykiecie jednorazowego użycia lub zawieszce dołączonej do tuszy.
8. Znak weterynaryjny nanosi się na tuszę przy użyciu stempla lub poprzez wypalenie, przy czym:
1) tusze o ciężarze powyżej 65 kg oznacza się na każdej półtuszy, co najmniej na zewnętrznych powierzchniach mięśni uda, mięśni lędźwiowych, w okolicy mostka i grzbietu;
2) tusze jagniąt, koźląt i prosiąt oznacza się na każdej stronie tuszy na łopatce lub zewnętrznej powierzchni ud;
3) tusze niewymienione w pkt 1 i 2 oznacza się co najmniej w czterech miejscach – na łopatce lub zewnętrznej powierzchni ud.
9. Na narządach wewnętrznych nieopakowanych jednostkowo znak weterynaryjny nanosi się poprzez wypalenie.
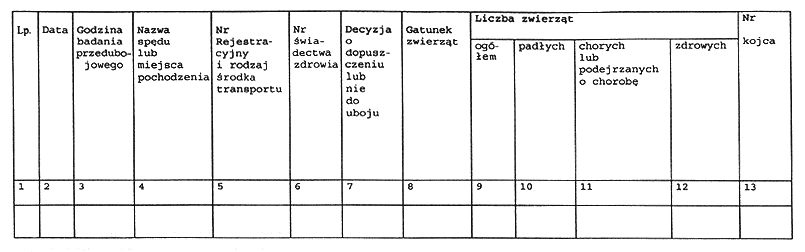
1) dziennik badania przedubojowego zwierząt rzeźnych;
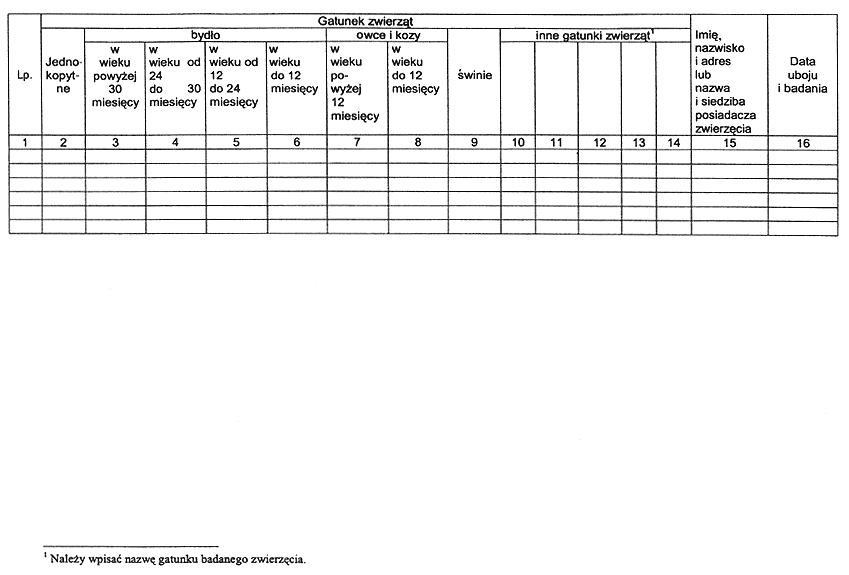
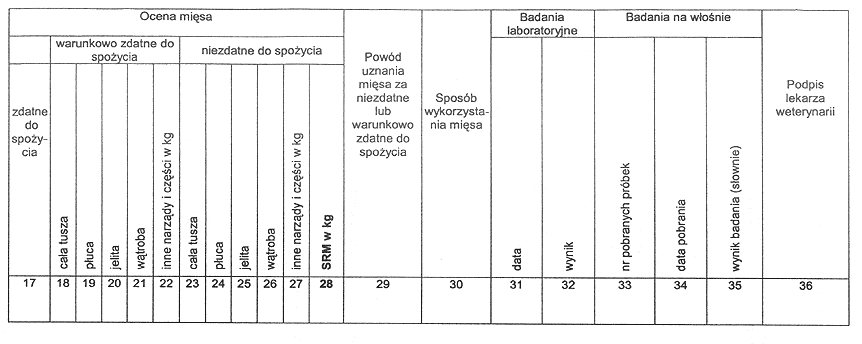
2) dziennik badania poubojowego mięsa zwierząt rzeźnych i łownych.
2. Dzienniki, o których mowa w ust. 1, wydawane są lekarzom weterynarii przez powiatowego lekarza weterynarii.
3. Dziennik, o którym mowa w ust. 1 pkt 1, zawiera w szczególności dane dotyczące:
1) identyfikacji zwierząt dopuszczonych w danym dniu do uboju;
2) pochodzenia zwierząt;
3) zdrowotności zwierząt.
4. Dziennik, o którym mowa w ust. 1 pkt 2, zawiera w szczególności dane dotyczące:
1) identyfikacji zwierząt dopuszczonych w danym dniu do uboju;
2) pochodzenia zwierząt;
3) oceny mięsa;
4) przyczyny uznania mięsa za niezdatne do spożycia lub warunkowo zdatne do spożycia i sposobu wykorzystania takiego mięsa.
5. Wzór dziennika badania przedubojowego zwierząt rzeźnych i dziennika badania poubojowego mięsa zwierząt rzeźnych i łownych zawiera załącznik nr 7 do rozporządzenia.
Rozdział 5
Przepisy końcowe
§ 25.
Minister Rolnictwa i Rozwoju Wsi: J. Kalinowski
|
|
1) Minister Rolnictwa i Rozwoju Wsi kieruje działem administracji rządowej – rolnictwo na podstawie § 1 ust. 2 pkt 1 rozporządzenia Prezesa Rady Ministrów z dnia 29 marca 2002 r. w sprawie szczegółowego zakresu działania Ministra Rolnictwa i Rozwoju Wsi (Dz. U. Nr 32, poz. 305).
Załączniki do rozporządzenia Ministra Rolnictwa i Rozwoju Wsi
z dnia 11 września 2002 r. (poz. 1296)
Załącznik nr 1


Załącznik nr 2


Załącznik nr 3
SZCZEGÓŁOWY SPOSÓB BADANIA POUBOJOWEGO BYDŁA, ŚWIŃ, OWIEC, KÓZ, ZWIERZĄT JEDNOKOPYTNYCH ORAZ JELENI l DANIELI UTRZYMYWANYCH W WARUNKACH FERMOWYCH
1. Badanie bydła oraz jeleni i danieli utrzymywanych w warunkach fermowych powyżej sześciu tygodni życia obejmuje:
1) oględziny tuszy ze szczególnym uwzględnieniem wykrwawienia, żółtaczki, wodnicy, inwazji pasożytniczych, zmian występujących przy syndromie mięsa bladego, miękkiego, wodnistego (PSE) i mięsa czerwonego, twardego, suchego (DFD); w uzasadnionych przypadkach nacięcie dostępnych węzłów chłonnych;
2) oględziny głowy oraz jamy gardłowej, nacięcie węzłów chłonnych zagardłowych, mięśni żwaczy, mięśni skrzydłowych, wykonanie dwóch nacięć mięśni zewnętrznych żuchwy równolegle do skrzydła żuchwy oraz jednego nacięcia mięśni wewnętrznych żuchwy wzdłuż ich płaszczyzny, oględziny i omacywanie języka po wcześniejszym jego uwolnieniu, pozwalającym na szczegółowe oględziny jamy ustnej i gardła, usunięcie migdałków;
3) badanie tchawicy; oględziny i omacywanie płuc i przełyku, nacięcie węzłów chłonnych tchawiczno-oskrzelowych i śródpiersiowych, przecięcie tchawicy i głównych pni oskrzelowych wzdłuż ich przebiegu, nacięcie każdego płuca od strony grzbietowej poprzecznie do osi długiej w połowie długości płuca, a w razie potrzeby w jednej trzeciej dolnej płuca;
4) oględziny worka osierdziowego i serca, przecięcie jednym podłużnym cięciem obydwu komór serca i przegrody międzykomorowej;
5) oględziny przepony;
6) oględziny i omacywanie wątroby oraz węzłów chłonnych wątrobowych, nacięcie dwukrotne powierzchni trzewnej płata lewego wątroby prostopadle do przewodów żółciowych oraz nacięcie prowadzone przez płat prawy obok płata ogoniastego wzdłuż przewodów żółciowych; w uzasadnionych przypadkach nacięcie węzłów chłonnych wątrobowych;
7) oględziny przewodu pokarmowego, trzustki, krezki i węzłów chłonnych znajdujących się w krezce oraz jeżeli to konieczne ich omacywanie i nacięcie;
8) oględziny oraz, jeżeli to konieczne, omacywanie i przecięcie śledziony;
9) oględziny nerek po wyłuszczeniu z torebki tłuszczowej i otoczki, a w razie potrzeby nacięcie nerek i węzłów chłonnych nerkowych;
10) oględziny opłucnej i otrzewnej;
11) oględziny narządów płciowych;
12) oględziny oraz, jeżeli to konieczne, omacywanie i nacięcie wymienia i przynależnych węzłów chłonnych; u krów obie połowy wymienia przecina się długim cięciem poprowadzonym w taki sposób, aby zatoki mleczne oraz węzły chłonne wymienia zostały nacięte, przy czym nie jest to konieczne, jeśli wymię nie jest przeznaczone do spożycia przez ludzi;
13) badanie laboratoryjne bydła powyżej 30 miesiąca życia w kierunku gąbczastej encefalopatii bydła (BSE);
14) oględziny kanału kręgowego bydła w wieku powyżej 12 miesiąca życia w celu stwierdzenia, czy usunięto z niego rdzeń kręgowy, oponę twardą oraz tkankę tłuszczową.
2. Badanie bydła oraz jeleni i danieli utrzymywanych w warunkach fermowych poniżej sześciu tygodni życia obejmuje;
1) oględziny tuszy ze szczególnym uwzględnieniem wykrwawienia, żółtaczki, wodnicy, inwazji pasożytniczych i innych;
2) oględziny głowy i jamy gardłowej, nacięcie węzłów chłonnych pozagardłowych, omacywanie języka, usunięcie migdałków;
3) oględziny płuc, tchawicy i przełyku, omacywanie płuc, zbadanie i nacięcie węzłów chłonnych tchawiczno-oskrzelowych i śródpiersiowych;
4) oględziny worka osierdziowego i serca, przecięcie serca podłużnym cięciem dla otwarcia komór oraz przecięcie podłużnie przegrody międzykomorowej;
5) oględziny przepony;
6) oględziny i omacywanie wątroby oraz węzłów chłonnych wątrobowych i trzustkowych oraz jeżeli to konieczne, nacięcie wątroby oraz przynależnych węzłów chłonnych;
7) oględziny przewodu pokarmowego, krezki, węzłów chłonnych żołądkowych i krezkowych oraz jeżeli to konieczne, ich nacięcie;
8) oględziny oraz, jeżeli to konieczne, omacywanie śledziony;
9) oględziny nerek oraz, jeżeli to konieczne, nacięcie nerek i węzłów chłonnych nerkowych;
10) oględziny opłucnej i otrzewnej;
11) oględziny i omacywanie okolic pępowiny oraz stawów, a w przypadku wątpliwości nacięcie okolic pępowiny i otwarcie stawów;
12) w przypadku wątpliwości można dokonać dalszych nacięć i badań odpowiednich części ciała zwierzęcia, jeśli są one niezbędne do podjęcia ostatecznej oceny;
13) jeżeli wykonanie nacięć węzłów chłonnych (plasterkowanie) jest obowiązkowe, to liczba nacięć nie powinna być mniejsza niż 3.
3. Badanie świń obejmuje:
1) oględziny tuszy;
2) oględziny głowy i jamy gardłowej, badanie i nacięcie węzłów chłonnych żuchwowych; oględziny jamy ustnej, gardła oraz języka, usunięcie migdałków;
3) oględziny płuc, tchawicy i przełyku, omacywanie płuc oraz nacinanie węzłów chłonnych tchawiczno-oskrzelowych i śródpiersiowych, przecięcie tchawicy i głównych pni oskrzelowych wzdłuż ich przebiegu, nacięcie płuc poprzecznie do ich osi w 1/3 dolnej; nacięcia te nie są konieczne, jeżeli płuca nie są przeznaczone do spożycia przez ludzi;
4) oględziny worka osierdziowego i serca, przecięcie serca podłużnym cięciem w celu otworzenia komór oraz przecięcie podłużnie przegrody międzykomorowej;
5) oględziny przepony;
6) oględziny wątroby oraz węzłów chłonnych wątrobowych i trzustkowo-dwunastniczych, omacywanie wątroby oraz jej węzłów chłonnych;
7) oględziny przewodu pokarmowego, krezki, węzłów chłonnych żołądkowych i krezkowych, omacywanie węzłów chłonnych żołądkowych i krezkowych oraz, jeżeli to konieczne, ich nacięcie;
8) oględziny oraz, jeżeli to konieczne, omacywanie śledziony;
9) oględziny nerek oraz, jeżeli to konieczne, nacięcie nerek i węzłów chłonnych nerkowych;
10) oględziny opłucnej i otrzewnej;
11) oględziny narządów płciowych;
12) oględziny i omacywanie wymienia i przynależnych węzłów chłonnych, nacięcie węzłów chłonnych wymieniowych u macior;
13) w przypadku wątpliwości można dokonać dalszych nacięć i badań odpowiednich części ciała zwierzęcia, jeżeli są one niezbędne do podjęcia ostatecznej oceny;
14) jeżeli wykonanie nacięć węzłów chłonnych (plasterkowanie) jest obowiązkowe, to liczba nacięć (plasterkowanie) nie powinna być mniejsza niż 3.
4. Badanie owiec i kóz obejmuje:
1) oględziny tuszy;
2) oględziny głowy po zdjęciu skóry oraz w przypadku wątpliwości badanie jamy ustnej, gardła, języka i węzłów chłonnych pozagardłowych oraz przyuszniczych; badanie to nie jest konieczne, jeżeli głowa wraz z językiem i mózgiem nie będzie przeznaczona do spożycia przez ludzi;
3) oględziny płuc, tchawicy i przełyku, omacywanie płuc oraz węzłów chłonnych tchawiczno-oskrzelowych i śródpiersiowych oraz, jeżeli to konieczne, nacięcie tych narządów oraz przynależnych do nich węzłów chłonnych;
4) oględziny worka osierdziowego i serca oraz, jeżeli to konieczne, jego przecięcie i zbadanie;
5) oględziny przepony;
6) oględziny wątroby oraz węzłów chłonnych wątrobowych i trzustkowo-dwunastniczych, oględziny i omacywanie wątroby oraz jej węzłów chłonnych trzustkowo-dwunastniczych, nacięcie żołądkowej części wątroby w celu zbadania przewodów wątrobowych;
7) oględziny przewodu pokarmowego, krezki, węzłów chłonnych żołądkowych i krezkowych;
8) oględziny oraz, jeżeli to konieczne, omacywanie śledziony;
9) oględziny nerek oraz, jeżeli to konieczne, nacięcie nerek i węzłów chłonnych nerkowych;
10) oględziny opłucnej i otrzewnej;
11) oględziny narządów płciowych;
12) oględziny wymienia wraz z węzłami chłonnymi;
13) oględziny i omacywanie okolic pępowiny oraz stawów u młodych zwierząt oraz, jeżeli to konieczne, nacięcie okolicy pępowiny i otwarcie stawów;
14) oględziny kanału kręgowego owiec i kóz w wieku powyżej 12 miesiąca życia w celu stwierdzenia, czy usunięto z niego rdzeń kręgowy, oponę twardą oraz tkankę tłuszczową, jeżeli w trakcie obróbki poubojowej dokonano przepołowienia tuszy;
15) w przypadku wątpliwości można dokonać dalszych nacięć i badań odpowiednich części ciała zwierzęcia, jeżeli są one niezbędne do podjęcia ostatecznej oceny;
16) jeżeli wykonanie nacięcia węzłów chłonnych (plasterkowanie) jest obowiązkowe, to liczba nacięć nie powinna być mniejsza niż 3.
5. Badanie koni, osłów i ich mieszańców obejmuje:
1) oględziny tuszy;
2) oględziny głowy po uwolnieniu języka i odsłonięciu jamy gardłowej oraz, jeżeli to konieczne, nacięcie węzłów chłonnych zagardłowych bocznych i przyśrodkowych, żuchwowych oraz oględziny błony śluzowej przegrody nosowej, usunięcie migdałków;
3) oględziny płuc, tchawicy i przełyku, omacywanie płuc, nacięcie i zbadanie węzłów tchawiczno-oskrzelowych i śródpiersiowych, przecięcie tchawicy i głównych pni oskrzelowych wzdłuż ich przebiegu, przecięcie płuc poprzecznie do ich osi w dolnej 1/3 długości, przy czym nacięcia te nie są konieczne, jeżeli płuca nie są przeznaczone do spożycia przez ludzi;
4) oględziny worka osierdziowego i serca, przecięcie podłużnie mięśnia sercowego oraz przegrody międzykomorowej;
5) oględziny przepony;
6) oględziny i omacywanie wątroby oraz węzłów chłonnych wątrobowych i trzustkowo-dwunastniczych oraz, jeżeli to konieczne, nacięcie wątroby i przynależnych węzłów chłonnych;
7) oględziny przewodu pokarmowego, krezki, węzłów chłonnych żołądkowych i krezkowych oraz, jeżeli to konieczne, nacięcie tych węzłów;
8) oględziny oraz jeżeli to konieczne omacywanie śledziony;
9) oględziny nerek oraz, jeżeli to konieczne, ich nacięcie wraz z węzłami chłonnymi;
10) oględziny opłucnej i otrzewnej;
11) oględziny narządów płciowych ogierów i klaczy;
12) oględziny i omacywanie wymienia i przynależnych węzłów chłonnych oraz, jeżeli to konieczne, nacięcie węzłów chłonnych pachwinowych powierzchownych;
13) oględziny i omacywanie okolic pępowiny oraz stawów młodych zwierząt oraz, jeżeli to konieczne, nacięcie okolicy pępowiny, otwarcie stawów;
14) zbadanie wszystkich siwych i białych koni w kierunku występowania czerniako-mięsaków w mięśniach i węzłach chłonnych, poprzez wykonanie głębokich cięć pod łopatkami poniżej chrząstki łopatkowej, zbadanie wyłuszczonych z torebki nerek poprzez wykonanie nacięcia przez cały miąższ organu;
15) w przypadku wątpliwości, można dokonać dalszych nacięć i badań odpowiednich części ciała zwierzęcia, jeżeli są one niezbędne do podjęcia ostatecznej oceny;
16) jeżeli wykonanie nacięć węzłów chłonnych (plasterkowanie) jest obowiązkowe, to liczba nacięć nie powinna być mniejsza niż 3.
Załącznik nr 4
METODY BADANIA NA WŁOŚNIE
l. Badanie kompresorowe
1. Sprzęt i odczynniki:
1) trychinoskop o powiększeniu 50 x i 80–100 x;
2) kompresor składający się z dwóch płytek szklanych, z których jedna jest podzielona na równe obszary;
3) małe zakrzywione nożyczki;
4) pinceta, nóż do wycinania próbek;
5) małe ponumerowane pojemniki do oddzielnego przechowywania próbek;
6) zakraplacz;
7) kwas octowy i roztwór wodorotlenku potasu do rozjaśniania zwapnień lub zmiękczania suszonego mięsa.
2. Pobieranie próbek:
1) w przypadku całych tusz pobiera się przynajmniej jedną próbkę o wielkości orzecha laskowego z obu odnóg przepony na odcinku przejścia części mięśniowej w ścięgnistą;
2) jeżeli jest tylko jedna odnoga przepony, pobiera się jedną próbkę o wielkości orzecha laskowego;
3) w przypadku braku obu odnóg przepony, pobiera się dwie próbki o przybliżonej wielkości orzecha laskowego z części żebrowej lub mostkowej przepony lub też z mięśni okołojęzykowych, żuchwowych lub brzusznych;
4) w przypadku części tuszy pobiera się z każdej części z różnych miejsc, w miarę możliwości położonych w okolicy kości i ścięgien, trzy próbki mięśni szkieletowych, o wielkości orzecha laskowego.
3. Metoda:
1) jeżeli są obie odnogi przepony, z każdej odnogi wycina się po 7 skrawków o wielkości ziarna owsa – łącznie 14 skrawków, a jeżeli jest jedna odnoga przepony, wycina się z niej 14 skrawków z różnych miejsc;
2) w przypadku całych tusz próbki pobiera się z części żebrowej lub mostkowej przepony, mięśni okołojęzykowych, żuchwowych lub mięśni brzusznych; wycina się 14 skrawków o wielkości ziarna owsa z każdej próbki, łącznie 28;
3) skrawki ściska się między płytkami szklanymi w taki sposób, aby można było przez przygotowany diapozytyw odczytać normalny druk;
4) jeżeli mięso próbek do badania jest suche i stare, preparaty zmiękcza się w mieszance o składzie jedna część roztworu wodorotlenku potasu i dwie części wody przez 10 do 20 minut przed rozpoczęciem badania;
5) z każdej próbki pobranej z części tuszy (elementu mięsnego) wycina się po 8 skrawków o wielkości ziarna owsa, łącznie 24 skrawki;
6) jeżeli uzyskane wyniki badania nie są jednoznaczne, badanie kontynuuje się na większej liczbie próbek za pomocą większych powiększeń lub pod mikroskopem lub metodą wytrawiania;
7) badanie przeprowadza się przy powiększeniu 30–40x, w czasie nie krótszym niż 5 minut, przy czym w przypadku próbek zastępczych, pobranych z części żebrowej lub mostkowej przepony, mięśni okołojęzykowych, żuchwowych lub mięśni brzusznych przeprowadza się je przez przynajmniej 10 minut; minimalny czas ustalony na badania nie zawiera czasu koniecznego do pobierania próbek i przygotowywania preparatów;
8) badający nie powinien sprawdzić więcej niż 840 skrawków dziennie; w wyjątkowych przypadkach dopuszcza się zbadanie do 1050 skrawków dziennie.
II. Metoda wytrawiania
1. Sprzęt i materiał:
1) nóż do pobierania próbek;
2) matę ponumerowane pojemniki z zamknięciem, do przechowywania próbek, w razie konieczności do powtórzenia badania;
3) cieplarka;
4) 2–3-litrowy rozdzielacz szklany ze statywem, gumowy przewód łączący, klamry do mocowania przewodu łączącego;
5) sito plastikowe (o średnicy ok. 18 cm i o średnicy otworów ok. 1 mm);
6) gaza;
7) mata stożkowa kolba ze szczelnym zamknięciem;
8) zlewka szklana;
9) rozdrabniacz mięsa;
10) stereomikroskop (powiększenie 15–40 x) z odpowiednim źródłem światła;
11) płyn wytrawiający sporządzony w następujący sposób: 10 g pepsyny (1200 u/g; 80 u/g FIP), 5 ml HCI (przynajmniej 37%), dopełniony do objętości 1 l wodą.
2. Pobieranie próbek:
1) w przypadku całych tusz, pobiera się próbkę o wadze co najmniej 20 g z odnogi przepony w miejscu jej przejścia w część ścięgnistą;
2) w przypadku braku odnóg przepony, pobiera się próbki o wadze co najmniej 20 g z części żebrowej lub mostkowej przepony, z mięśni okołojęzykowych, mięśni żuchwowych lub z mięśni brzusznych;
3) w przypadku części tuszy pobiera się próbkę o wadze co najmniej 20 g z mięśni szkieletowych, jeżeli to możliwe bez tłuszczu, z miejsc położonych blisko kości lub ścięgien.
3. Metoda:
1) dla badania łącznej próbki mięsa z 10 świń przygotowuje się po 10 g z każdej pojedynczej próbki 20-gramowej, a pozostałe 10 g zatrzymuje się na wypadek, gdyby dodatkowe badanie pojedynczej próbki okazało się konieczne;
2) 10 próbek, każda o wadze 10 g, łączy się w jedną próbkę, którą się rozdrabnia w rozdrabniaczu mięsa (z otworami średnicy 2 mm) i rozmieszcza się luźno na sicie wyścielonym warstwą gazy, które następnie umieszcza się na lejku nałożonym na rozdzielacz połączony przewodem gumowym z matą stożkową kolbą, rozdzielacz napełnia się do krawędzi płynem wytrawiającym do momentu, w którym materiał badany nie zostanie przykryty; proporcje materiału poddanego badaniu do płynu wytrawiającego wynoszą w przybliżeniu 1:20 do 1:30;
3) po 18–20 godzinach inkubacji w temperaturze 37–39°C odłącza się stożkową kolbę, po czym, po ostrożnym odciągnięciu cieczy sklarowanej nad osadem, osad znajdujący się w końcówce kolby ostrożnie przenosi się na płytkę, a następnie bada na obecność włośni za pomocą stereomikroskopu o powiększeniu 20–40-krotnym;
4) w przypadku pozytywnego lub niepewnego wyniku próbki łącznej bada się pozostałe pojedyncze próbki, każdą z osobna po dodaniu do nich dalszych 20 g próbek z mięsa każdej świni, lub w wypadku części tusz, po dodaniu 20 g próbki z mięsa każdej części, zgodnie z ust. 2.
III. Metoda wytrawiania prób zbiorczych
1. Sprzęt i odczynniki:
1) nóż i pinceta do pobierania próbek;
2) rozdrabniacz mięsa z otworami o średnicy od 2 do 3 mm;
3) kolba Erlenmeyera o pojemności 3 ml z korkiem gumowym lub bawełnianowełnianym;
4) rozdzielacz stożkowy oddzielający o pojemności 2000 ml;
5) statyw o długości ok. 28 cm z 80 cm korpusem;
6) pierścień o średnicy 10 lub 11 cm przymocowany do statywu;
7) uchwyt z płaskimi zaciskami (23 x 40 mm), przymocowany do statywu z podwójną złączką;
8) sito (o oczkach 177 mikronów) o zewnętrznej średnicy 11 cm z siatką mosiężną lub ze stali nierdzewnej;
9) plastikowy lejek z wewnętrzną średnicą nie mniejszą niż 12 cm;
10) stereomikroskop (powiększenie 15–40x) z odpowiednim źródłem światła lub trychinoskop ze stołem poziomym;
11) w przypadku stosowania trychinoskopu: rynienka do liczenia larw o pojemności ok. 60–65 cm3, wykonana z akrylowych płytek o grubości 3 mm w ten sposób, że podzielone na pola dno rynienki ma wymiary 180 x 40 mm; boki mają wymiary 230 x 20 mm, a szczyty – 40 x 20 mm; dno i szczyty rynienki umieszcza się pomiędzy jej bokami, co tworzy dwa uchwyty na końcach; dno rynienki powinno być podwyższone 7–9 mm od podstawy ramy utworzonej przez boki i szczyty;
12) płytki Petriego o średnicy 9 cm, w przypadku używania stereomikroskopu, podzielone od spodu na pola 10 x 10 mm;
13) kalibrowane 100 ml szklane cylindry;
14) kwas solny o stężeniu 37%;
15) pepsyna o mocy 1:10000 NF (Narodowy Receptariusz USA) odpowiadającej 1:12.500 BP (Farmakopea Brytyjska) lub 2000 FIP (Międzynarodowa Federacja Farmacji);
16) tace odpowiednie do zgromadzenia 50 lub 100 prób;
17) waga o dokładności do 0,1 g.
2. Pobieranie próbek:
1) w przypadku całych tusz pobiera się próbkę o wadze około 2 g z odnóg przepony w przejściu w część ścięgnistą;
2) w przypadku braku odnóg przepony pobiera się próbkę o wadze około 2 g z części żebrowej lub mostkowej przepony, z mięśni okołojęzykowych lub żuchwowych lub z mięśni brzusznych;
3) w przypadku kawałków mięsa pobiera się próbkę o wadze około 2 g z mięśni szkieletowych, o możliwie najmniejszej zawartości tłuszczu, w miarę możliwości z miejsca w pobliżu kości lub ścięgien.
3. Metoda:
1) tworzenie próby zbiorczej ze 100 próbek:
a) próbkę o wadze około 1 g pobiera się, z każdej z pojedynczych próbek pobranych z mięsa 100 świń, a następnie umieszcza się je w rozdrabniaczu mięsa,
b) rozdrobnione mięso umieszcza się w trzylitrowej kolbie Erlenmeyera razem z 7 g pepsyny, 2 l wody podgrzanej do temperatury 40–41 °C i 25 ml stężonego kwasu solnego, a następnie wstrząsa się tą mieszanką w celu rozpuszczenia pepsyny; zasadowość roztworu powinna wynosić 1,5–2,0 pH,
c) dla ułatwienia wytrawiania kolbę Erlenmeyera umieszcza się w cieplarce o temperaturze 40–41°C na około 4 godziny; w tym czasie kolbę regularnie wstrząsa się co najmniej 2 razy na godzinę,
d) roztwór po wytrawieniu przefiltrowuje się przez sito do rozdzielacza o pojemności 2 l i pozostawia na stojaku przynajmniej przez 1 godzinę,
e) uzyskany płyn o objętości około 45 ml przelewa się do kalibrowanego cylindra, a następnie rozdziela się na trzy płytki Petriego, po 15 ml na każdą płytkę, której dno jest podzielone na kwadraciki 10 x 10 mm,
f) każdą płytkę Petriego bada się przez 1 minutę na obecność larw pod stereomikroskopem,
g) przy stosowaniu rynienek do liczenia larw uzyskany płyn równo rozdziela się na dwie rynienki i bada się pod trychinoskopem; płyn bada się niezwłocznie,
h) jeżeli płyn jest mętny lub nie został zbadany w czasie 30 minut od jego uzyskania, oczyszcza się go w następujący sposób:
– 45 ml pozyskanego płynu przelewa się do kalibrowanego cylindra i pozostawia na 10 minut,
– po upływie tego czasu poprzez zassanie odejmuje się 30 ml supernatantu, a pozostałe 15 ml uzupełnia się do 45 ml wodą,
– po upływie kolejnych 10 minut ponownie 30 ml supernatantu usuwa się, a pozostałe 15 ml przelewa się na płytkę Petriego lub na rynienkę do liczenia larw,
i) kalibrowany cylinder opłukuje się 10 ml wody, a następnie przelewa się ją na płytkę Petriego lub na rynienkę do liczenia larw;
2) tworzenie próby zbiorczej z mniej niż 100 próbek:
a) jeżeli jest 15 lub mniej niż 15 pojedynczych próbek, mogą być one dodane do próby zbiorczej i bada się je razem,
b) jeżeli bada się więcej niż 15, a mniej niż 100 próbek, objętość płynu wytrawiającego zmniejsza się proporcjonalnie;
3) w przypadku pozytywnego lub wątpliwego wyniku badania próby zbiorczej:
a) dalsze 20 g próbki pobiera się od każdej świni, zgodnie z ust. 2,
b) 20 g próbki od każdej świni łączy się i bada metodą określoną w pkt 1 i 2,
c) próbki z 20 świń po 5 świń każda bada się w sposób określony w lit. a i b,
d) jeżeli w próbie zbiorczej od 5 świń wykryto włośnie, pobiera się próbki o wadze 20 g, zgodnie z ust. 2.
IV. Metoda mechanicznie wspomaganego wytrawiania próby zbiorczej (technika sedymentacji)
1. Sprzęt i odczynniki:
1) nóż i nożyczki;
2) tace z ponumerowanymi polami na 50 prób mięsa, po 2 g każda;
3) stomacher 3500 thermomodel;
4) plastikowe torebki do stomachera;
5) stożkowe rozdzielacze o pojemności 2 l zaopatrzone w teflonowe zatyczki;
6) statywy, pierścienie, zaciski;
7) sito o otworach 177 mikronów, średnicy zewnętrznej 11 cm i siatka ze stali nierdzewnej;
8) lejki o wewnętrznej średnicy nie mniejszej niż 12 cm do stabilizacji sit;
9) 100 ml szklane, kalibrowane cylindry;
10) 25 ml rozdzielacz;
11) zlewki o pojemności 3 l;
12) łyżka lub szklany pręt do mieszania roztworu w zlewce;
13) plastikowe: strzykawka i wężyk do odsysania;
14) miarka o pojemności 6 g;
15) termometr o dokładności ± 0,5°C i o zakresie od 1 do 100°C;
16) elektryczny potrząsacz z odejmowaną głowicą (wibrator);
17) minutnik pracujący w przedziałach 1 minuty;
18) trychinoskop z poziomym pulpitem lub stereomikroskop z odpowiednim źródłem światła;
19) rynienka do liczenia larw wykonana w sposób określony w części III ust. 1 pkt 11, jeżeli stosowany jest trychinoskop;
20) płytki Petriego o średnicy 9 cm podzielone od spodu na pola badań o wymiarach 10 x 10 mm;
21) 17,5% roztwór kwasu solnego;
22) pepsyna odpowiadająca wymaganiom określonym w części III ust. 1 pkt 15;
23) 10 l pojemniki do dekontaminacji formaliną sprzętu i pozostałego płynu wytrawiającego;
24) waga o dokładności do 0,1 g.
2. Próbki pobiera się w sposób określony w części III ust. 2.
3. Metoda:
1) sposób wytrawiania:
a) próba zbiorcza ze 100 próbek:
– stomacher powinien być zaopatrzony w podwójną plastikową torebkę i urządzenie do utrzymania temperatury 40–41 °C,
– 1,5 l wody podgrzanej do temperatury 32–35°C przelewa się do wewnętrznej torebki plastikowej i następnie wodę podgrzewa się do temperatury 40–41 °C,
– 25 ml 17,5% kwasu solnego dodaje się do wody w stomacherze,
– następnie dodaje się 100 próbek o wadze 1 g każda (o temperaturze 25–30°C), pobranych z każdej indywidualnej próby zgodnie z ust. 2,
– na końcu dodaje się 6 g pepsyny,
– zawartość stomachera odstawia się na 25 minut,
– następnie torebkę wyjmuje się ze stomachera, a płyn wytrawiający filtruje się przez sito do 3 l zlewki,
– plastikową torebkę przepłukuje się 100 ml wody, a następnie przez sito przelewa się ją do filtratu w zlewce,
b) próba zbiorcza złożona z mniej niż 100 próbek:
– stomacher powinien być zaopatrzony w podwójną plastikową torebkę i urządzenie do utrzymania temperatury 40–41°C,
– płyn wytrawiający sporządza się przez wymieszanie ok. 1,5 l wody, 25 ml 17,5% kwasu solnego i 6 g pepsyny przy zachowaniu temperatury 40–41 °C,
– z płynu wytrawiającego odmierza się 15 ml na 1 g próbki i tę ilość płynu z próbkami 1 g o temperaturze 25–30°C przenosi się do wewnętrznej torebki,
– wodę o temperaturze 41 °C przelewa się do zewnętrznej torebki, tak aby całkowita objętość w obu torebkach wynosiła 1,5 l,
– zawartość stomachera odstawia się na 25 minut,
– następnie torebkę wyjmuje się ze stomachera, a płyn wytrawiający filtruje się przez sito do 3 l zlewki,
– plastikową torebkę przepłukuje się w 100 ml wody, którą następnie przelewa się przez sito do filtratu w zlewce;
2) oddzielanie larw metodą sedymentacji:
a) lód o wadze 300–400 g w płatkach, łuskach lub pokruszony dodaje się do płynu wytrawiającego, doprowadzając jego objętość do 2 l, a następnie płyn ten miesza się do rozpuszczenia lodu, przy czym w przypadku mniejszej próby zbiorczej, określonej w pkt 1 w lit. b, ilość lodu odpowiednio zmniejsza się,
b) wychłodzony płyn wytrawiający przenosi się do 2 l rozdzielacza, wyposażonego w wibrator,
c) sedymentacja trwa 30 minut, przy czym wirowanie odbywa się w sposób przerywany, tj. 1 minuta wirowania i 1 minuta przerwy,
d) po 30 minutach wirowania, 60 ml sedymentu przenosi się niezwłocznie do 100 ml kalibrowanego cylindra,
e) 60 ml sedymentu odstawia się na co najmniej 10 minut, a następnie supernatant odsysa się, pozostawiając 15 ml do badania na obecność larw,
f) do odsysania stosuje się plastikową strzykawkę połączoną z plastikowym przewodem,
g) pozostałe 15 ml przelewa się do rynienki do liczenia larw lub dwu płytek Petriego i bada się pod trychinoskopem lub stereomikroskopem,
h) płyn wytrawiający bada się niezwłocznie,
i) jeżeli płyn wytrawiający jest mętny lub nie został zbadany w czasie 30 minut, po jego sporządzeniu:
– 60 ml próbkę końcową przelewa się do kalibrowanego cylindra i pozostawia na 10 minut,
– po upływie 10 minut odsysa się 45 ml supernatantu, a pozostałe 15 ml uzupełnia się wodą do objętości 45 ml,
– po upływie następnych 10 minut odsysa się 30 ml supernatantu, a pozostałe 15 ml przelewa się na płytkę Petriego lub rynienkę do przeprowadzania badania,
j) kalibrowany cylinder przepłukuje się 10 ml wody, którą następnie dodaje się do rynienki lub płytki Petriego;
3) w przypadkach pozytywnych lub wątpliwych wyników postępuje się w sposób określony w części III ust. 3 pkt 3.
V. Metoda mechanicznie wspomaganego wytrawiania próbki zbiorczej (technika izolacji filtrowej)
1. Oprócz sprzętu i odczynników wymienionych w części IV w ust. 1 używa się:
1) litrowego rozdzielacza (Gelmana) wyposażonego w uchwyt filtru (średnica 45 mm);
2) płytek filtrów o średnicy 45 mm każda składających się z okrągłej siatki ze stali nierdzewnej z oczkami o średnicy 35 mikronów;
3) dwóch gumowych pierścieni grubości 1 mm, o średnicy zewnętrznej 45 mm i wewnętrznej 38 mm, z umieszczoną pomiędzy nimi okrągłą siatką, umocowaną do nich dwuskładnikowym klejem odpowiednim dla tych materiałów;
4) zlewki Erlenmeyera o pojemności 3 l zaopatrzonej w boczny wężyk do odsysania;
5) pompy filtrującej;
6) plastikowych torebek o pojemności co najmniej 80 ml każda;
7) sprzętu do zgrzewania torebek;
8) renniny o mocy 1:1 500 000 jednostek Soxleta na 1 g.
2. Próbki pobiera się w sposób określony w części III ust. 2.
3. Metoda:
1) do wytrawiania stosuje się metodę określoną w części IV ust. 3 pkt 1;
2) odddzielanie larw przez filtrowanie:
a) lód o wadze 300–400 g w płatkach, łuskach lub pokruszony dodaje się do płynu wytrawiającego, doprowadzając jego objętość do 2 l, przy czym w przypadku mniejszej próby zbiorczej ilość lodu odpowiednio zmniejsza się,
b) płyn wytrawiający miesza się do czasu rozpuszczenia lodu,
c) następnie płyn ten pozostawia się co najmniej na 3 minuty,
d) rozdzielacz (Gelmana) zaopatrzony w uchwyt i płytkę filtrującą umieszcza się w zlewce Erlenmeyera połączonej z pompą filtrującą,
e) płyn wytrawiający przelewa się do rozdzielacza (Gelmana), a następnie filtruje; pod koniec filtrowania przechodzenie płynu wytrawiającego przez filtr może być wspomagane zasysaniem z pompy filtrującej, przy czym zasysanie przerywa się, zanim filtr stanie się suchy, tj. kiedy 2 do 5 ml płynu pozostaje w rozdzielaczu,
f) po zakończeniu filtrowania płynu wytrawiającego dysk filtru wyjmuje się i umieszcza się w torebce o pojemności 80 ml razem z 15–20 ml roztworu renniny, który sporządza się przez dodanie 2 g renniny do 100 ml wody; filtry nie mogą być używane, jeśli nie są zupełnie czyste, filtrów nieoczyszczonych nie suszy się, oczyszcza się je przez pozostawienie w roztworze renniny na noc; przed użyciem filtry myje się w świeżym roztworze renniny z użyciem stomachera,
g) torebkę plastikową zgrzewa się dwukrotnie i umieszcza w stomacherze pomiędzy wewnętrzną i zewnętrzną torebką,
h) stomacher pozostawia się na 3 minuty niezależnie od tego, czy pracuje na pełnej, czy niepełnej próbie zbiorczej,
i) po 3 minutach torebkę plastikową z dyskiem filtru i roztworem renniny wyjmuje się ze stomachera i otwiera nożyczkami, płyn przelewa się do rynienki do liczenia larw lub na płytki Petriego, a torebkę przepłukuje się 5–10 ml wody, którą przelewa się do rynienki do badania pod trychinoskopem lub na pytki Petriego do badania pod stereomikroskopem,
j) płyn bada się niezwłocznie;
3) w przypadku pozytywnych lub wątpliwych wyników postępuje się w sposób określony w części III ust. 3 pkt 3.
VI. Metoda wytrawiania próby zbiorczej z zastosowaniem metody magnetycznego mieszania
1. Sprzęt i odczynniki:
1) nóż i nożyczki do sporządzania próbek;
2) tace z oznaczonymi 50 polami do przetrzymywania próbek o wadze 2 g każda;
3) rozdrabniacz mięśni;
4) mieszadła magnetyczne, z płytką o temperaturze regulowanej termostatem i pokrytymi teflonem prętami mieszającymi, o długości ok. 5 cm;
5) rozdzielacze stożkowe o pojemności 2 l;
6) statywy, pierścienie, uchwyty;
7) sito o siatce ze stali nierdzewnej z oczkami 177 mikronów o średnicy zewnętrznej 11 cm;
8) lejki o średnicy wewnętrznej nie mniejszej niż 12 cm, do umieszczenia sit;
9) zlewka o pojemności 3 l;
10) kalibrowane cylindry o pojemności ok. 50 ml lub cylindry wirówkowe;
11) trychinoskop z poziomym pulpitem lub stereomikroskop z odpowiednim źródłem światła,
12) rynienka do liczenia larw, wykonana w sposób określony w części III ust. 1 pkt 11, jeżeli stosowany jest trychinoskop;
13) płytki Petriego o średnicy 9 cm, podzielone od spodu na pola 10 x 10 mm, jeżeli stosowany jest stereomikroskop;
14) folia aluminiowa;
15) kwas solny 25%;
16) pepsyna odpowiadająca wymaganiom określonym w części III ust. 1 pkt 15;
17) woda podgrzana do temperatury 46–48°C;
18) 10 l pojemniki do dekontaminacji formaliną sprzętu i pozostałego płynu wytrawiającego;
19) waga z dokładnością do 0,1 g.
2. Próbki pobiera się w sposób określony w części III ust. 2.
3. Metoda:
1) tworzenie próby zbiorczej ze 100 próbek:
a) z pojedynczych 100 próbek pobiera się próbki o wielkości 1 g, rozdrabnia się je w rozdrabniaczu,
b) rozdrobnione mięso przenosi się do 3-litrowej zlewki, dodaje się 10 g pepsyny, 2 l wody podgrzanej do temperatury 46–48°C oraz 16 ml kwasu solnego,
c) w celu oddzielenia przyczepionych skrawków mięśni wkładkę mieszającą rozdrabniacza niezwłocznie wkłada się do zlewki z płynem wytrawiającym,
d) pręcik mieszający umieszcza się w zlewce, którą przykrywa się folią aluminiową,
e) po umieszczeniu zlewki na podgrzanej płytce grzewczej mieszadła magnetycznego rozpoczyna się proces mieszania, przed jego rozpoczęciem sprawdza się, czy mieszadło utrzymuje stałą temperaturę 44–46°C oraz uzyskuje maksymalne wirowanie płynu,
f) płyn wytrawiający miesza się 30 minut, po czym wyłącza się mieszadło, a płyn przelewa się przez sito do rozdzielacza sedymentacyjnego,
g) płyn w rozdzielaczu odstawia się na 30 minut,
h) po 30 minutach płyn z osadem w ilości 40 ml szybko przelewa się do kalibrowanego cylindra lub cylindra wirówki,
i) próbkę 40 ml pozostawia się na 10 minut, a następnie odsysa się 30 ml supernatantu, pozostawiając 10 ml,
j) pozostałe 10 ml osadu przelewa się do rynienki lub płytki Petriego,
k) następnie cylinder przepłukuje się 10 ml wody, którą dodaje się do rynienki lub płytki Petriego i niezwłocznie bada się pod trychinoskopem lub stereomikroskopem,
l) jeżeli badanie nie zostało przeprowadzone w czasie 30 minut, supernatant oczyszcza się w sposób następujący:
– końcową próbę 40 ml przelewa się do kalibrowanego cylindra i pozostawia na 10 minut,
– 30 ml supernatantu usuwa się pozostawiając 10 ml, który uzupełnia się wodą do 40 ml,
– po upływie kolejnych 10 minut 30 ml supernatantu odsysa się pozostawiając 10 ml do badania na płytce Petriego lub rynience,
– cylinder przepłukuje się 10 ml wody, którą dodaje się do płytki Petriego lub rynienki i poddaje badaniu,
m) jeżeli osad w czasie badania jest mętny, próbę przelewa się do kalibrowanego cylindra, uzupełnia się do 40 ml wodą; następnie postępuje się w sposób określony w lit. k;
2) próba zbiorcza składająca się z mniej niż 100 próbek:
a) w razie potrzeby nie więcej niż 15 próbek 1-gramowych dodaje się do próby zbiorczej złożonej ze 100 próbek i bada się razem, zgodnie z pkt 1,
b) więcej niż 15 próbek bada się jako oddzielną próbę zbiorczą,
c) dla prób złożonych z nie więcej niż 50 próbek, objętość płynu wytrawiającego redukuje się do 1 l;
3) w przypadku pozytywnych lub wątpliwych wyników postępuje się w sposób określony w części III ust. 3 pkt 3.
Załącznik nr 5

Załącznik nr 6
SZCZEGÓŁOWY SPOSÓB OCENY MIĘSA
l. Ocena mięsa bydła, świń, owiec, kóz, zwierząt jednokopytnych oraz jeleni, danieli utrzymywanych w warunkach fermowych
1. Za niezdatne do spożycia uznaje się:
1) mięso, pochodzące od zwierzęcia, u którego stwierdzono jedną z następujących chorób:
a) pryszczycę,
b) pęcherzykowe zapalenie jamy ustnej,
c) chorobę pęcherzykową świń,
d) księgosusz,
e) pomór małych przeżuwaczy,
f) zarazę płucną bydła,
g) guzowatą chorobę skóry bydła albo kliniczną postać białaczki bydła,
h) gorączkę doliny Rift albo gorączkę Q,
i) chorobę niebieskiego języka,
j) ospę owiec i kóz,
k) afrykański pomór koni,
l) afrykański pomór świń,
m) klasyczny pomór świń,
n) wąglik,
o) gąbczastą encefalopatię bydła,
p) ogólną actinobacilozę, promienicę, gruźlicę albo uogólnione zapalenie węzłów chłonnych,
r) szelestnicę,
s) nosaciznę,
t) wściekliznę,
u) tężec albo botulizm,
w) kliniczną postać salmonellozy,
z) kliniczną postać brucelozy,
za) różycę świń,
zb) kliniczną postać leptospirozy świń, bydła, owiec i kóz,
zc) posocznicę, ropnicę, toksemię albo wiremię,
zd) włośnicę, sarkocystozę, wągrzycę wywołaną przez C. cellulosae lub C. bovis (powyżej 10 wągrów w tuszy i jej narządach);
2) mięso ze zwierząt wykazujących ostre zmiany chorobowe przy zapaleniu oskrzeli i płuc, zapaleniu opłucnej, zapaleniu otrzewnej, zapaleniu macicy, zapaleniu wymienia, zapaleniu stawów, zapaleniu osierdzia, zapaleniu jelit oraz zapaleniu mózgu i opon mózgowych, potwierdzone szczegółowym badaniem, a jeżeli to możliwe – uzupełnione badaniem mikrobiologicznym oraz badaniem pozostałości środków farmaceutycznych, przy czym, jeżeli wyniki tych badań będą ujemne, tusza może być uznana za zdatną do spożycia po wcześniejszym usunięciu części niezdatnych do spożycia;
3) mięso ze zwierząt:
a) nienarodzonych,
b) młodych, jeżeli jest zbyt wodniste,
c) wykazujących objawy wychudzenia lub zaawansowanej anemii,
d) wykazujących liczne guzy, ropnie lub rany w różnych miejscach tuszy lub narządów wewnętrznych,
e) które reagowały dodatnio lub wątpliwie w teście na brucelozę, także w przypadku, gdy nie zostały stwierdzone zmiany w wymieniu, układzie rozrodczym oraz we krwi;
4) części tuszy z wylewami krwotocznymi, ograniczonymi ropniami lub zlokalizowanymi zanieczyszczeniami;
5) narządy wewnętrzne ze zmianami chorobowymi pochodzenia zakaźnego, pasożytniczego lub urazowego;
6) mięso wykazujące cechy zaparzenia (kwaśna przenikliwa fermentacja);
7) części tuszy i poszczególne narządy wewnętrzne z przynależnymi do nich węzłami chłonnymi, jeżeli zawierają ogniska zapalne serowaciejące lub ropne, przy czym zmiany te nie są uogólnione albo związane z wychudzeniem i znajdują się na powierzchni tuszy, narządu wewnętrznego lub w węźle chłonnym;
8) mięso pochodzące z wycięcia okolicy kłucia powstałego w celu wykrwawienia zwierzęcia; po wycięciu okolicy rany;
9) tusze, których narządy wewnętrzne nie zostały poddane badaniu poubojowemu;
10) mięso ze zwierząt, którym podawano substancje niedozwolone, produkty, które mogą spowodować, że mięso będzie szkodliwe dla zdrowia ludzi, substancje przyspieszające dojrzewanie mięsa;
11) mięso zawierające pozostałości substancji dodatkowych dozwolonych, pozostałości środków farmaceutycznych, w tym antybiotyków, pestycydów lub innych substancji szkodliwych dla zdrowia ludzi, w przypadku gdy przekraczają one dozwolony poziom określony odrębnymi przepisami;
12) płuca świń zanieczyszczone treścią pokarmową lub zalane wodą do oparzania;
13) mięso, które wydziela zapach płciowy, moczowy, rybny, tranowy lub inny spowodowany środkami leczniczymi lub odkażającymi, jeżeli smak lub zapach występuje przy próbie gotowania lub pieczenia wykonanej po upływie 24 godzin od chwili uboju zwierzęcia;
14) mięso wykazujące cechy rozkładu gnilnego;
15) mięso w przypadku stwierdzenia śmierci naturalnej zwierzęcia lub w przypadku uboju upozorowanego albo na skutek dobicia w agonii;
16) mięso w przypadku wodnicy ogólnej widocznej po upływie 24 godzin od chwili dokonania uboju;
17) mięso w przypadku ogólnej żółtaczki widocznej po upływie 24 godzin od chwili dokonania uboju lub jeżeli próba gotowania lub pieczenia mięsa wykonana po upływie tego czasu wykaże odchylenia smaku lub zapachu;
18) narządy wewnętrzne lub części tuszy ze zmianami gruźliczymi, pochodzące od zwierząt, które wykazywały wynik dodatni lub wątpliwy w przeprowadzonej przed ubojem śródskórnej próbie tuberkulinowej, z tym że jeżeli zmiany gruźlicze są stwierdzone wyłącznie w węzłach chłonnych, za niezdatne do spożycia należy uznać narząd lub część tuszy, do których przynależą tę węzły chłonne;
19) poszczególne narządy wewnętrzne z przynależnymi do nich węzłami chłonnymi, jeżeli tusza lub narządy wewnętrzne zawierają ogniska zapalne serowaciejące lub ropne, przy czym zmiany te nie są uogólnione albo związane z wychudzeniem i znajdują się na powierzchni tuszy, narządu wewnętrznego lub w węźle chłonnym;
20) wątrobę i nerki zwierząt starszych niż dwa lata, pochodzących z obszarów, na których, w wyniku badań kontrolnych, stwierdzono ponadnormatywną zawartość metali ciężkich w środowisku;
21) pęcherzyk żółciowy;
22) krew zwierzęcia, którego mięso uznane zostało za niezdatne do spożycia, oraz krew zanieczyszczona, krew techniczna;
23) mózg, rdzeń przedłużony i rdzeń kręgowy bydła, owiec, kóz;
24) śledzionę bydła, owiec i kóz;
25) mięso mechanicznie oddzielone z kręgosłupa bydła, owiec, kóz;
26) narządy płciowe samic i samców;
27) oczy, chrząstkowe części przewodu usznego zewnętrznego, migdałki, tchawicę;
28) wymię u macior i krów, jeśli nie zdjęto z nich skóry;
29) jelita grube jednokopytnych;
30) nieoczyszczone z treści żołądki, jelita, przełyki i pęcherze moczowe z zawartością moczu;
31) miejsca iniekcji;
32) dolne odcinki kończyn, jeśli nie zdjęto z nich skóry i racic;
33) zbliznowacone części tuszy i narządów wewnętrznych po wyleczonych procesach zapalnych lub okaleczeniach;
34) całą sztukę w przypadku dodatniego wyniku badania laboratoryjnego w kierunku gąbczastej encefalopatii bydła (BSE);
35) ocenę określoną w pkt 34 stosuje się odpowiednio do zwierzęcia poddanego ubojowi bezpośrednio przed zwierzęciem, u którego badaniem laboratoryjnym stwierdzono dodatni wynik, oraz do dwóch zwierząt ubitych po zwierzęciu z dodatnim wynikiem badania laboratoryjnego;
36) całą sztukę w przypadku, gdy wykonanie badań laboratoryjnych w kierunku gąbczastej encefalopatii bydła (BSE) jest niemożliwe, a zwierzę wykazywało objawy wskazujące na tę chorobę;
37) całą sztukę w przypadku, gdy wykonanie badań laboratoryjnych w kierunku gąbczastej encefalopatii bydła (BSE) jest niemożliwe, a zwierzę nie wykazywało objawów chorobowych wskazujących na tę chorobę, lecz podlegało obowiązkowi badania laboratoryjnego (bydło powyżej 30 miesiąca życia);
38) próbki mięsa pobrane do badania na włośnie.
2. Za warunkowo zdatne do spożycia uznaje się mięso pochodzące:
1) z bydła i świń w przypadku stwierdzenia inwazji wągrów Cysticercus cellulosae i Cysticercus bovis w nieznacznym stopniu, tj. do 10 wągrów w tuszy, głowie i narządach;
2) z niekastrowanych knurów, obojnaków, wnętrów i późnych kastratów świń;
3) ze zwierząt poddanych ubojowi na podstawie nakazu wydanego przez powiatowego lekarza weterynarii, pochodzących z obszaru, na którym stwierdzono pryszczycę, chorobę pęcherzykową lub klasyczny pomór świń.
3. Jeżeli mięsa warunkowo zdatnego do spożycia nie można poddać zabiegom uzdatniającym, określonym w przepisach odrębnych, ocenia się je i znakuje jako mięso niezdatne do spożycia.
II. Ocena mięsa drobiu
1. Za niezdatne do spożycia uznaje się:
1) mięso pochodzące od zwierzęcia, u którego stwierdzono jedną z następujących chorób:
a) influenzę drobiu (pomór drobiu),
b) rzekomy pomór drobiu,
c) salmonellozę,
d) cholerę,
e) ornitozę,
f) charłactwo,
g) wodobrzusze,
h) żółtaczkę,
i) aspergilozę,
j) toksoplazmozę,
k) nowotwory złośliwe;
2) mięso pochodzące od zwierząt, których śmierć nastąpiła z innych przyczyn niż ubój;
3) mięso ogólnie zanieczyszczone;
4) mięso wykazujące:
a) rozległe uszkodzenia mechaniczne i krwawe wybroczyny,
b) nieprawidłowości dotyczące zapachu, barwy, smaku lub konsystencji,
c) zmiany gnilne,
d) pasożyty podskórne lub mięśniowe,
e) objawy zatrucia,
f) białaczkę;
5) części ubitego zwierzęcia, z miejscowymi uszkodzeniami mechanicznymi, niewpływającymi na jakość zdrowotną pozostałej części tuszy;
6) tchawicę, płuca, przełyk, wole, jelito i pęcherzyk żółciowy;
7) mięso zawierające pozostałości substancji biologicznych, chemicznych i leków weterynaryjnych, w przypadku gdy przekraczają dozwolony poziom określony innymi przepisami.
2. Za warunkowo zdatne uznaje się mięso pochodzące ze zwierząt, u których podczas badania poubojowego stwierdzono zmiany wskazujące na salmonellozę, potwierdzone badaniem bakteriologicznym,
III. Ocena mięsa królików i nutrii
Za mięso niezdatne do spożycia uznaje się:
1) mięso, jeżeli badanie potwierdzi, że zwierzę, od którego pochodzi, było dotknięte chorobą zakaźną przenoszącą się na ludzi i zwierzęta;
2) mięso wykazujące:
a) ogniska zapalne lub liczne ropnie,
b) pasożyty podskórne lub mięśniowe,
c) zmiany wskazujące na zatrucie,
d) rozległe uszkodzenia mechaniczne lub krwawe wybroczyny,
e) nieprawidłowości dotyczące zapachu, barwy, smaku lub konsystencji,
f) zmiany gnilne;
3) mięso zawierające pozostałości substancji biologicznych, chemicznych i środków farmaceutycznych, w przypadku gdy przekraczają dozwolony poziom określony innymi przepisami;
4) części zwierzęcia poddanego ubojowi, w których stwierdzono miejscowe urazy mechaniczne niemające wpływu na jakość zdrowotną tuszy.
IV. Ocena mięsa zwierząt łownych
Za niezdatne do spożycia uznaje się mięso:
1) pochodzące od zwierząt łownych, których zachowanie odbiegało od naturalnego, lub ze zwierząt pochodzących z obszarów objętych czasowym zakazem polowań i odłowów zwierząt łownych;
2) jeżeli badanie po odstrzeleniu zwierzęcia wykazało:
a) obecność włośni,
b) zapalenie stawów, jąder lub jelit,
c) liczne guzy lub ropnie,
d) zmiany w wątrobie lub śledzionie,
e) obecność ciał obcych w jamach ciała, zwłaszcza w żołądku i jelitach lub w pęcherzu moczowym,
f) znaczne ilości gazu w żołądku i jelitach, wraz z odbarwieniem narządów wewnętrznych,
g) zmiany dotyczące barwy, zapachu, smaku lub konsystencji,
h) zmiany gnilne,
i) złamania otwarte, jeżeli nie są bezpośrednio związane z polowaniem,
j) wychudzenie,
k) ogólny lub umiejscowiony obrzęk,
l) inne zmiany chorobowe.
Załącznik nr 7


- Data ogłoszenia: 2002-09-23
- Data wejścia w życie: 2002-10-08
- Data obowiązywania: 2002-10-08
- Dokument traci ważność: 2004-05-01
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
