REKLAMA
Dziennik Ustaw - rok 2001 nr 108 poz. 1184
ROZPORZĄDZENIE MINISTRA ROLNICTWA l ROZWOJU WSI
z dnia 14 sierpnia 2001 r.
w sprawie rejestracji odmian i udzielania ochrony wyłącznego prawa do odmiany oraz wytwarzania i kontroli materiału siewnego
Na podstawie art. 23 pkt 1–4, art. 41 pkt 1 i 3, art. 46, art. 62 pkt 1–3, 7 i 8, art. 67a, art. 70 ust. 2 ustawy z dnia 24 listopada 1995 r. o nasiennictwie (Dz. U. z 2001 r. Nr 53, poz. 563 i Nr 76, poz. 811) zarządza się, co następuje:
Rozdział 1
Przepisy ogólne
§ 1.
1) wykaz roślin uprawnych, których odmiany wpisuje się do rejestru,
2) wykaz roślin uprawnych, których wpisanie do rejestru wymaga stwierdzenia zadowalającej wartości gospodarczej,
3) wykaz roślin uprawnych, których wartość gospodarczą odmian bada się po ich wpisaniu do rejestru,
4) szczegółowe wymagania obowiązujące przy zgłaszaniu, wpisywaniu i skreślaniu odmian z rejestru, nadawaniu im nazw, urzędowym badaniu odmian, prowadzeniu rejestru oraz przy dokonywaniu lustracji hodowli lub zachowania w inny sposób odmian zgłoszonych lub wpisanych do rejestru,
5) szczegółowe wymagania obowiązujące przy składaniu wniosku o przyznanie wyłącznego prawa i urzędowym badaniu odmian, przyznaniu i pozbawieniu wyłącznego prawa oraz prowadzeniu księgi i spisu,
6) wykaz roślin, których materiał siewny ze zbioru odmiany chronionej może być przez posiadacza gruntów stosowany jako materiał siewny bez zgody hodowcy w ilości potrzebnej na obsianie lub obsadzenie uprawy gruntowej rośliny rolniczej do 2 ha,
7) wymagania dotyczące wytwarza nią kwalifikowanego i standardowego materiału siewnego, izolacji przestrzennej od innych upraw, czystości gatunkowej i odmianowej, zdrowotności oraz maksymalnej ilości rozmnożeń materiałów hodowlanych, a w zależności od tego – stopni kwalifikacji materiału siewnego,
8) wymagania dotyczące jakości materiału siewnego, a w szczególności zdolności kiełkowania lub tożsamości gatunkowej i odmianowej oraz zanieczyszczeń i zdrowotności,
9) dopuszczalną wielkość produkcji w ciągu roku materiału siewnego warunkowo kwalifikowanego dla poszczególnych roślin (grup roślin),
10) szczegółowe zasady składania wniosku o ocenę materiału siewnego,
11) sposób i tryb przeprowadzania kontroli materiału siewnego, a w szczególności czas prowadzenia kontroli, sposób sporządzania dokumentacji i sposób postępowania pokontrolnego oraz sposób postępowania przy pobieraniu prób materiału siewnego,
12) terminy ważności świadectwa materiału siewnego w zależności od rośliny, wyników oceny oraz rodzaju opakowania,
13) dokumenty dotyczące oceny materiału siewnego, wystawione za granicą, uznawane za równoważne krajowym świadectwom,
14) zakres i terminy składania informacji dotyczących obrotu materiałem siewnym,
15) szczegółowe zasady prowadzenia dokumentacji dotyczącej wytwarzania i obrotu materiałem siewnym,
16) wykaz populacji miejscowych mających szczególne znaczenie dla ochrony różnorodności biologicznej,
17) stawki opłaty hodowlanej.
Rozdział 2
Rejestracja odmian roślin uprawnych
§ 2.
2. Określa się wykaz roślin uprawnych, których wpisanie do rejestru odmian roślin uprawnych, wymaga stwierdzenia zadowalającej wartości gospodarczej, stanowiący załącznik nr 2 do rozporządzenia.
3. Określa się wykaz roślin, których wartość gospodarczą odmian bada się po ich wpisaniu do rejestru odmian roślin uprawnych, stanowiący załącznik nr 3 do rozporządzenia.
1) imię i nazwisko albo nazwę oraz adres zamieszkania albo siedzibę,
2) imię i nazwisko twórcy albo twórców odmian, jeżeli odmiana została wyhodowana w kraju,
3) nazwę tej rośliny uprawnej w językach polskim i łacińskim,
4) proponowaną nazwę odmiany,
5) miejsce prowadzenia hodowli zachowawczej odmiany,
6) datę i podpis hodowcy.
2. Przy zgłaszaniu mieszańca do rejestru wymagana jest pisemna zgoda hodowców składników tego mieszańca na ich wykorzystanie, jeśli składnik mieszańca jest chroniony w Rzeczypospolitej Polskiej.
1) upoważnienie przedstawiciela do działania w imieniu hodowcy dla odmian hodowanych za granicą,
2) wyniki badania wartości gospodarczej odmiany przeprowadzone w Rzeczypospolitej Polskiej, której wpisanie do rejestru wymaga stwierdzenia jej zadowalającej wartości gospodarczej,
3) opis botaniczny odmiany,
4) pisemną informację o pochodzeniu i strukturze odmiany,
5) opis botaniczny składników mieszańca rośliny rolniczej,
6) kopię dowodu uiszczenia opłaty za zgłoszenie odmiany do rejestru.
1) dla roślin rolniczych:
a) ozimych:
– rzepaku, wyki kosmatej – od dnia 1 sierpnia do dnia 10 sierpnia,
– jęczmienia – od dnia 1 sierpnia do dnia 20 sierpnia,
– pozostałych – od dnia 1 sierpnia do dnia 25 sierpnia,
b) zbożowych jarych – od dnia 1 października do dnia 30 listopada,
c) strączkowych:
– grochu siewnego, łubinu – od dnia 1 października do dnia 30 listopada,
– pozostałych – od dnia 15 października do dnia 15 grudnia,
d) kukurydzy, buraka cukrowego, buraka pastewnego, ziemniaka, życicy westerwoldzkiej – od dnia 1 listopada do dnia 31 grudnia,
e) pozostałych – od dnia 15 listopada do dnia 15 stycznia,
2) dla roślin warzywnych:
a) odmian zimujących cebuli, sałaty – od dnia 1 maja do dnia 30 czerwca,
b) odmian czosnku ozimego, sałaty pod osłonami
– od dnia 1 lipca do dnia 31 sierpnia,
c) odmian uprawianych pod osłonami ogrzewanymi – od dnia 1 sierpnia do dnia 30 września,
d) odmian uprawianych pod osłonami nieogrzewanymi – od dnia 1 października do dnia 30 listopada,
e) odmian uprawianych w gruncie – od dnia 1 października do dnia 31 grudnia,
3) dla roślin sadowniczych:
a) drzew owocowych – od dnia 1 listopada do dnia 31 grudnia,
b) krzewów jagodowych, bylin – od dnia 1 grudnia do dnia 31 stycznia.
2. Nazwa odmiany, o której mowa w ust. 1:
1) rozpoczyna się od litery,
2) nie jest tożsama:
a) z nazwą, skrótem literowym lub z akronimem państwa, organizacji międzynarodowej,
b) z nazwą jednostek systematyki botanicznej.
2. Materiał siewny, o którym mowa w ust. 1, powinien odpowiadać wymaganiom jakościowym oraz nie może być traktowany środkami ochrony roślin i regulatorami wzrostu.
3. Materiał siewny do urzędowych badań odrębności, wyrównania i trwałości oraz wartości gospodarczej odmiany powinien pochodzić z tej samej partii materiału siewnego.
2. Dla grup roślin ustala się następujące oznaczenia literowe:
1) R – rośliny rolnicze,
2) W – rośliny warzywne,
3) S – rośliny sadownicze.
2. Lustrację hodowli zachowawczej przeprowadza się komisyjnie.
3. Komisja, o której mowa w ust. 2, sprawdza:
1) sposób i metody prowadzenia hodowli zachowawczej oraz
2) warunki niezbędne do uzyskania materiału siewnego odpowiedniej jakości.
2. Protokół, o którym mowa w ust. 1, podpisują przeprowadzający lustrację i hodowca lustrowanej odmiany.
3. Hodowcy, o którym mowa w ust. 2, przysługuje prawo wniesienia zastrzeżeń co do treści i ustaleń zawartych w protokole, w terminie podanym w protokole.
Rozdział 3
Wyłączne prawo do odmiany
§ 17.
1) imię i nazwisko albo nazwę hodowcy oraz jego adres zamieszkania albo siedziby,
2) nazwę rośliny uprawnej podaną w językach polskim i łacińskim,
3) proponowaną nazwę odmiany,
4) datę i podpis hodowcy.
2. Do wniosku, o którym mowa w ust. 1, dołącza się:
1) dokument potwierdzający, że odmiana spełnia kryterium nowości,
2) opis botaniczny odmiany,
3) pisemną informację o pochodzeniu i strukturze odmiany,
4) kopię dowodu uiszczenia opłaty za zgłoszenie wniosku o przyznanie wyłącznego prawa do odmiany.
2. Jeżeli złożony za granicą wniosek o przyznanie wyłącznego prawa do odmiany został wycofany przez hodowcę albo nie został pozytywnie rozpatrzony przez właściwy organ, hodowca odmiany informuje o tym Centralny Ośrodek.
2. Dla grup roślin ustala się następujące oznaczenia literowe:
1) R – rośliny rolnicze,
2) W – rośliny warzywne,
3) S – rośliny sadownicze,
4) L – rośliny leśne,
5) O – rośliny ozdobne,
6) P –- rośliny pozostałe.
Rozdział 4
Wymagania dotyczące wytwarzania kwalifikowanego i standardowego materiału siewnego oraz jego jakości
§ 25.
2. Pole przeznaczone pod plantację sadzeniaków ziemniaka powinno być wolne od cyst mątwika ziemniaczanego, co należy potwierdzić badaniem gleby przeprowadzonym nie wcześniej niż na rok przed założeniem plantacji.
1) nasion roślin rolniczych:
a) materiał hodowcy – MM,
b) materiał elitarny:
– przedbazowy – PB – trzecie albo drugie rozmnożenie przed nasionami kwalifikowanymi,
– bazowy: dla odmian ustalonych – B,
– dla komponentów do odmian mieszańcowych – Ro, Rm,
c) materiał kwalifikowany:
– dla odmian ustalonych: pierwsze rozmnożenie – K1, drugie rozmnożenie – K2,
– dla odmian mieszańcowych – F1,
d) materiał handlowy:
– dla odmiany znanej – Ho,
– dla odmiany nieznanej – H,
2) sadzeniaków ziemniaka:
a) sadzeniaki przedbazowe – PB,
b) sadzeniaki bazowe:
– superelita – SE,
– elita – E,
c) sadzeniaki kwalifikowane;
– oryginał – O,
– klasa A – kl. A,
3) nasion roślin warzywnych:
a) materiał hodowcy – MM,
b) materiał elitarny:
– przedbazowy – PB – pierwsze albo drugie rozmnożenia materiału hodowcy,
– bazowy:
– dla odmian ustalonych – B,
– dla komponentów do odmian mieszańcowych – Ro, Rm,
c) materiał kwalifikowany:
– dla odmian ustalonych – K,
– dla odmian mieszańcowych – F1,
d) materiał standardowy – St,
e) materiał handlowy:
– dla nieznanej odmiany – H,
– dla znanej odmiany – Ho,
4) materiału szkółkarskiego:
a) materiał przedelitarny – superelita – SE,
b) materiał elitarny:
– elita 1 – E1,
– elita 2– E2,
c) materiał kwalifikowany:
– oryginał – O.
2. Określa się wymagania dotyczące wytwarzania kwalifikowanego i standardowego materiału siewnego, izolacji przestrzennej od innych upraw, czystości gatunkowej i odmianowej, zdrowotności oraz maksymalnej ilości rozmnożeń materiałów hodowlanych, a w zależności od tego – stopni kwalifikacji oraz jakości materiału siewnego roślin warzywnych, stanowiące załącznik nr 6 do rozporządzenia.
3. Określa się wymagania dotyczące wytwarzania kwalifikowanego materiału szkółkarskiego oraz jego jakości, stanowiące załącznik nr 7 do rozporządzenia.
Rozdział 5
Szczegółowe zasady składania wniosku o ocenę materiału siewnego
§ 31.
1) imię, nazwisko albo nazwę oraz adres zamieszkania albo siedziby wnioskodawcy,
2) lokalizację plantacji, imię i nazwisko plantatora, nazwę miejscowości, gminę, powiat,
3) gatunek, odmianę, a w przypadku odmian mieszańcowych – formułę mieszańca,
4) stopień kwalifikacji wysianego materiału siewnego oraz numer i datę świadectwa kwalifikacji materiału siewnego,
5) powierzchnię plantacji,
6) rok założenia plantacji dla roślin dwu- i wieloletnich,
7) przewidywaną wielkość zbioru,
8) przewidywaną liczbę etykiet,
9) oznaczenie znakiem Organizacji Współpracy Ekonomicznej i Rozwoju (OECD) plantacji kwalifikowanych według tego systemu,
10) oznaczenie znakiem Europejskiej Komisji Gospodarczej Organizacji Narodów Zjednoczonych (UN/ECE) sadzeniaków ziemniaka.
2. Wniosek o dokonanie oceny polowej materiału szkółkarskiego zawiera:
1) imię, nazwisko albo nazwę oraz adres zamieszkania albo siedziby wnioskodawcy,
2) informację o:
a) rodzaju materiału szkółkarskiego, z podaniem jego ilości i powierzchni plantacji,
b) nazwie gatunku, odmiany, podkładki, wstawki,
c) wieku, formie, kategorii, statusie zdrowotności, stopniu kwalifikacji,
d) pochodzeniu materiału,
3) przewidywaną liczbę etykiet.
| Grupa roślin lub gatunek | Termin złożenia wniosku |
| Rośliny ozime, rośliny wieloletnie | do 28 lutego |
| Groch, rzodkiewka, sałata, szpinak | do 30 kwietnia |
| Pozostałe gatunki roślin uprawnych, z wyjątkiem ziemniaków, roślin korzeniowych i kapusty pastewnej | do 25 maja |
| Ziemniak | do 31 maja |
| Cebula dymka | do 15 maja |
| Rośliny korzeniowe, kapusta pastewna | do 15 lipca |
| Mateczniki porzeczek | do 10 marca |
| Sady nasienne, sady zraźnikowe | do 30 maja |
| Truskawka | do 1 maja |
| Pozostałe rodzaje materiału szkółkarskiego | do 15 czerwca |
1) obsianych albo obsadzonych materiałem hodowlanym:
a) oświadczenie hodowcy, że materiał hodowlany został wyprodukowany zgodnie z metodyką hodowli przyjętą dla zgłoszonej odmiany,
b) informacje o wynikach kiełkowania nasion wydanych przez upoważnione laboratorium lub stację oceny nasion, z wyjątkiem gatunków szklarniowych,
c) opis odmiany, która będzie warunkowo kwalifikowana,
d) opis składników mieszańca, przy zgłaszaniu do oceny polowej odmiany mieszańcowej,
2) obsianych albo obsadzonych składnikami mieszańca:
a) oświadczenie hodowcy, że składniki mieszańca zostały wyprodukowane zgodnie z metodyką hodowli przyjętą dla zgłoszonej odmiany mieszańcowej, lub świadectwo kwalifikacji polowej składników mieszańca,
b) informacje o wynikach kiełkowania nasion wydane przez upoważnione laboratorium lub stację oceny nasion, z wyjątkiem gatunków szklarniowych,
3) obsianych nasionami zgodnie ze stopniami kwalifikacji, o których mowa w § 28:
a) protokół pobrania próbki nasion materiału siewnego do oceny tożsamości,
b) oryginał lub uwierzytelnioną kopię świadectwa kwalifikacji materiału siewnego użytego do obsiewu plantacji,
c) kopię dokumentu zakupu potwierdzającą zgodność z danymi zawartymi w świadectwie kwalifikacji,
4) nasiennych ziemniaka:
a) świadectwo oceny weryfikacyjnej,
b) świadectwo oceny cech zewnętrznych,
c) kopię dokumentu zakupu potwierdzającą zgodność z danymi zawartymi w świadectwie,
d) etykietę urzędową,
5) cebuli dymki:
a) kopię dokumentu zakupu nasion kwalifikowanych lub standardowych zawierającą dane ze świadectwa albo
b) uwierzytelnioną kopię świadectwa jakości nasion użytych do produkcji cebuli dymki,
c) kopię dokumentu zakupu nasion,
6) na których odbywa się reprodukcja nasion roślin rolniczych dla firm zagranicznych, nieprzeznaczonych do obrotu w kraju:
a) świadectwo Międzynarodowego Związku Oceny Nasion (ISTA) lub Stowarzyszenia Agencji Urzędowej Kwalifikacji Nasion (AOSCA), z podaniem wyników wartości siewnej,
b) certyfikat stwierdzający stopień kwalifikacji lub kategorię materiału siewnego,
c) etykiety każdej partii materiału siewnego,
d) kontrakt określający powierzchnię, jaka powinna być obsiana albo obsadzona, oraz masę zużytego materiału siewnego,
e) pisemną zgodę urzędu kwalifikacyjnego kraju pochodzenia nasion na prowadzenie reprodukcji,
7) materiału szkółkarskiego:
a) oświadczenie hodowcy, że materiał przedelitarny został wyprodukowany zgodnie z metodyką hodowli przyjętą dla zgłoszonej odmiany,
b) świadectwo kwalifikacji albo kopię dokumentu zakupu zawierającą numer świadectwa kwalifikacji polowej,
c) opis odmiany przy zgłaszaniu do kwalifikacji warunkowej,
d) etykietę urzędową.
2. W razie zmiany danych zawartych we wniosku, o którym mowa w § 31, wnioskodawca informuje o tym właściwego wojewódzkiego inspektora Inspekcji Nasiennej.
Rozdział 6
Kontrola materiału siewnego
§ 36.
2. Protokół, o którym mowa w ust. 1, podpisu kontrolujący oraz kontrolowany podmiot albo osoba uprawniona do reprezentowania kontrolowanego podmiotu.
3. Kontrolujący informuje o możliwości:
1) wniesienia zastrzeżeń co do treści i ustaleń zawartych w protokole, przed jego podpisaniem,
2) zgłoszenia, w terminie podanym w protokole, pisemnego wyjaśnienia co do zawartych w nim ustaleń.
2. Kontrolowany podmiot, w terminie podanym w wystąpieniu pokontrolnym, powiadamia kontrolującego o wykonaniu zaleceń i wniosków albo o przyczynach ich niewykonania.
2. Próbki materiału siewnego pobiera się, stosownie do wielkości partii nasion, z każdego pojemnika lub z różnych miejsc w pojemniku.
3. Próbki pobierane są ręcznie lub za pomocą próbobierzy:
1) laskowego lub cylindrycznego,
2) zgłębnikowego typu Nobbego,
3) automatycznego.
4. Próbki z materiału siewnego – elitarnego, wszystkich stopni kwalifikacji odmian uprawianych według systemu OECD, oraz do oceny tożsamości odmianowej pobierają pracownicy Inspekcji Nasiennej, zgodnie z ust. 2 i 3.
5. Próbki z materiału siewnego kwalifikowanego, standardowego oraz handlowego do obrotu w kraju pobierają próbobiorcy, zgodnie z ust. 2 i 3.
Rozdział 7
Terminy ważności świadectwa materiału siewnego
§ 41.
1) roślin rolniczych – 12 miesięcy, z tym że dla;
a) szarłatu – 2 miesiące,
b) zbóż ozimych o wilgotności 16% – 3 miesiące,
c) sadzeniaków ziemniaka, w przypadku świadectw:
– weryfikacyjnych – przez cały okres sprzedaży i zbywania,
– oceny cech zewnętrznych – 14 dni,
2) roślin warzywnych – 12 miesięcy,
z tym że dla:
– nasion pakowanych hermetycznie o zdolności kiełkowania wyższej o co najmniej 10 punktów procentowych od minimalnych wymagań jakościowych – 24 miesiące,
3) roślin ozdobnych – 12 miesięcy,
z tym że dla:
– nasion pakowanych hermetycznie o zdolności kiełkowania powyżej 70% – 24 miesiące,
4) materiału szkółkarskiego – 12 miesięcy,
z tym że dla:
– nasion drzew owocowych – 6 miesięcy,
5) roślin zielarskich – 12 miesięcy, z tym że dla:
a) arcydzięgla, litworu i kozłka lekarskiego – 6 miesięcy,
b) nasion o wilgotności od 4% do 8% w opakowaniach hermetycznych – 24 miesiące.
2. Przepis ust. 1 ma zastosowanie do ważności świadectwa mieszanek roślin rolniczych, z tym że termin ważności świadectwa oceny mieszanki roślin rolniczych odpowiada terminowi ważności świadectwa oceny składnika tej mieszanki, które zostało wystawione najwcześniej.
Rozdział 8
Dokumenty dotyczące oceny materiału siewnego wystawione za granicą, uznawane za równoważne krajowym świadectwom
§ 43.
1) świadectwo jakości wystawione przez: Międzynarodowy Związek Oceny Nasion – ISTA, Stowarzyszenie Agencji Urzędowej Kwalifikacji Nasion – AOSCA,
2) certyfikat oceny polowej,
3) etykiety urzędowe odpowiednie dla poszczególnych kategorii materiału siewnego,
4) świadectwo jakości wystawiane przez upoważnioną firmę nasienną dla każdej partii materiału siewnego standardowego i handlowego,
5) świadectwo jakości wystawiane przez właściwy dla danego kraju urząd kwalifikacyjny – w przypadku sadzeniaków ziemniaka,
6) świadectwo oceny polowej wystawiane przez właściwe urzędy albo upoważnione instytucje – w przypadku materiału szkółkarskiego.
Rozdział 9
Zakres i terminy składania informacji
§ 44.
1) nazwę gatunku,
2) masę,
3) kategorię,
4) stan początkowy ilości materiału siewnego,
5) przychód:
a) z produkcji własnej, kontraktacji,
b) z importu,
6) rozchód:
a) ze sprzedaży krajowej,
b) z siewu we własnym gospodarstwie,
c) z eksportu,
d) przeznaczony na cele niesiewne,
7) stan końcowy ilości materiału siewnego,
8) ilość magazynów i punktów sprzedaży, z podaniem ich lokalizacji oraz informacji o otwarciu lub zamknięciu punktu sprzedaży.
2. Informację, o której mowa w ust. 1, w:
1) pkt 1–8 – składają przedsiębiorcy wprowadzający materiał siewny do obrotu z własnej produkcji oraz poprzez jego import lub eksport,
2) pkt 1–3,7 i 8 – składają przedsiębiorcy prowadzący obrót nabytym materiałem siewnym.
3. Ustala się następujące terminy przekazywania informacji, o których mowa w ust. 1 i 2, z zastrzeżeniem ust. 4 i 5:
1) za pierwsze półrocze – do dnia 31 sierpnia dla zbóż jarych i motylkowych drobnonasiennych,
2) za drugie półrocze – do dnia 31 stycznia dla zbóż ozimych i motylkowych drobnonasiennych,
3) roczne – do dnia 31 sierpnia następnego roku dla roślin warzywnych i pozostałych roślin rolniczych.
4. Przedsiębiorcy prowadzący obrót nabytym materiałem siewnym w formie przygotowanej do obrotu przekazują, do dnia 31 stycznia następnego roku, roczne informacje dotyczące stanu magazynowego według stanu na dzień 31 grudnia.
5. Przedsiębiorcy prowadzący obrót materiałem siewnym informacje o otwarciu lub zamknięciu punktu sprzedaży przesyłają w terminie, o którym mowa w ust. 4.
Rozdział 10
Szczegółowe zasady prowadzenia dokumentacji dotyczącej wytwarzania i obrotu materiałem siewnym
§ 46.
1) wytwarzania materiału siewnego roślin rolniczych i warzywnych, która obejmuje:
a) umowę kontraktacyjną wraz z kopią dokumentu zakupu od producenta,
b) świadectwo kwalifikacji materiału siewnego,
c) kopię dokumentu zakupu materiału siewnego,
d) świadectwo oceny polowej,
e) dokument przyjęcia do magazynu, wskazujący gatunek, odmianę, kategorię albo stopień kwalifikacji, numer i masę partii,
2) wytwarzania materiału szkółkarskiego, która obejmuje informacje o:
a) pochodzeniu materiału wykorzystywanego do rozpoczęcia procesu rozmnażania,
b) terminie siewu, sadzenia, szczepienia, okulizacji i innych metod rozmnażania roślin,
c) metodach uprawy,
d) sposobach pielęgnacji plantacji,
e) stosowanych zabiegach mechanicznych i chemicznych,
f) sposobie przechowywania,
3) przerobu materiału siewnego, która obejmuje informacje o:
a) ilości materiału siewnego przekazanego do przerobu, ze wskazaniem gatunku, odmiany, stopnia kwalifikacji, numeru i masy partii,
b) masie czystego materiału siewnego,
c) masie odpadów,
d) dacie rozpoczęcia i zakończenia przerobu,
e) ilości masy otoczkującej oraz zużytej zaprawy w przypadku otoczkowania lub zaprawiania nasion,
4) sposobu postępowania z materiałem siewnym nieuznanym za kwalifikowany lub standardowy, która obejmuje:
a) kopię dokumentu sprzedaży na cele niesiewne,
b) protokół zniszczenia,
c) dokument wydania,
5) tworzenia partii zbiorczej materiału siewnego pochodzącego od różnych producentów, która obejmuje:
a) dokument przerobu ze specyfikacją partii wchodzących w skład partii zbiorczej,
b) oryginał lub uwierzytelnioną kopię świadectw oceny polowej tych partii,
c) świadectwo kwalifikacji nasion lub wartości siewnej,
6) tworzenia zestawu partii materiału siewnego pochodzącego od różnych producentów, która obejmuje:
a) świadectwa oceny polowej poszczególnych partii lub świadectwa wartości siewnej, lub świadectwa kwalifikacji nasion,
b) dokument łączenia i ujednolicenia partii, który zawiera:
– specyfikację partii wchodzących w skład zestawu,
– rozliczenia ilościowe partii nasion wchodzących w skład tego zestawu,
c) świadectwo kwalifikacji lub wartości siewnej wydane na zestaw,
7) tworzenia mieszanek nasiennych, która obejmuje:
a) dokumentację, o której mowa w pkt 6, z wyjątkiem świadectwa oceny polowej,
b) wyliczenie składu procentowego w przypadku mieszanek roślin rolniczych,
8) sposobu wykorzystania etykiet.
2. Dokumentacja, o której mowa w ust. 1 pkt 5, dotyczy partii, którą tworzy się z tej samej odmiany, tej samej kategorii i tego samego roku zbioru.
3. Dokumentacja, o której mowa w ust. 1 pkt 6, dotyczy zestawu, który tworzy się z partii materiału siewnego z tej samej odmiany, pochodzących z różnych lat zbioru.
Rozdział 11
Przepisy przejściowe i końcowe
§ 50.
1) rozporządzenie Ministra Rolnictwa i Gospodarki Żywnościowej z dnia 15 kwietnia 1996 r. w sprawie wykonania niektórych przepisów ustawy o nasiennictwie (Dz. U. Nr 50, poz. 216 i z 1997 r. Nr 14, poz. 80),
2) zarządzenie Ministra Rolnictwa i Gospodarki Żywnościowej z dnia 20 czerwca 1996 r. w sprawie wymagań dotyczących wytwarzania materiału siewnego (Monitor Polski Nr 52, poz. 481).
1) § 4 pkt 2 –w zakresie gatunków i ich odmian, które przed dniem wejścia w życie rozporządzenia nie podlegały urzędowym badaniom wartości gospodarczej,
2) § 28:
a) pkt 1 lit. c) – w zakresie drugiego rozmnożenia (K2) dla pszenicy, żyta, pszenżyta, jęczmienia i owsa,
b) pkt 3 lit. c) – w zakresie odmian ustalonych (K) – stosuje się od dnia 1 stycznia 2003 r.
Minister Rolnictwa i Rozwoju Wsi: A. Balazs
Załączniki do rozporządzenia Ministra Rolnictwa i Rozwoju Wsi
z dnia 14 sierpnia 2001 r. (poz. 1184)
Załącznik nr 1
WYKAZ ROŚLIN UPRAWNYCH, KTÓRYCH ODMIANY WPISUJE SIĘ DO REJESTRU ODMIAN ROŚLIN UPRAWNYCH
| Lp. | Nazwa rośliny uprawnej | Nazwa łacińska rośliny |
| 1 | 2 | 3 |
| 1. Rośliny rolnicze | ||
| a) Rośliny zbożowe | ||
| 1 | Gryka | Fagopyrum esculentum Moench |
| 2 | Jęczmień | Hordeum vulgare L. |
| 3 | Kukurydza | Zea mays L. |
| 4 | Owies | Avena sativa L. |
| 5 | Proso | Panicum miliaceum L. |
| 6 | Pszenica zwyczajna | Triticum aestivum L. Emend. Fiori et Paol. |
| 7 | Pszenżyto | x Triticosecale Wittm. |
| 8 | Żyto | Secale cereale L. |
| b) Rośliny strączkowe | ||
| 9 | Bobik | Vicia faba L. Var. Minor Harz |
| 10 | Groch siewny | Pisum sativum L. ssp. Sativum |
| 11 | Łubin biały | Lupinus albus L. |
| 12 | Łubin wąskolistny | Lupinus angustifolius L. |
| 13 | Łubin żółty | Lupinus luteus L. |
| 14 | Soja | Glycine max (L.) Merr. |
| 15 | Wyka kosmata | Vicia villosa Roth |
| 16 | Wyka siewna | Vicia sativa L. Ssp. Sativa |
| c) Rośliny motylkowate drobnonasienne | ||
| 17 | Esparceta | Onobrychis viciifolia Scop. |
| 18 | Komonica zwyczajna | Lotus corniculatus L. |
| 19 | Koniczyna biała | Trifolium repens L. |
| 20 | Koniczyna łąkowa (czerwona) | Trifolium pratense L. |
| 21 | Koniczyna krwistoczerwona (inkarnatka) | Trifolium incarnatum L. |
| 22 | Koniczyna perska | Trifolium resupinatum L. |
| 23 | Koniczyna szwedzka | Trifolium hybridum L. |
| 24 | Lucerna chmielowa | Medicago lupulina L. |
| 25 | Lucerna mieszańcowa | Medicago sativa L. Ssp. falcata x ssp. sativa |
| 26 | Lucerna siewna | Medicago sativa L. Ssp. sativa |
| 27 | Nostrzyk biały | Melilotus albus Medik. |
| 28 | Seradela | Ornithopus sativus Brot. |
| d) Trawy | ||
| 29 | Festulolium | x Festulolium |
| 30 | Kostrzewa czerwona | Festuca rubra L. Sensu lato |
| 31 | Kostrzewa łąkowa | Festuca pratensis Huds. |
| 32 | Kostrzewa owcza | Festuca ovina L. Sensu lato |
| 33 | Kostrzewa różnolistna | Festuca heterophylla Lam. |
| 34 | Kostrzewa trzcinowa | Festuca arundinacea Schreb. |
| 35 | Kupkówka pospolita | Dactylis glomerata L. |
| 36 | Mietlica biaława | Agrostis gigantea Roth |
| 37 | Mietlica mieszańcowa | Agrostis stolonifera L. X Agrostis canina L. et |
| 38 | Mietlica pospolita | Agrostis capillaris L. |
| 39 | Mietlica pośrednia | Agrostis intermedia Veb. |
| 40 | Mietlica psia | Agrostis canina L. |
| 41 | Mietlica rozłogowa | Agrostis stolonifera L. |
| 42 | Mozga trzcinowata | Phalaris arundinacea L. |
| 43 | Rajgras wyniosły (francuski) | Arrhenatherum elatius (L.) P. Beauv. ex J. S. et K.B. Presl |
| 44 | Stokłosa bezostna | Bromus inermis Leyss. |
| 45 | Stokłosa uniolowata | Bromus catharticus Vahl |
| 46 | Śmiałek darniowy | Deschampsia cespitosa (L.) P. Beauv. |
| 47 | Tymotka kolankowata | Phleum bertolonii DC. |
| 48 | Tymotka łąkowa | Phleum pratense L. |
| 49 | Wiechlina błotna | Poa palustris L. |
| 50 | Wiechlina gajowa | Poa nemoralis L. |
| 51 | Wiechlina łąkowa | Poa pratensis L. |
| 52 | Wiechlina spłaszczona | Poa compressa L. |
| 53 | Wyczyniec łąkowy | Alopecurus pratensis L. |
| 54 | Życica mieszańcowa (rajgras oldenburski) | Lolium x boucheanum Kunth. |
| 55 | Życica trwała (rajgras angielski) | Lolium perenne L. |
| 56 | Życica wielokwiatowa (rajgras włoski) | Lolium multifiorum Lam. |
| 57 | Życica wielokwiatowa westerwoldzka (rajgras holenderski) | Lolium multiflorum Lam. var. westerwoldicum Wittm. |
| e) Rośliny bulwiaste, korzeniowe, rzepowate | ||
| 58 | Brukiew pastewna | Brassica napus emend. Metzg. ssp. rapifera Metzg. |
| 59 | Burak cukrowy | Beta vulgaris L. ssp. Vulgaris convar. vulgaris var. Altissima Doell |
| 60 | Burak pastewny | Beta vulgaris L. ssp. Vulgaris convar. vulgaris var. Rapacea K. Koch |
| 61 | Cykoria korzeniowa | Cichorium intybus L. Var. sativum DC. |
| 62 | Marchew pastewna | Daucus carota L. ssp. Sativus (Hoffm.) Schübl. et |
| 63 | Rzepa pastewna | Brassica rapa L. Emend. Metzg. ssp. rapa |
| 64 | Ziemniak | Solanum tuberosum L. sensu lato |
| f) Rośliny oleiste | ||
| 65 | Gorczyca biała | Sinapis alba L. ssp. Alba |
| 66 | Gorczyca sarepska | Brassica juncea (L.) Czern. |
| 67 | Len oleisty | Linum usitatissimum L. convar. Mediterraneum (Vavilov ex Ell.) Kulpa et Danert |
| 68 | Mak | Papaver somniferum L. ssp. somniferum |
| 69 | Rzepak | Brassica napus L. Emend. Metzg. Ssp. napus |
| 70 | Rzepik | Brassica rapa L. Emened. Metzg. ssp. oleifera (DC.) Metzg. |
| 71 | Rzodkiew oleista | Raphanus satiyus L. Var. oleiformis Pers. |
| 72 | Słonecznik | Helianthus annuus L. |
| g) Rośliny włókniste | ||
| 73 | Konopie | Cannabis sativa L. Ssp. sativa |
| 74 | Len włóknisty | Linum usitatissimum L. convar. Usitatissimum |
| h) Rośliny przemysłowe specjalne | ||
| 75 | Chmiel | Humulus lupulus L. |
| 76 | Tytoń szlachetny | Nicotiana tabacum L. |
| i) Inne rośliny rolnicze | ||
| 77 | Facelia błękitna | Phacelia tanacetifolia Benth. |
| 78 | Kapusta pastewna | Brassica oleracea L. Ssp. oleracea convar. Acephala (DC.) Alef. Var. Yiridis et var. Medullosa Thell. |
| II. Rośliny warzywne | ||
| a) Rośliny cebulowe | ||
| 79 | Cebula szalotka | Allium ascalonicum L. |
| 80 | Cebula zwyczajna | Allium cepa L. var. Cepa Helm |
| 81 | Czosnek pospolity | Allium sativum L. Var. satiyum |
| 82 | Por | Allium porrum L. Var. Porrum |
| b) Rośliny dyniowate | ||
| 83 | Dynia olbrzymia | Cucurbita maxima Duch. |
| 84 | Dynia zwyczajna | Cucurbita pepo L. |
| 85 | Kawon | Citrullus lanatus Matsum. et Nakai ssp. vulgaris Fursa var. Vulgaris |
| 86 | Melon | Cucumis melo L. |
| 87 | Ogórek | Cucumis sativus L. |
| c) Rośliny kapustne | ||
| 88 | Brokuł | Brassica oleracea L. Ssp. oleracea convar. botrytis |
| 89 | Jarmuż | Brassica oleracea L. Ssp. oleracea convar. acephala (DC.) Alef. Var. Sabellica L. |
| 90 | Kalafior | Brassica oleracea L. Ssp. oleracea convar. botrytis |
| 91 | Kalarepa | Brassica oleracea L. Ssp. oleracea convar. |
| 92 | Kapusta brukselska | Brassica oleracea L. Ssp. oleracea convar. fruticosa (Metzg.) Alef. var. Gemmifera DC. |
| 93 | Kapusta chińska | Brassica rapa L. Emend. Metzg. ssp. chmensis |
| 94 | Kapusta głowiasta biała | Brassica oleracea L. Ssp. oleracea convar. capitata |
| 95 | Kapusta głowiasta czerwona | Brassica oleracea L. Ssp. oleracea convar. capitata |
| 96 | Kapusta pekińska | Brassica rapa L. Emend. Metzg. ssp. pekinensis |
| 97 | Kapusta włoska | Brassica oleracea L. Ssp. oleracea convar. capitata |
| d) Rośliny korzeniowe | ||
| 98 | Burak ćwikłowy | Beta vulgaris L. ssp. Vulgaris convar. Vulgaris var. Vulgaris |
| 99 | Marchew jadalna | Daucus carota L. Ssp. Sativus (Hoffm.) Schübl. et G. Martens |
| 100 | Pietruszka korzeniowa | Petroselinum crispum (Mill.) Nym. ex A. W. Hill |
| 101 | Seler korzeniowy | Apium graveolens L. Var. Rapaceum (Mill.) Gaud. |
| e) Rośliny rzepowate | ||
| 102 | Rzepa jadalna | Brassica rapa Z. Emend. Metzg. ssp. rapa |
| 103 | Rzodkiew | Raphanus sativus L. Var. Niger (Mill.) S. Kerner |
| 104 | Rzodkiewka | Raphanus sativus L. Var. Sativus |
| f) Rośliny liściowe | ||
| 105 | Cykoria liściowa | Cichorium intybus L. Var. Foliosum Hegi |
| 106 | Pietruszka naciowa | Petroselinum crispum (Mill.) Nym. ex A. W. Hillc |
| 107 | Sałata głowiasta | Lactuca sativa L. Var. Capitata L. |
| 108 | Sałata liściowa | Lactuca sativa L. Var. Crispa L. |
| 109 | Sałata łodygowa (szparagowa) | Lactuca sativa L. Var. Angustana hort. ex L.H. |
| 110 | Sałata rzymska | Lactuca sativa L. Var. Longifolia Lam. |
| 111 | Seler naciowy | Apium graveolens L. Var. Dulce (Mill.) Pers. |
| 112 | Szpinak | Spinacia oleracea L. |
| g) Rośliny psiankowate | ||
| 113 | Papryka | Capsicum annuum L. |
| 114 | Pomidor | Lycopersicon esculentum Mill. nom cons. Var. Esculentum |
| 115 | Oberżyna | Solanum melongena L. |
| h) Rośliny strączkowe | ||
| 116 | Bób | Vicia faba L. Var. Major Harz |
| 117 | Fasola wielokwiatowa | Phaseolus coccineus L. |
| 118 | Fasola zwykła karłowa | Phaseolus vulgaris L. Var. nanus (L.) Aschers. |
| 119 | Fasola zwykła tyczna | Phaseolus vulgaris L. Var. vulgaris |
| 120 | Groch siewny cukrowy | Pisum sativum L. Ssp. Sativum convar. Axiphium |
| 121 | Groch siewny łuskowy | Pisum sativum L. Ssp. Sativum convar. Medullare |
| i) Inne rośliny warzywne | ||
| 122 | Koper ogrodowy | Anethum graveolens L. |
| 123 | Koper włoski (fenkuł) | Foeniculum vulgare Mill. Ssp. vulgare var. azoricum (Mill.) Thell. |
| 124 | Kukurydza cukrowa | Zea mays L. Convar. Saccharata Koern. |
| 125 | Kukurydza pękająca | Zea mays L. Convar. Microsperma Koern. |
| 126 | Szparag | Asparagus officinalis L. |
| III. Rośliny sadownicze | ||
| a) Drzewa owocowe | ||
| 127 | Brzoskwinia1 | Prunus persica (L.) Batsch |
| 128 | Czereśnia1 | Prunus avium (L.) L. |
| 129 | Grusza1 | Pyrus communis L. |
| 130 | Jabłoń1 | Malus domestica Borkh. |
| 131 | Morela | Prunus armeniaca L. |
| 132 | Pigwa2 | Cydonia oblonga Mill. |
| 133 | Śliwa domowa1 | Prunus domestica L. |
| 134 | Wiśnia | Prunus cerasus L. |
| 135 | Śliwa i wiśnia2 (inne gatunki) | Prunus L. |
| b) Rośliny jagodowe | ||
| 136 | Agrest | Ribes grossularia L. |
| 137 | Borówka wysoka | Vaccinium corymbosum L. |
| 138 | Malina właściwa | Rubus idaeus L. |
| 139 | Porzeczka czarna | Ribes nigrum L. |
| 140 | Porzeczka czerwona | Ribes sylvestre (Lam.) Mert. et W. Koch |
| 141 | Truskawka | Fragaria x ananassa Duch. |
Objaśnienia:
1 Obejmują zarówno odmiany owocujące, jak i odmiany na podkładki.
2 Obejmują odmiany wyłącznie na podkładki.
Załącznik nr 2
WYKAZ ROŚLIN UPRAWNYCH, KTÓRYCH WPISANIE DO REJESTRU ODMIAN ROŚLIN UPRAWNYCH WYMAGA STWIERDZENIA ZADOWALAJĄCEJ WARTOŚCI GOSPODARCZEJ
| Lp. | Nazwa rośliny uprawnej | Nazwa łacińska rośliny |
| 1 | 2 | 3 |
| Rośliny rolnicze | ||
| a) Rośliny zbożowe | ||
| 1 | Jęczmień | Hordeum vulgare L. |
| 2 | Kukurydza | Zea mays L. |
| 3 | Owies | Avena salwa L. |
| 4 | Pszenica zwyczajna | Triticum aestiyum L. Emend. Fiori et Paol. |
| 5 | Pszenżyto | x Triticosecale Wittm. |
| 6 | Żyto (z wyłączeniem żyta na zieloną masę) | Secale cereale L. |
| b) Rośliny strączkowe | ||
| 7 | Bobik | Vicia faba L. Var. Minor Harz |
| 8 | Groch siewny | Pisum sativum L. ssp. Sativum |
| 9 | Łubin wąskolistny | Lupinus angustifolius L. |
| 10 | Łubin żółty | Lupinus luteus L. |
| 11 | Soja | Glycine max (L.) Merr. |
| 12 | Wyka siewna | Vicia sativa L. Ssp. Sativa |
| c) Rośliny motylkowate drobnonasienne | ||
| 13 | Esparceta | Onobrychis viciifolia Scop. |
| 14 | Koniczyna biała | Trifolium repens L. |
| 15 | Koniczyna łąkowa (czerwona) | Trifolium pratense L. |
| 16 | Koniczyna szwedzka | Trifolium hybridum L. |
| 17 | Lucerna siewna | Medicago sativa L. Ssp. Sativa |
| 18 | Lucerna mieszańcowa | Medicago sativa L. Ssp. Falcata x ssp. Sativa |
| d) Trawy1 | ||
| 19 | Festulolium | x Festulolium. |
| 20 | Kostrzewa czerwona | Festuca rubra L. Sensu lato |
| 21 | Kostrzewa łąkowa | Festuca pratensis Huds. |
| 22 | Kupkówka pospolita | Dactylis glomerata L. |
| 23 | Mietlica pospolita | Agrostis capillaris L. |
| 24 | Rajgras wyniosły (francuski) | Arrhenatherum elatius (L.) P. Beauv. Ex J.S. et K.B. Presl |
| 25 | Tymotka łąkowa | Phleum pratense L. |
| 26 | Wiechlina łąkowa | Poa pratensis L. |
| 27 | Wyczyniec łąkowy | Alopecurus pratensis L. | |
| 28 | Życica mieszańcowa (rajgras oldenburski) | Lolium x boucheanum Kunth. | |
| 29 | Życica trwała (rajgras angielski) | Lolium perenne L. | |
| 30 | Życica wielokwiatowa (rajgras włoski) | Lolium multiflorum Lam. | |
| 31 | Życica wielokwiatowa westerwoldzka (rajgras holenderski) | Lolium multiflorum Lam. var. westerwoldicum Wittm. | |
| e) Rośliny bulwiaste, korzeniowe | |||
| 32 | Burak cukrowy | Beta vulgaris L. ssp. Vulgaris convar. vulgaris var. Altissima Doell | |
| 33 | Burak pastewny | Beta vulgaris L. ssp. Vulgaris convar. vulgaris var. rapacea K. Koch | |
| 34 | Ziemniak | Solanum tuberosum L. Sensu lato | |
| f) Rośliny oleiste | |||
| 35 | Gorczyca biała | Sinapis alba L. Ssp. Alba | |
| 36 | Mak | Papaver somniferum L. Ssp. Somniferum | |
| 37 | Rzepak | Brassica napus L. Emend. Metzg. ssp. Napus | |
| g) Rośliny włókniste | |||
| 38 | Konopie | Cannabis sativa L. ssp. Sativa | |
| 39 | Len włóknisty | Linum usitatissimum L. Convar. Usitatissimum | |
Objaśnienie:
1 Nie dotyczy odmian użytkowanych jako gazonowe, z wyjątkiem kostrzewy czerwonej, wiechliny łąkowej, życicy trwałej (rajgras angielski).
Załącznik nr 3
WYKAZ ROŚLIN UPRAWNYCH, KTÓRYCH WARTOŚĆ GOSPODARCZĄ ODMIAN
BADA SIĘ PO ICH WPISANIU DO REJESTRU ODMIAN ROŚLIN UPRAWNYCH
| Lp. | Nazwa rośliny uprawnej | Nazwa łacińska rośliny |
| 1 | 2 | 3 |
| I. Rośliny warzywne | ||
| a) Rośliny cebulowe | ||
| 1 | Cebula zwyczajna | Allium cepa L. Var. cepa Helm |
| 2 | Por | Allium porrum L. Var. Porrum |
| b) Rośliny dyniowate | ||
| 3 | Ogórek | Cucumis satiyus L. |
| c) Rośliny kapustne | ||
| 4 | Kalafior | Brassica oleracea L. ssp. Oleracea convar. botrytis (L.) Alef. var. Botrytis |
| 5 | Kapusta brukselska | Brassica oleracea L. ssp. Oleracea convar. Fruticosa (Metzg.) Alef. var. Gemmifera DC. |
| 6 | Kapusta głowiasta biała | Brassica oleracea L. ssp. Oleracea convar. Capitata (L.) Alef. var. Capitata L.f. alba DC. |
| 7 | Kapusta głowiasta czerwona | Brassica oleracea L. Ssp. oleracea convar. Capitata (L.) Alef. var. Capitata L.f. rubra DC. |
| d) Rośliny korzeniowe | ||
| 8 | Burak ćwikłowy | Beta Vulgaris L. Ssp. Vulgaris convar. Vulgaris var. Vulgaris |
| 9 | Marchew jadalna | Daucus carota L. Ssp. Sativus (Hoffm.) Schübl. et G. Martens |
| 10 | Pietruszka korzeniowa | Petroselimum crispum (Mill.) Nym. ex A. W. Hill convar. Radicosum (Alef.) Danert |
| 11 | Seler korzeniowy | Apium graveolens L. var. Rapaceum (Mill.) Gaud. |
| e) Rośliny psiankowate | ||
| 12 | Papryka | Capsicum annuum L. |
| 13 | Pomidor | Lycopersicon esculentum Mill. nom cons. Var. Esculentum |
| f) Rośliny strączkowe | ||
| 14 | Fasola zwykła karłowa | Phaseolus Vulgaris L. Var. nanus (L.) Aschers. |
| 15 | Groch siewny łuskowy | Pisum Sativum L. Ssp. Sativum convar. Medullare Alef. Emend. C.O. Lehm. et convar. Sativum |
| II. Rośliny sadownicze | ||
| a) Drzewa owocowe | ||
| 16 | Grusza2 | Pyms communis L. |
| 17 | Jabłoń2 | Malus domestica Borkh. |
| 18 | Śliwa domowa2 | Prunus domestica L. |
| 19 | Wiśnia | Prunus cerasus L. |
| b) Rośliny jagodowe | ||
| 20 | Malina właściwa | Rubus idaeus L. |
| 21 | Porzeczka czarna | Ribes nigrum L. |
| 22 | Truskawka | Fragaria x ananassa Duch. |
Objaśnienia:
1 W celu tworzenia list opisowych odmian.
2 Obejmują odmiany owocujące oraz odmiany na podkładki.
Załącznik nr 4
WYKAZ ROŚLIN, KTÓRYCH MATERIAŁ SIEWNY ZE ZBIORU ODMIANY CHRONIONEJ MOŻE BYĆ PRZEZ POSIADACZA GRUNTÓW STOSOWANY JAKO MATERIAŁ SIEWNY BEZ ZGODY HODOWCY W ILOŚCI POTRZEBNEJ NA OBSIANIE LUB OBSADZENIE UPRAWY GRUNTOWEJ ROŚLINY ROLNICZEJ DO 2 ha
| Lp. | Nazwa rośliny uprawnej | Nazwa łacińska rośliny uprawnej |
| 1 | 2 | 3 |
| a) Rośliny zbożowe | ||
| 1 | Jęczmień | Hordeum vulgare L. |
| 2 | Owies | Avena sativa L. |
| 3 | Pszenica zwyczajna | Triticum aestivum L. Emend. Flori et Paol. |
| 4 | Pszenżyto | x Triticosecale Wittm. |
| 5 | Żyto | Secale cereale L. |
| b) Rośliny bulwiaste | ||
| 6 | Ziemniak | Solarium tuberosum L. Sensu lato |
| c) Rośliny oleiste | ||
| 7 | Rzepak | Brassica napus L. Emend. Metzg. ssp. napus |
| 8 | Len oleisty | Linum usitatissimum L. Convar. Mediterraneum (Vavilov ex Ell.) Kulpa et Danert |
| d) Rośliny strączkowe | ||
| 9 | Łubin żółty | Lupinus luteus L. |
| 10 | Bobik | Vicia faba L. Var. Minor Harz |
| 11 | Groch siewny | Pisum sativum L. ssp. Sativum |
| 12 | Wyka siewna | Vicia sativa L. Ssp. Sativa |
| e) Rośliny motylkowate drobnonasienne | ||
| 13 | Lucerna siewna | Medicago sativa L. Ssp. Sativa |
| 14 | Lucerna mieszańcowa | Medicago sativa L. Ssp. Falcata x ssp. sativa |
Załącznik nr 5
WYMAGANIA DOTYCZĄCE WYTWARZANIA KWALIFIKOWANEGO MATERIAŁU SIEWNEGO, IZOLACJI PRZESTRZENNEJ OD INNYCH UPRAW, CZYSTOŚCI GATUNKOWEJ I ODMIANOWEJ, ZDROWOTNOŚCI ORAZ MAKSYMALNEJ ILOŚCI ROZMNOŻEŃ MATERIAŁÓW HODOWLANYCH, A W ZALEŻNOŚCI OD TEGO – STOPNI KWALIFIKACJI ORAZ JAKOŚCI MATERIAŁU SIEWNEGO ROŚLIN ROLNICZYCH
I. Rośliny zbożowe.
1. Stopnie kwalifikacji – kategorie materiału siewnego:
1) odmiany ustalone:
a) materiał elitarny:
| – nasiona przedbazowe | – PB, |
| – nasiona bazowe | – B, |
b) materiał kwalifikowany:
|
| – nasiona kwalifikowane pierwszego rozmnożenia | – K1, |
|
| – nasiona kwalifikowane drugiego rozmnożenia | – K2, |
| c) nasiona handlowe | – H (wyłącznie dla mozgi kanaryjskiej), | |
2) odmiany mieszańcowe:
| a) materiał elitarny | – Ro, Rm, |
| b) materiał kwalifikowany | – F1. |
2. Nazwy gatunków roślin zbożowych:
| 1) Avena sativa L. | – Owies |
| 2) Fagopyrum esculentum Moench | – Gryka |
| 3) Hordeum vulgare L. sensu łato | – Jęczmień, |
| 4) Panicum miliaceum L. | – Proso, |
| 5) Phalaris canariensis L. | – Mozga kanaryjska (kanar), |
| 6) Secale cereale L. | – Żyto, |
| 7) x Triticosecale Wittm. | – Pszenżyto, |
| 8) Triticum aestivum L. emend. Fiori et Paol. | – Pszenica zwyczajna, |
| 9) Zea mays L. | – Kukurydza |
| (oprócz: Zea mays var. saccharata Koke Zea mays convar. microsperma Koem.) | (oprócz kukurydzy cukrowej i pękającej). |
3. Wymagania dotyczące wytwarzania materiału siewnego przy przeprowadzaniu oceny polowej:
3. 1 .Ocena stanu plantacji:
1) dla pszenicy, pszenżyta, jęczmienia, żyta (odmiany ustalone), owsa, prosa, gryki plantacje ocenia się w czasie dojrzewania nasion,
2) dla żyta mieszańcowego każde rozmnożenie składników mieszańca podlega ocenie, w czasie której oceniane jest spełnienie kryteriów dotyczących uprawy:
a) w produkcji nasion męskosterylnego składnika matecznego (Rm) w materiale bazowym przynajmniej dwie oceny,
b) w produkcji nasion płodnego składnika matecznego (Rm) w materiale bazowym oraz materiale kwalifikowanym – przynajmniej jedna ocena,
c) w produkcji składnika ojcowskiego (Ro) – jedna ocena,
3) dla kukurydzy podczas okresu kwitnienia obowiązują przynajmniej trzy oceny linii wsobnych lub mieszańców. Ocenie podlegają plantacje nasienne, na których produkowane są nasiona składników rodzicielskich pokolenia, które jest używane bezpośrednio do produkcji nasion mieszańca handlowego.
Na wniosek hodowcy mogą być również oceniane plantacje nasienne, na których produkowane są nasiona wcześniejszych pokoleń składników rodzicielskich (linie wsobne).
3. 2. Zmianowanie:
1) dla pszenicy, owsa, jęczmienia i żyta: plantacji nasiennej nie można zakładać na polu, na którym w ostatnim roku uprawiano ten sam gatunek innej odmiany bądź tej samej odmiany, ale niższego stopnia kwalifikacji,
2) dla pszenżyta: plantacji nasiennej nie można zakładać na polu, na którym w ostatnich dwóch latach było uprawiane pszenżyto innej odmiany lub tej samej odmiany, ale niższego stopnia kwalifikacji, a także żyto lub pszenica,
3) dla żyta mieszańcowego: plantacji nasiennych nie można zakładać na polu, na którym w ostatnim roku uprawiane było żyto lub pszenżyto,
4) dla gryki: plantacji nasiennej nie można zakładać na polu, na którym w dwóch ostatnich latach uprawiano grykę lub tatarkę,
5) dla prosa: plantacji nasiennej nie można zakładać na polu, na którym w ostatnim roku uprawiano proso lub rośliny z podrodziny prosowatych: czumizę, mohar, sorgo, trawę sudańską,
6) dla kukurydzy: nie określa się przedplonu.
3. 3. Izolacja przestrzenna32):
1) dla mozgi kanaryjskiej i odmian ustalonych żyta odległość od zasiewów innych odmian tego samego gatunku nie mniejsza niż:
| a) materiał elitarny | – 300 m, |
| b) materiał kwalifikowany | – 250 m, |
2) dla pszenicy odległość od zasiewów pszenicy porażonej w silnym stopniu głownią pyłkową lub śniecią cuchnącą oraz dla:
a) owsa odległość od zasiewów owsa porażonych w silnym stopniu przez głownię pyłkową owsa,
b) pszenżyta odległość od zasiewów innej odmiany pszenżyta,
c) jęczmienia odległość od zasiewów jęczmienia porażonych w silnym stopniu przez głownię pyłkową lub głownią zwartą jęczmienia
jest nie mniejsza niż:
| – materiał elitarny | – 50 m, |
| – materiał kwalifikowany | – 20 m, |
3) dla jęczmienia ozimego odległość od plantacji jęczmienia ozimego o innej rzędowości, pylącej w tym samym czasie nie mniejsza niż:
| a) materiał elitarny | –100 m, |
| b) materiał kwalifikowany | – 50 m, |
4) dla gryki odległość od zasiewów innych odmian gryki nie mniejsza niż:
| a) materiał elitarny | –200 m, |
| b) materiał kwalifikowany | –100 m, |
5) dla prosa odległość od innych odmian prosa oraz innych gatunków roślin prosowatych nie mniejsza niż:
| a) materiał elitarny | –100 m, |
| b) materiał kwalifikowany | – 50 m, |
6) dla kukurydzy odległość plantacji, na której produkuje się nasiona:
| a) formy rodzicielskiej od zasiewów innej odmiany lub formy kukurydzy niż ta, której pyłkiem mają | |
| być zapylone rośliny, jest nie mniejsza niż | – 200 m, |
| b) mieszańca handlowego od zasiewów odmiany lub formy kukurydzy innej niż forma ojcowska | |
| danego mieszańca jest nie mniejsza niż | – 200 m, |
7) dla żyta mieszańcowego odległość od następujących plantacji:
a) innych odmian lub składników rodzicielskich żyta,
b) tego samego składnika rodzicielskiego, którego plantacja nie zachowuje minimalnych wymagań,
c) innych gatunków, których pyłek może doprowadzić do zapłodnienia:
| – podczas produkcji materiału elitarnego, gdzie stosuje | – 1000 m, |
| się męską sterylność, nie mniejsza niż: | |
| – podczas produkcji materiału elitarnego, gdzie nie stosuje | – 600 m, |
| się męskiej sterylności, nie mniejsza niż: | |
| – podczas produkcji materiału kwalifikowanego | – 500 m. |
| nie mniejsza niż: |
3. 4. Czystość odmianowa:
1) dla pszenicy, jęczmienia i owsa minimalna czystość odmianowa powinna wynosić:
| a) materiał elitarny | – 99,9%, |
| b) materiał kwalifikowany K1 | – 99,7%, |
| c) materiał kwalifikowany K2 | – 99,0%, |
2) dla samopylnych odmian pszenżyta:
| a) materiał elitarny | – 99,7%, |
| b) materiał kwalifikowany K1 | – 99,0%, |
| c) materiał kwalifikowany K2 | – 98,0%, |
3) dla odmian ustalonych i mieszańcowych żyta, obcopylnych odmian pszenżyta oraz mozgi kanaryjskiej występowanie roślin innych odmian nie może przekraczać:
| a) materiał elitarny | – 1,0 rośliny na 30 m2, |
| b) materiał kwalifikowany | –1,0 rośliny na 10 m2, |
| c) w ocenie tożsamości (kontroli następczej) liczba roślin innego składnika nie może przekraczać – 6,0 sztuk na 1000 roślin. | |
W materiale kwalifikowanym żyta mieszańcowego wymagania te stosuje się tylko w urzędowej ocenie polowej składnika matecznego.
W produkcji materiału bazowego żyta mieszańcowego poziom sterylności składnika męskosterylnego nie może być niższy niż 98,0%.
W materiale kwalifikowanym, produkowanym jako mieszanina składników ojcowskiego i matecznego, nie traktuje się jako zanieczyszczenie roślin składnika ojcowskiego, jednak jego udział nie może przekraczać podanego przez hodowcę stosunku składników przewidzianego dla produkcji materiału kwalifikowanego.
4) dla kukurydzy procent liczbowy roślin, które są rozpoznawalne jako niebędące linią wsobną lub innym składnikiem rodzicielskim, nie może przekraczać:
| a) w produkcji składników rodzicielskich (Ro, Rm) linie wsobne i każdy składnik pojedynczego mieszańca rodzicielskiego | – 0,1% | |
| (0,1 rośliny na jednostkę – 100 roślin), | ||
| b) w produkcji mieszańców handlowych linie wsobne i pojedyncze mieszańce | ||
| rodzicielskie | – 0,2% (0,2 rośliny na jednostkę –100 roślin), | |
| c) gdy 5% lub więcej roślin składnika matecznego ma znamiona zdolne do zapylenia, to procent roślin w obrębie tego składnika, który pylił lub pyli, nie może przekraczać: | ||
– 1% w każdej urzędowej ocenie stanu plantacji,
– 2% we wszystkich urzędowych ocenach łącznie.
Rośliny uważa się za pylące wtedy, gdy pędy główne lub odgałęzienia wiech mają długość 50 mm, a pylniki wydostały się z plew i pylą.
5) dla gryki i prosa występowanie roślin innych odmian na plantacji nie może przekroczyć w:
| a) materiale elitarnym | – 6,0 rośliny na 30 m2, |
| b) materiale kwalifikowanym | – 10,0 rośliny na 10 m2. |
3. 5. Czystość gatunkowa:
1) dla pszenicy, pszenżyta, jęczmienia, owsa, żyta mieszańcowego i odmian ustalonych żyta występowanie roślin innych gatunków zbóż na plantacji nie większe niż:
| a) materiał elitarny | – 1,0 rośliny na 30 m2, |
| b) materiał kwalifikowany | – 1,0 rośliny na 10 m2, |
2) dla gryki oraz wszystkich roślin zbożowych występowanie innych gatunków uprawnych w ilości powodującej pogorszenie jakości nasion stanowi podstawę do dyskwalifikacji plantacji,
3) dla prosa i mozgi kanaryjskiej występowanie roślin innych gatunków uprawnych, do których zalicza się: czumizę, mohar, pajzę, sorgo miotełkowe, trawę sudańską, gorczycę białą, czarną i sarepską, Iniankę siewną, rzepak jary i rzepik jary oraz u mozgi kanaryjskiej proso na plantacji nie więcej niż:
| a) materiał elitarny | – 1,0 rośliny na 30 m2, |
| b) materiał kwalifikowany | – 1,0 rośliny na 10 m2, |
4) dla kukurydzy nie określa się czystości gatunkowej.
3. 6. Zachwaszczenie:
1) dla pszenicy, pszenżyta, jęczmienia, owsa, obu form żyta, prosa, gryki i mozgi kanaryjskiej występowanie roślin, których nasiona są trudne do oddzielenia w procesie czyszczenia na plantacji, nie większe niż:
| a) materiał elitarny | – 1,0 rośliny na 30 m2, |
| b) materiał kwalifikowany | – 1,0 rośliny na 10 m2, |
2) plantacje wszystkich gatunków powinny być praktycznie wolne od następujących chwastów: kąkolu polnego, rzodkwi świrzepy, życicy rocznej, ponadto: żyta od stokłosy żytniej, owsa od owsa szorstkiego i blekotu pospolitego, gryki od tatarki i rdestu powojowego, prosa od dziko rosnących wyk i gorczycy polnej, chwastnicy jednostronnej, włośnicy sinej i zielonej, mozgi kanaryjskiej od babki lancetowatej, chabra bławatka, chwastnicy jednostronnej, powoju polnego, rdestu kolankowatego, szczawiów i śmiałka darniowego,
3) u wszystkich gatunków występowanie innych chwastów w ilości powodującej pogorszenie wykształcenia bądź jakości nasion stanowi podstawę do dyskwalifikacji plantacji,
4) dla poszczególnych gatunków dopuszcza się liczbę roślin owsa głuchego na 1 ha:
| plantacja zgłoszona do produkcji nasion w stopniu | pszenica | jęczmień | owies | żyto, pszenżyto |
| PB i B | 7 | 7 | 0 | 7 |
| K1 i K2 | 50 | 20 | 0 | 50 |
5) dla kukurydzy nie określa się zachwaszczenia.
3. 7. Choroby i szkodniki.
1. Udział roślin porażonych nie może przekraczać na plantacji:
1) głowni źdźbłowej żyta:
| a) materiał elitarny | – 0,6 rośliny na 30 m2, |
| b) materiał kwalifikowany | – 0,3 rośliny na 10 m2, |
2) sporyszu, o ile porażony jest nie tylko skraj uprawy (nie dotyczy żyta mieszańcowego):
| a) materiał elitarny | – 2,0 rośliny na 30 m2, |
| b) materiał kwalifikowany | –1,5 rośliny na 10 m2, |
3) śnieci cuchnącej:
| a) materiał elitarny | – 0,6 rośliny na 30 m2 , |
| b) materiał kwalifikowany | – 0,3 rośliny na 10 m2, |
4) głowni pyłkowej pszenicy lub jęczmienia, głowni zwartej jęczmienia, głowni pyłkowej lub zwartej owsa:
| a) materiał elitarny | – 0,6 rośliny na 30 m2 , |
| b) materiał kwalifikowany | – 0,5 rośliny na 10 m2 , |
5) głowni pyłkowej prosa:
| a) materiał elitarny | – 0,3 rośliny na 30 m2 , |
| b) materiał kwalifikowany | – 0,5 rośliny na 10 m2 , |
6) głownia kukurydziana – plantacja kukurydzy nie może zawierać w większych ilościach roślin porażonych głownią kukurydzianą. Nie dotyczy plantacji linii wsobnych.
2. U wszystkich gatunków z plantacji nie wolno usuwać roślin porażonych głownią. W czasie kiedy plantacja jest wrażliwa na infekcję głownią, sąsiednie uprawy w promieniu 50 m nie powinny zawierać przeciętnie na 30 m2 powierzchni więcej niż 3 rośliny wytwarzające zarodniki głowni.
3. Występowanie innych chorób i szkodników w ilości powodującej pogorszenie jakości nasion stanowi podstawę do dyskwalifikacji plantacji.
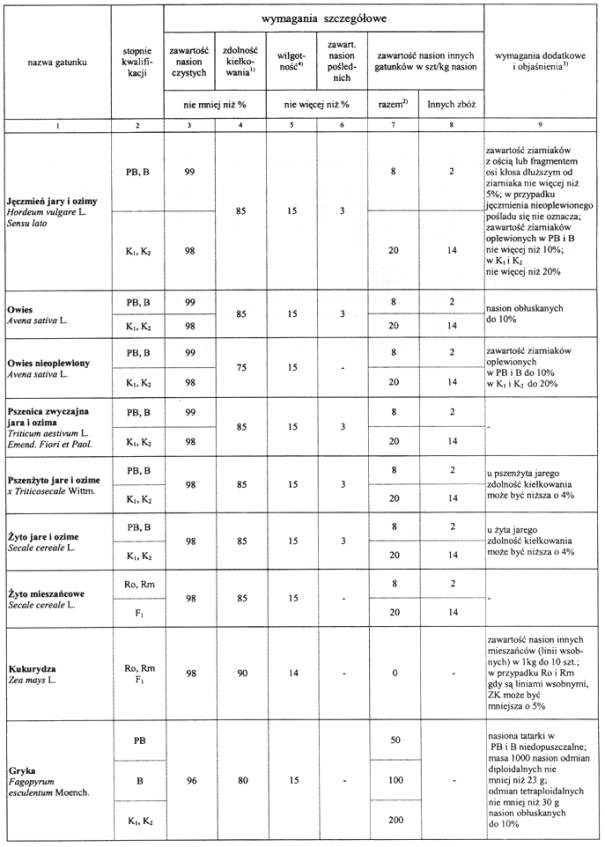
4. Wymagania dotyczące jakości materiału siewnego:

Objaśnienia:
1) W przypadku wykonania testu tetrazolinowego wynik nie może być mniejszy niż 95% z wyjątkiem pszenżyta i gryki.
2) W jęczmieniu, owsie, pszenicy, pszenżycie i życie dopuszcza się obecność nasion kąkolu i rzodkwi świrzepy łącznie dla PB, B do 2 szt./kg, dla K1 i K2 do 6 szt./kg.
3) W jęczmieniu, owsie, pszenicy życie i pszenżycie do 5% nasion z widocznym porostem.
4) Dla nasion zbóż ozimych wysiewanych w roku zbioru wilgotność 16%.
Uwagi:
Obecność sporyszu (Claviceps purpurea) w zbożach w B –1 szt./kg, w K1 i K2 – 3 szt./kg,
a w życie mieszańcowym w materiale kwalifikowanym – 4 szt./kg.
Dopuszcza się występowanie teliospor śnieci cuchnącej {Tilletia caries) w pszenicy w PB i B do 1000 szt./g,w K1 i K2 do 10000 szt./g (określenie występowania ilości teliospor nie musi być przeprowadzone, chyba że zaistniały podejrzenia o ich występowanie).
Obecność kanianki, owsa głuchego i jego mieszańców, owsa płonego oraz życicy rocznej jest niedopuszczalna.
II. Rośliny strączkowe.
1. Stopnie kwalifikacji:
1) materiał elitarny:
| a) nasiona przedbazowe | – PB, |
| b) nasiona bazowe | – B, |
2) materiał kwalifikowany:
|
| a) nasiona kwalifikowane pierwszego rozmnożenia | – K1, |
|
| b) nasiona kwalifikowane drogiego rozmnożenia | – K.2, |
| 3) materiał handlowy | – H. | |
2. Nazwy gatunków roślin strączkowych:
| 1) Cicer arietinum L. | – Ciecierzyca pospolita, |
| 2) Lupinus albus L. | – Łubin biały, |
| 3) Lupinus angustifolius L. | – Łubin wąskolistny, |
| 4) Lupinus luteus L. | – Łubin żółty, |
| 5) Pisum sativum L. spp. Sativum | – Groch siewny, |
| 6) Vicia faba L. var. minor Harz. | – Bobik, |
| 7) Vicia sativa L. spp. Sativa | – Wyka siewna, |
| 8) Vicia villosa Roth. | – Wyka kosmata. |
3. Wymagania dotyczące wytwarzania materiału siewnego przy przeprowadzaniu oceny polowej:
3. 1. Ocena stanu plantacji.
Obowiązuje jedna ocena stanu plantacji w okresie od pełni kwitnienia roślin do początku zawiązywania strąków; w przypadku łubinu należy przeprowadzić jeszcze drugą ocenę w okresie zawiązywania strąków.
3. 2. Zmianowanie.
Plantacji nasiennej danego gatunku nie należy zakładać na polu, na którym w ostatnich trzech latach uprawiano ten sam lub blisko spokrewniony gatunek roślin.
3. 3. Izolacja przestrzenna32).
Muszą być zachowane następujące minimalne odległości, podane w metrach, od innych plantacji pylących w tym samym czasie lub od innych odmian tego samego gatunku i od innych gatunków, których pyłek może prowadzić do zapylenia:
| Lp. | Rodzaj plantacji | B | K1 i K2 |
| 1 | bobiku dla plantacji do 2 ha | 500 | 100 |
| 2 | bobiku dla plantacji powyżej 2 ha | 100 | 50 |
| 3 | łubinu żółtego | 200 | 100 |
| 4 | wyki kosmatej | 200 | 100 |
Przekroczenie minimalnych odległości wymienionych wyżej jest dopuszczalne, jeśli plantacja w wystarczający sposób jest osłonięta przed obcozapyleniem.
W przypadku odmian samopylnych wszystkie sąsiednie plantacje, a w przypadku roślin obcopylnych plantacje niewymienione wyżej muszą być oddzielone pasem izolacyjnym.
3. 4. Czystość odmianowa:
1) dla grochu i bobiku minimalna czystość odmianowa wynosi:
| a) materiał elitarny | – 99,7%, |
| b) materiał kwalifikowany K1 | – 99,0%, |
| c) materiał kwalifikowany K2 | – 98,0%, |
2) dla pozostałych gatunków czystość odmianowa nie większa niż:
| a) materiał elitarny | –1,0 rośliny na 30 m2, |
| b) materiał kwalifikowany | –1,0 rośliny na 10 m2. |
3. 5. Czystość gatunkowa.
Udział roślin należących do innych gatunków nie większy niż:
| 1) materiał elitarny | – 1,0 rośliny na 30 m2, |
| 2) materiał kwalifikowany | – 1,0 rośliny na 10 m2. |
3. 6. Zachwaszczenie.
Silne zachwaszczenie plantacji, powodujące słabe wykształcenie nasion, stanowi podstawę do dyskwalifikacji.
3. 7. Choroby i szkodniki:
1) udział roślin porażonych przez choroby wirusowe przenoszone przez nasiona, antraknozę wywołaną przez grzyby z rodzaju Colletotrichum nie możne przekroczyć na plantacji:
| a) materiału elitarnego | – 2,0 rośliny na 30 m2, |
| b) materiału kwalifikowanego | – 2,0 rośliny na 10 m2, |
2) silne porażenie plantacji przez choroby i szkodniki, mogące być przyczyną pogorszenia jakości nasion, stanowi podstawę do dyskwalifikacji ocenianej plantacji.
4. Wymagania dotyczące jakości materiału siewnego:
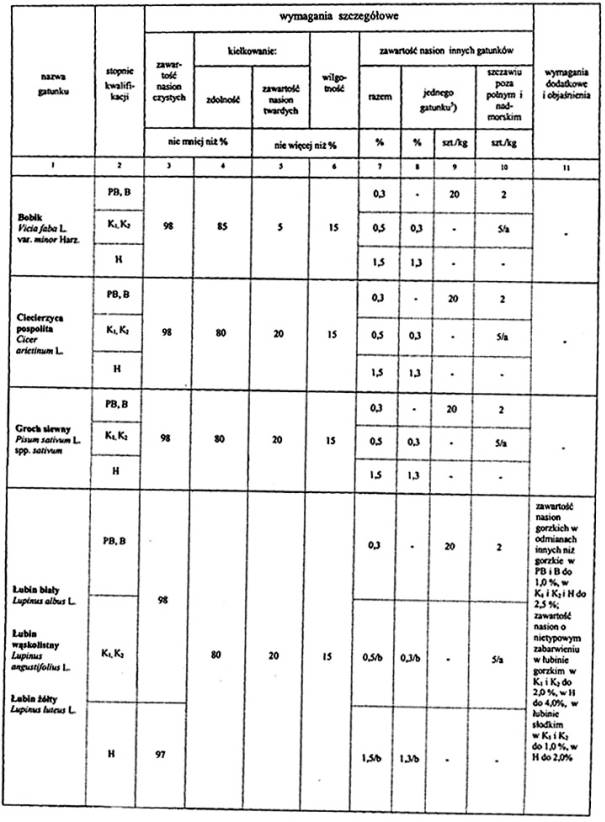
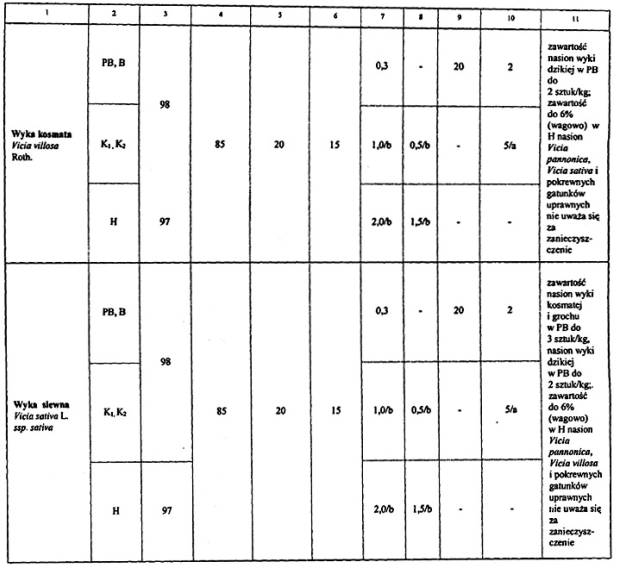
Objaśnienia:
5) Oznaczanie liczby nasion nostrzyku należy wykonywać tylko wtedy, gdy istnieje przypuszczenie, że nostrzyk może wystąpić. W PB i B nie dopuszcza się występowania nasion nostrzyku, w K1 i K2 nie więcej niż 0,3 %.
a Oznaczanie liczby nasion szczawiu należy wykonywać tylko wtedy, gdy istnieje przypuszczenie, że może wystąpić szczaw inny niż szczaw polny i nadmorski w liczbie większej niż podano w kolumnie 10.
b Za zanieczyszczenie do 0,5 % (wagowo) łącznie łubinu białego, łubinu wąskolistnego, łubinu żółtego, grochu, bobiku, wyki siewnej, wyki kosmatej w odnośnych gatunkach.
Uwagi:
Dodatkowe wymagania dotyczące dopuszczalnych ilości nasion innych gatunków roślin, wymienione w kol. 11, stanowią, część składową wymagań określonych w kol. 9 i 10.
Dla bobiku, grochu siewnego i łubinów zawartość nasion uszkodzonych nie może przekraczać 12%.
Wszystkie zdrowe nasiona świeże, które nie skiełkowały po zastosowaniu zabiegów wstępnych, zalicza się do kiełkujących.
Obecność kanianki, owsa głuchego i jego mieszańców jest niedopuszczalna.
III. Rośliny motylkowate drobnonasienne.
1. Stopnie kwalifikacji:
| 1) materiał elitarny: |
|
| a) nasiona przedbazowe | – PB, |
| b) nasiona bazowe | – B, |
| 2) materiał kwalifikowany: |
|
| a) nasiona kwalifikowane pierwszego rozmnożenia | – K1, |
| b) nasiona kwalifikowane drugiego rozmnożenia | – K2, |
| 3) materiał handlowy | – H. |
2. Nazwy gatunków roślin motylkowatych drobnonasiennych:
| 1) Anthyllis vulneraria L. | – Przelot pospolity, |
| 2) Coronilla varia L. | – Cieciorka pstra, |
| 3) Lotus comiculatus L. | – Komonica zwyczajna, |
| 4) Medicago lupulina L. | – Lucerna chmielowa, |
| 5) Medicago sativa L. | – Lucerna siewna, |
| 6) Medicago x varia | – Lucerna mieszańcowa, |
| 7) Melilotus albus Medik. | – Nostrzyk biały, |
| 8) Onobrychis viciifolia Scop. | – Esparceta siewna, |
| 9) Ornithopus sativus Brot | – Seradela siewna, |
| 10) Trifolium alexandrinum L. | – Koniczyna aleksandryjska, |
| 11) Trigonella foenumgraceum L. | – Kozieradka pospolita, |
| 12) Trifolium hybridum L. | – Koniczyna szwedzka, |
| 13) Trifolium incarnatum L. | – Koniczyna krwistoczerwona (Inkarnatka), |
| 14) Trifolium pratense L. | – Koniczyna łąkowa (czerwona), |
| 15) Trifolium repens L. | – Koniczyna biała, |
| 16) Trifolium resupinatum L. | – Koniczyna perska. |
3. Wymagania dotyczące wytwarzania materiału siewnego przy przeprowadzaniu oceny polowej:
3. 1. Ocena stanu plantacji.
Obowiązuje jedna ocena stanu plantacji w okresie między pełnym kwitnieniem, a dojrzewaniem nasion.
3. 2. Zmianowanie.
Plantacji nasiennej nie należy zakładać na polu, na którym w ostatnich 3 latach uprawiano rośliny motylkowate drobnonasienne.
3. 3. Izolacja przestrzenna32).
Izolacja przestrzenna od innych plantacji pylących w tym samym czasie, innych odmian tego samego gatunku, tej samej odmiany o słabym wyrównaniu, innych gatunków, których pyłek może prowadzić do zapylenia, nie mniejsza niż:
| 1) dla materiału elitarnego: |
|
| a) jeśli powierzchnia rozmnożenia wynosi do 2 ha | – 200 m, |
| b) jeśli powierzchnia rozmnożenia jest większa niż 2 ha | – 100 m, |
| 2) dla materiału kwalifikowanego: |
|
| a) jeśli powierzchnia rozmnożenia wynosi do 2 ha | – 100 m, |
| b) jeśli powierzchnia rozmnożenia jest większa niż 2 ha | – 50 m. |
Przekroczenie minimalnych odległości jest dopuszczalne, jeśli plantacja w wystarczający sposób jest osłonięta przed obcozapyleniem.
3. 4. Czystość odmianowa.
U wszystkich gatunków roślin motylkowatych drobnonasiennych czystość odmianowa jest nie większa niż:
| 1) materiał elitarny | – 1,0 rośliny na 30 m2, |
| 2) materiał kwalifikowany | – 1,0 rośliny na 10 m2. |
3. 5. Czystość gatunkowa.
| Występowanie roślin innych gatunków, których nasiona trudno jest oddzielić podczas czyszczenia nie więcej niż w: | |
| 1) materiale elitarnym | 1,0 rośliny na 30 m2, |
| 2) materiale kwalifikowanym | 1,0 rośliny na 10 m2. |
3. 6. Zachwaszczenie:
1) występowanie roślin chwastów w ilości powodującej pogorszenie jakości nasion stanowi podstawę do dyskwalifikacji,
2) dla esparcety – występowanie zarazy powoduje dyskwalifikację,
3) dla komonicy zwyczajnej, koniczyn i lucerny – występowanie kanianki koniczynowej oraz zarazy powoduje dyskwalifikację plantacji,
4) dla koniczyny i lucerny w materiale bazowym – występowanie nostrzyku żółtego jest niedopuszczalne.
3. 7. Choroby i szkodniki:
| 1) ilość roślin wykazujących porażenie chorobami zgorzelowymi nie więcej niż w: | ||
| a) materiale elitarnym | – 0,5 rośliny na 30 m2, | |
| b) materiale kwalifikowanym | –1,0 rośliny na 10 m2, | |
| 2) ilość roślin wykazujących porażenie chorobami wirusowymi, zarazą, rakiem i rizoktoniozą nie więcej niż w: | ||
| a) materiale elitarnym | – 2,0 rośliny na 30 m2, | |
| b) materiale kwalifikowanym | – 2,0 rośliny na 10 m2. | |
Silne porażenie przez inne choroby i szkodniki mogące być przyczyną pogorszenia jakości nasion stanowi podstawę do dyskwalifikacji.
4. Wymagania dotyczące jakości materiału siewnego:
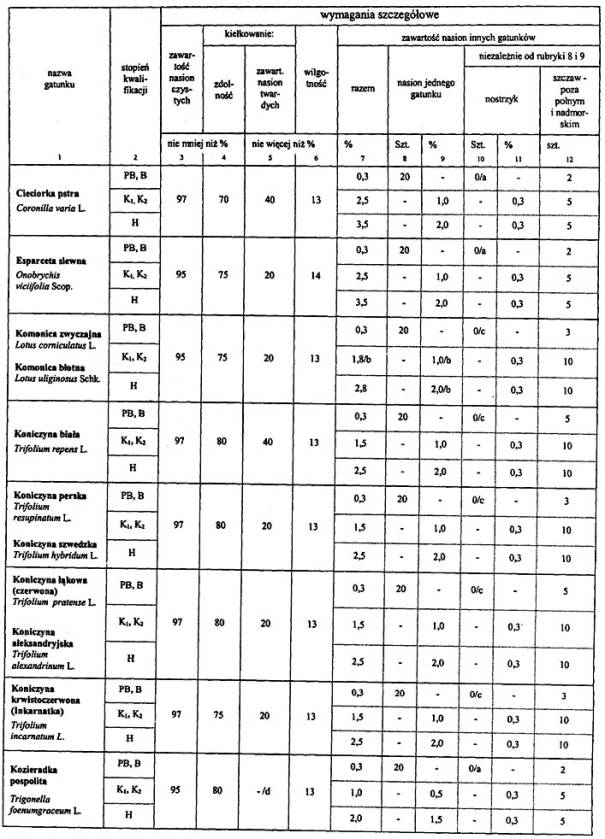
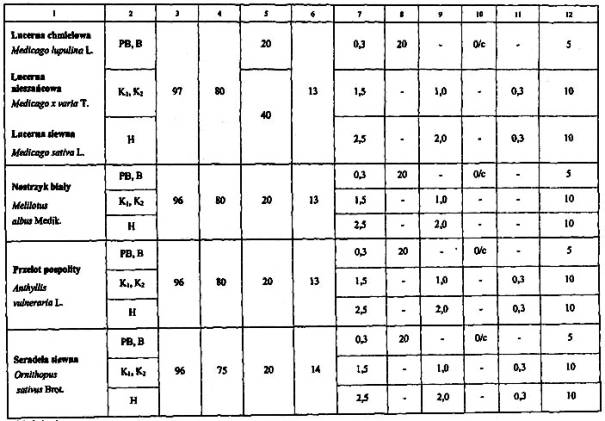
Objaśnienia:
a Ocenę podejmuje się wówczas, kiedy powstało podejrzenie zanieczyszczenia.
b Maksymalnie 1,0% nasion koniczyny czerwonej nie traktuje się jako zanieczyszczenie.
c Jedno nasienie nie traktuje się jako zanieczyszczenie, jeśli dodatkowa próba o masie podwójnej jest wolna od zanieczyszczeń.
d Wszystkie nasiona twarde zalicza się do kiełkujących.
Uwagi:
Wszystkie zdrowe nasiona świeże, które nie skiełkowały po zastosowaniu zabiegów wstępnych, zalicza się do kiełkujących.
Obecność kanianki, owsa głuchego i jego mieszańców jest niedopuszczalna.
IV. Trawy.
1. Stopnie kwalifikacji:
| 1) materiał elitarny: |
|
| a) nasiona przedbazowe | – PB, |
| b) nasiona bazowe | – B, |
| 2) materiał kwalifikowany: |
|
| a) nasiona kwalifikowane pierwszego rozmnożenia | – K1, |
| b) nasiona kwalifikowane drugiego rozmnożenia | – K2, |
| 3) materiał handlowy | – H. |
2. Nazwy gatunków traw:
| 1) Agrostis canina L. | – Mietlica psia, |
| 2) Agrostis capillaris L. | – Mietlica pospolita, |
| 3) Agrostis giganthea Roth. | – Mietlica biaława, |
| 4) Agrostis stolonifera L. | – Mietlica rozłogowa, |
| 5) Ahpecrus pratensis L. | – Wyczyniec łąkowy, |
| 6) Arrhenatherum elatius (L.) Beauv. | – Rajgras wyniosły (francuski) |
| (Avena elatior L.) | (Owsik wyniosły), |
| 7) Bromus inermis Leys. | – Stokłosa bezostna, |
| 8) Bromus unioloides Humb. et Kunth | – Stokłosa uniolowata, |
| (Bromus catharticus Vahl) |
|
| 9) Cynosurus cristatus L. | – Grzebienica pospolita, |
| 10) Dactylis Aschersoniana Graebn | – Kupkówka Aschersona, |
| 11) Dactylis glomerata L. | – Kupkówka pospolita, |
| 12) Deschampsia caespitosa L. | – Śmiałek darniowy, |
| 13) Festuca arundinacea Schreb. | – Kostrzewa trzcinowa, |
| 14) Festuca heterophylla Lam. | – Kostrzewa różnolistna, |
| 15) Festuca ovina L. | – Kostrzewa owcza, |
| 16) Festuca pratensis Huds. | – Kostrzewa łąkowa, |
| 17) Festuca pratensis Huds. |
|
| x Lolium multiflorum Lam. | – Festulolium, |
| 18) Festuca rubra L. | – Kostrzewa czerwona, |
| 19) Lolium boucheanum Kunth. | – Życica mieszańcowa, |
|
| (Rajgras oldenburski), |
| 20) Lolium multiflorum Lam. | – Życica wielokwiatowa |
|
| (Rajgras włoski), |
| 21) Lolium multiflorum |
|
| var. westerwoldicum Wittm. | – Życica westerwoldzka |
|
| (Rajgras holenderski), |
| 22) Lolium perenne L. | – Życica trwała (Rajgras angielski), |
| 23) Phalaris arundinacea L. | – Mozga trzcinowata, |
| 24) Phleum nodosum auct. (Phleum bertołonii L.) | – Tymotka dzika (kolankowata), |
| 25) Phleum pratense L. | – Tymotka łąkowa, |
| 26) Poa annua L. | – Wiechlina roczna, |
| 27) Poa compressa L. | – Wiechlina spłaszczona, |
| 28) Poa nemoralis L. | – Wiechlina gajowa, |
| 29) Poa palustris L. | – Wiechlina błotna, |
| 30) Poa pratensis L. | – Wiechlina łąkowa, |
| 31) Poa trivilis L. | – Wiechlina zwyczajna. |
3. Wymagania dotyczące wytwarzania materiału siewnego przy przeprowadzaniu oceny polowej:
3. 1. Ocena stanu plantacji.
Obowiązuje jedna ocena stanu plantacji w okresie między pełnym wykłoszeniem a dojrzewaniem nasion.
3. 2. Zmianowanie.
Plantacji nasiennej nie należy zakładać na polu, na którym w ostatnich dwóch latach uprawiano daną odmianę, lub trzech latach, jeśli uprawiano inną odmianę traw niezależnie od gatunku.
3. 3. Izolacja przestrzenna32).
Izolacja przestrzenna od innych plantacji pylących w tym samym czasie, innych odmian tego samego gatunku, tej samej odmiany o słabym wyrównaniu, innych gatunków, których pyłek może prowadzić do zapłodnienia, nie mniejsza niż:
| 1) materiał elitarny: | |||
| a) jeśli powierzchnia rozmnożenia wynosi do 2 ha | – 200 m, | ||
| b) jeśli powierzchnia rozmnożenia jest większa niż 2 ha | – 100 m, | ||
| 2) materiał kwalifikowany: | |||
| a) jeśli powierzchnia rozmnożenia wynosi do 2 ha | – 100 m, | ||
| b) jeśli powierzchnia rozmnożenia jest większa niż 2 ha | – | 50 m. | |
Przekroczenie minimalnych odległości jest dopuszczalne, jeśli plantacja w wystarczający sposób
jest osłonięta przed obcozapyleniem.
W przypadku odmian samopylnych plantacje muszą być oddzielone pasem izolacyjnym (technicznym).
3. 4. Czystość odmianowa:
| 1) dla wiechliny łąkowej minimalna czystość odmianowa wynosi: | ||
| a) materiał elitarny | –1,0 rośliny na 20 m2, | |
| b) materiał kwalifikowany | – 4,0 rośliny na 10 m2, | |
| c) materiał kwalifikowany dla odmian |
| |
| apomiktycznych – jednoklonalnych | – 6,0 rośliny na 10 m2, | |
| 2) dla pozostałych gatunków traw czystość odmianowa nie może przekraczać: | ||
| a) materiał elitarny | – 1,0 rośliny na 30 m2 , | |
| b) materiał kwalifikowany | –1,0 rośliny na 10 m2. | |
3. 5. Czystość gatunkowa:
| 1) dla gatunków Lolium (Życice) i x Festulolium występowanie roślin innych gatunków nie może przekraczać w: | |
| a) materiale elitarnym | – 1,0 rośliny na 50 m2, |
| b) materiale kwalifikowanym | –1,0 rośliny na 10 m2, |
| 2) dla pozostałych gatunków : |
|
| a) materiał elitarny | –1,0 rośliny na 30 m2, |
| b) materiał kwalifikowany | –1,0 rośliny na 10 m2. |
3. 6. Zachwaszczenie:
1) występowanie kanianki jest niedopuszczalne,
2) w materiale elitarnym niedopuszczalne jest występowanie roślin owsa głuchego,
3) plantacja powinna być praktycznie wolna od roślin chwastów trudnych do oddzielenia w procesie czyszczenia,
4) występowanie roślin innych chwastów w ilości powodującej pogorszenie wykształcenia bądź jakości nasion ocenianego gatunku stanowi podstawę do dyskwalifikacji.
3. 7. Choroby i szkodniki:
1) ilość roślin wykazujących porażenie chorobami zgorzelowymi nie więcej niż w:
| a) materiale elitarnym | – 0,5 rośliny na 30 m2, |
| b) materiale kwalifikowanym | – 1,0 rośliny na 10 m2, |
2) ilość roślin wykazujących porażenie chorobami wirusowymi, pochewczakiem, śniecią i głownią nie więcej niż w:
| a) materiale elitarnym | – 2,0 rośliny na 30 m2, |
| b) materiale kwalifikowanym | – 2,0 rośliny na 10 m2, |
3) silne porażenie przez inne choroby i szkodniki mogące być przyczyną pogorszenia jakości nasion stanowi podstawę do dyskwalifikacji.
4. Wymagania dotyczące jakości materiału siewnego:
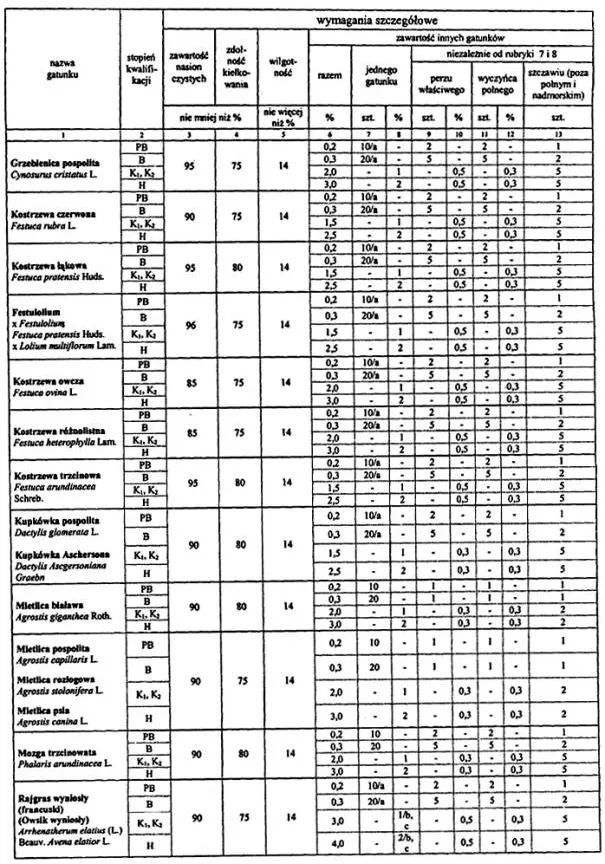
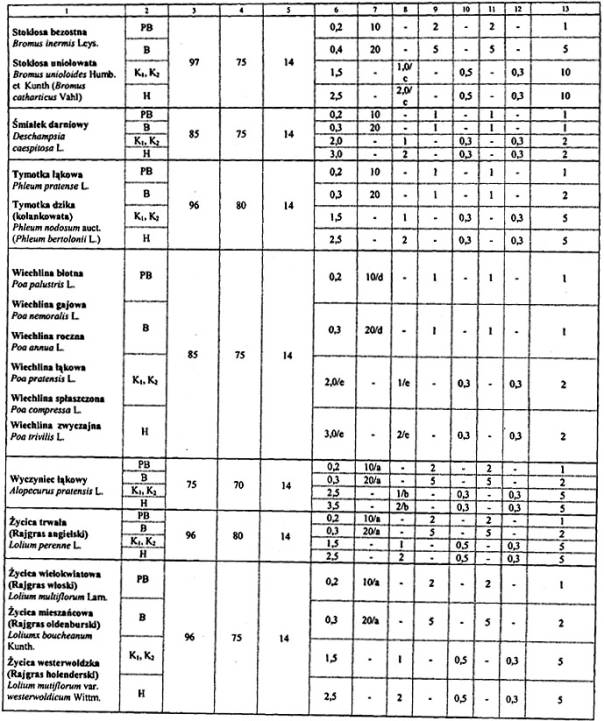
Objaśnienia:
a Zawartość gatunków wiechlin do 40 sztuk w PB i 80 sztuk w B nie jest traktowana jako zanieczyszczenie.
b Maksymalna zawartość w % nasion jednego gatunku nie dotyczy innych gatunków wiechlin.
c Dwa nasiona owsa głuchego i (lub) owsa płonego w próbce nie są uważane za zanieczyszczenie, gdy druga próbka o tej masie jest wolna od nasion tych gatunków.
d Nie dotyczy obecności innych gatunków wiechlin, najwyższa zawartość innych gatunków wiechlin niż badanych nie może przekraczać 1 sztuki w próbce 1000 sztuk w PB, 1 sztuki w próbce 500 sztuk w B.
e Do 0,8 % nasion innych niż oznaczany gatunek wiechlin nie uważa się za zanieczyszczenie.
Uwagi:
Wszystkie zdrowe nasiona świeże, które nie skiełkowały po zastosowaniu zabiegów wstępnych, zalicza się do kiełkujących.
Obecność kanianki, owsa głuchego i jego mieszańców jest niedopuszczalna z wyjątkiem lit. c.
V. Burak cukrowy i burak pastewny.
1. Stopnie kwalifikacji:
| 1) odmiany ustalone – materiał elitarny: |
|
| a) nasiona przedbazowe | – PB, |
| b) nasiona bazowe | – B, |
| 2) odmiany mieszańcowe: |
|
| a) materiał elitarny – nasiona bazowe | – Rm, Ro, |
| b) materiał kwalifikowany | – F1. |
2. Nazwy gatunków:
| 1) Beta vulgaris L.ssp. vulgaris convar. |
|
| vulgaris var. altissima Doll | – Burak cukrowy, |
| 2) Beta vulgaris L.ssp. vulgaris convar. |
|
| vulgaris var. rapacea K.Koch | – Burak pastewny. |
3. Wymagania dotyczące wytwarzania materiału siewnego przy przeprowadzaniu oceny polowej:
3. 1. Ocena stanu plantacji:
1) pierwszy rok uprawy – jedna w okresie wytwarzania wysadków,
2) drugi rok uprawy:
a) odmiany ustalone – jedna w okresie kwitnienia do początku dojrzewania nasion,
b) odmiany mieszańcowe:
– jedna w okresie pełni kwitnienia roślin,
– druga w okresie dojrzewania roślin.
3. 2. Zmianowanie.
Plantacji nasiennej nie można zakładać na polu, na którym w ciągu poprzednich czterech lat uprawiano buraki lub występowały burakochwasty, a w ostatnim roku gatunki roślin z rodziny krzyżowych.
3. 3. Izolacja przestrzenna32):
| 1) dla materiału elitarnego – minimalna odległość plantacji od jakichkolwiek źródeł pyłku z rodzaju Beta wynosi | – 1 000 m, |
| 2) dla materiału kwalifikowanego – minimalna odległość plantacji od źródeł pyłku z rodzaju Beta niepodanych poniżej, wynosi | – 1 000 m, |
| a) właściwy zapylacz lub jeden z zapylaczy będący diploidem, od źródeł pyłku z tetraploidalnych buraków wynosi | – 600 m, |
| b) właściwy zapylacz będący wyłącznie tetraploidem, |
|
| – od źródeł pyłku z diploidalnych buraków wynosi | – 600 m, |
| – od źródeł pyłku, którego ploidalność buraka nie jest znana, wynosi | – 600 m, |
| c) właściwy zapylacz, lub jeden z zapylaczy będący diploidem, od źródeł pyłku z diploidalnych buraków wynosi | – 300 m, |
| d) właściwy zapylacz będący wyłącznie tetraploidem, od źródeł pyłku z tetraploidalnych buraków wynosi | – 300 m, |
| e) pomiędzy dwoma plantacjami nasiennymi buraka, na których nie jest stosowana męska sterylność, wynosi | – 300 m, |
3) wymienione odległości mogą być mniejsze, jeśli istnieje wystarczająca ochrona przed niepożądanym obcym zapyleniem (np. osłony z konopi). Nie jest wymagana izolacja pomiędzy dwiema plantacjami nasiennymi, jeśli wykorzystywany jest ten sam zapylacz.
3. 4. Czystość odmianowa:
1) występowanie roślin innych odmian i typów użytkowych buraka, jak również obecność roślin męskopłodnych w formie męskosterylnej jest niedopuszczalne,
2) nieusunięcie roślin linii zapylającej przed ostatnią lustracją powoduje dyskwalifikację plantacji.
3. 5. Czystość gatunkowa.
Plantacja ma być wolna od nasienników innych gatunków roślin korzeniowych.
Zawartość burakochwastów w każdej próbie nasion wyprodukowanych poza granicami kraju nie może przekraczać 0,05%.
3. 6. Zachwaszczenie.
Silne zachwaszczenie plantacji, utrudniające dobre wykształcenie nasion, stanowi podstawę do dyskwalifikacji plantacji.
3. 7. Choroby i szkodniki:
1) występowanie skośnika buraczaka powoduje dyskwalifikację plantacji,
2) występowanie roślin z objawami żółtaczki wirusowej w ilości ponad 5% lub mączniaka rzekomego w ilości ponad 1% powoduje dyskwalifikację plantacji,
3) silne porażenie przez inne choroby i szkodniki, a zwłaszcza przez mszyce, stanowi podstawę do dyskwalifikacji plantacji.
Stwierdzenie występowania na plantacji wad niedopuszczalnych, niezależnie od tego czy ujawniono je podczas badania jednostek kwalifikacyjnych, czy w jakimkolwiek innym przypadku, dyskwalifikuje plantację.
Plantacją nasienną składnika rodzicielskiego mieszańca może być jednorodna uprawa obsiana (obsadzona) formą ojcowską (produkcja zapylacza) lub niejednorodna uprawa obsiana (obsadzona) w osobnych rzędach męskosterylną linią mateczną, a w osobnych rzędach linią męskopłodną 0 (zero) odtwarzającą sterylność linii matecznej (produkcja składnika matecznego).
4.Wymagania dotyczące jakości materiału siewnego:
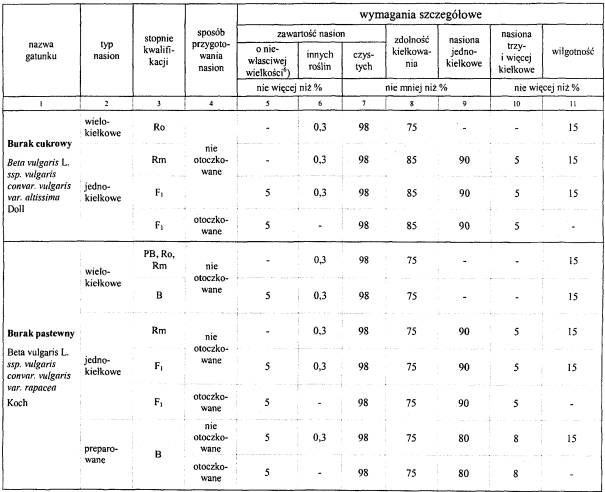
Objaśnienie:
6) Nasiona przeznaczone do siewu punktowego o średnicy (kalibrażu) od 3,20 mm do 5,00 mm, pozostałe o średnicy powyżej 2,50 mm.
Uwaga:
Obecność kanianki, owsa głuchego i jego mieszańców jest niedopuszczalna.
VI. Inne rośliny rolnicze.
1. Stopnie kwalifikacji:
1) materiał elitarny:
| a) nasiona przedbazowe | – PB, |
| b) nasiona bazowe | – B, |
2) materiał kwalifikowany:
| a) nasiona kwalifikowane pierwszego rozmnożenia | – K1, |
| b) nasiona kwalifikowane drugiego rozmnożenia | – K2. |
2. Nazwy gatunków:
| 1) Amaranthus cruentus L. | – Szarłat krwisty, |
| 2) Brassica oleracea L. ssp. oleracea convar. acephala (DC) Alef. var. viridis et var. medullosa Thell) | – Kapusta pastewna, |
| 3) Brassica napus. emend. Metzg. ssp rapifera Metzg. | – Rzepa pastewna, |
| 4) Brassica rapa L. emend. Metzg. ssp. rapa | – Brukiew pastewna, |
| 5) Cichorium intybus L. var. sativum DC. | – Cykoria korzeniowa, |
| 6) Daucus carota L. ssp. sativus (Hoffm.) Schubl. et G. Martens | – Marchew pastewna, |
| 7) Nicotiana tabacum L. | – Tytoń szlachetny, |
| 8) Phacelia tanacetifolia Benth. | – Facelia błękitna, |
| 9) Raphanus sativus L. | – Rzodkiew oleista, |
| 10) Humulus lupulus L. | – Chmiel. |
3. Wymagania dotyczące wytwarzania materiału siewnego przy przeprowadzaniu oceny polowej:
3. 1. Ocena stanu plantacji:
1) pierwszy rok uprawy – jedna w okresie wytwarzania wysadków,
2) drugi rok uprawy – jedna lustracja w okresie od kwitnienia roślin do początku dojrzewania nasion (żółknięcia łuszczyn),
3) dla metody bezwysadkowej*, którą mogą być uprawiane gatunki dwuletnie (kapusta pastewna, rzepa pastewna, brukiew pastewna, cykoria korzeniowa, marchew pastewna), obowiązują dwie oceny stanu plantacji:
a) w okresie formowania pędów kwiatowych,
b) w okresie od kwitnienia roślin do dojrzewania nasion,
4) dla gatunków jednorocznych – jedna ocena stanu plantacji od kwitnienia do początku zawiązywania nasion,
5) dla chmielu jedna ocena w okresie 2–3 tygodni przed zbiorem szyszek.
* Metodę bezwysadkową stosuje się tylko do rozmnażania nasion przedbazowych na bazowe. Nasiona wyprodukowane metodą bezwysadkową nie mogą być używane do dalszej reprodukcji.
3. 2. Zmianowanie:
1) plantacji nasiennej danego gatunku nie można zakładać na polu, na którym w ostatnich dwóch latach uprawiano ten gatunek lub blisko spokrewniony gatunek roślin,
2) plantacji tytoniu nie można zakładać na polu, na którym przedplonem były rośliny psiankowate,
3) plantacji kapusty pastewnej nie można zakładać na polu, na którym:
a) w ostatnich pięciu latach uprawiano kapustę,
b) w ostatnich trzech latach uprawiano rośliny krzyżowe,
c) w ostatnich dwóch latach uprawiano buraki,
4) plantacji chmielu nie można zakładać na polu, na którym w ostatnich sześciu latach uprawiano chmiel; plantacje chmielu nie mogą być starsze niż:
a) 18 lat – dla plantacji obsadzonych materiałem PB,
b) 15 lat – dla plantacji obsadzonych materiałem w pozostałych stopniach kwalifikacji.
3. 3. Izolacja przestrzenna32).
Odległość dla wszystkich stopni kwalifikacji nie mniejsza niż:
| 1) od plantacji nasiennych i zasiewów innych odmian lub blisko | – 1000 m, |
| spokrewnionych gatunków roślin | |
| 2) dla marchwi pastewnej | – 500 m, |
| 3) dla faceli błękitnej: |
|
| a) dla stopnia kwalifikacji B | – 400 m, |
| b) dla stopnia kwalifikacji K1 | – 200 m, |
| 4) od plantacji w pierwszym roku uprawy, na których występują pośpiechy: |
|
| a) dla brukwi pastewnej wszystkich stopni kwalifikacji | – 200 m, |
| b) dla cykorii stopnia kwalifikacji B | – 500 m, |
| c) dla cykorii stopnia kwalifikacji K1 | – 200 m, |
| d) dla marchwi wszystkich stopni kwalifikacji | – 200 m, |
| od łąk, pastwisk, miedz, wąwozów zachwaszczonych, dróg | – 100 m, |
| e) dla cykorii i marchwi | – 50 m, |
| f) dla tytoniu: |
|
| – od upraw innych odmian tytoniu | – 300 m, |
| – od upraw ziemniaka, pomidora | – 50 m, |
| – składniki mieszańca Ro i Rm oraz PB – rozmnaża się wyłącznie w izolatorach, | |
| g) dla chmielu – jeden rząd od plantacji innych odmian i plantacji przemysłowych. | |
3. 4. Czystość odmianowa:
| 1) dla kapusty pastewnej i rzepy pastewnej minimalna czystość odmianowa wynosi w: | |
| a) materiale elitarnym | – 99,7%, |
| b) materiale kwalifikowanym K1 | – 99,0%, |
| c) materiale kwalifikowanym K2 | – 98,0%, |
| 2) dla pozostałych gatunków czystość odmianowa nie powinna przekraczać w: | |
| a) materiale elitarnym | – 1,0 rośliny na 30 m2, |
| b) materiale kwalifikowanym | – 1,0 rośliny na 10 m2, |
| 3) dla chmielu – występowanie roślin nietypowych jest niedopuszczalne. | |
3. 5. Czystość gatunkowa.
Plantacja powinna być wolna od pędów nasiennych innych gatunków i grup roślin uprawnych blisko spokrewnionych z uprawianym gatunkiem.
3. 6. Zachwaszczenie:
1) występowanie chwastów z tej samej rodziny lub blisko spokrewnionych jest niedopuszczalne na plantacji w stopniu kwalifikacji – PB i B,
2) silne zachwaszczenie plantacji chwastami niepozwalające na dobre wykształcenie nasion, stanowi podstawę do dyskwalifikacji plantacji,
3) sporadyczne występowanie chwastów jest dopuszczalne na plantacji w stopniach kwalifikacji K1,
4) dla chmielu zachwaszczenie mogące obniżyć jakość sadzonek jest podstawą do dyskwalifikacji plantacji.
3. 7. Choroby i szkodniki.
Silne porażenie przez choroby lub szkodniki, wpływające na pogorszenie wykształcenia kwiatostanów bądź jakości nasion, stanowi podstawę do dyskwalifikacji plantacji:
1) dla chmielu:
a) występowanie chorób uwiądowych spowodowanych przez Verticilium alboatrum i Fusarium ssp. jest podstawą do dyskwalifikacji,
b) występowanie na jednostkę kwalifikacyjną roślin porażonych nie więcej niż:
| – kędzierzawką (Humulus virus 2 Duffield) | – 0,1, |
| – mozaiką [Humulus virus 3 (Salomon et Ware) Smith] | – 0,2, |
c) inne choroby i szkodniki występujące w nasileniu mogącym pogorszyć jakość sadzonek stanowią podstawę do dyskwalifikacji plantacji,
2) dla tytoniu – porażenie tytoniu przez choroby i szkodniki, a w szczególności porażenie kwiatostanów i nasienników przez grzyba brunatnej plamistości liści (Ąlternaria alternata) lub piętnówkę kapustnicę, a także wystąpienie innych chorób i szkodników (wirusy TSWV i PVY, „koguci ogon", mszyce, zmienniki) w stopniu wpływającym na pogorszenie wykształcenia kwiatostanów bądź jakości nasion stanowi podstawę do dyskwalifikacji plantacji.
4. Wymagania dotyczące jakości materiału siewnego:
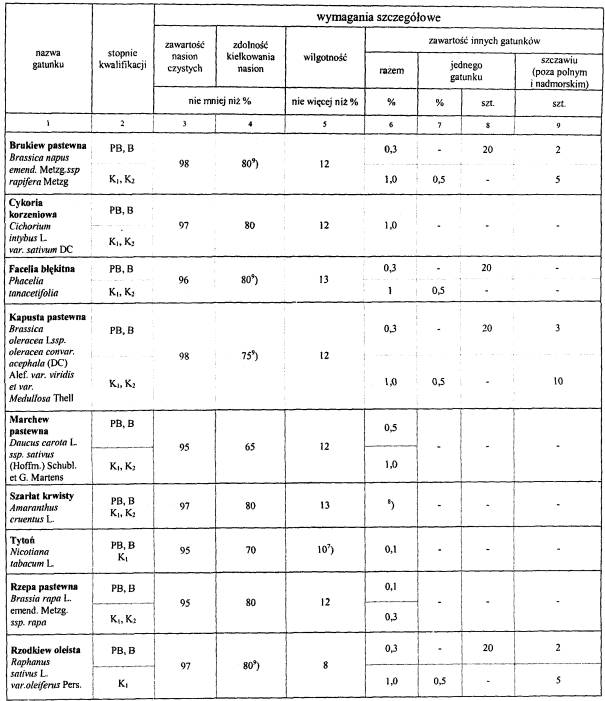
Objaśnienia:
7) W PB wilgotność nie jest określona.
8) Zawartość innych gatunków i odmian szarłatu w PB i B niedopuszczalna; w K1 i K2 nie więcej niż 25 sztuk/2 g.
9) Wszystkie zdrowe nasiona świeże, które nie skiełkowały po zastosowaniu zabiegów wstępnych, zalicza się do kiełkujących.
Uwaga:
Obecność kanianki, owsa głuchego i jego mieszańców jest niedopuszczalna.
VII. Rośliny oleiste i włókniste.
1. Stopnie kwalifikacji:
| 1) odmiany ustalone: |
|
| a) materiał elitarny: |
|
| – nasiona przedbazowe | – PB, |
| – nasiona bazowe | – B, |
| b) materiał kwalifikowany: |
|
| – nasiona kwalifikowane pierwszego rozmnożenia | – K1, |
| – nasiona kwalifikowane drugiego rozmnożenia | – K2, |
| c) materiał handlowy | – H (wyłącznie dla soi zwyczajnej), |
| 2) odmiany mieszańcowe: |
|
| a) materiał elitarny – nasiona bazowe | – Rm, Ro, |
| b) materiał kwalifikowany – nasiona kwalifikowane | – F1. |
2. Nazwy gatunków roślin oleistych i włóknistych:
| 1) Brassica juncea (L.) Czern. Et Coss. | – Gorczyca sarepska, |
| 2) Brassica napus L. var oleifera Metzger. | – Rzepak ozimy i jary, |
| 3) Brassica nigra (L.) W. Koch | – Gorczyca czarna, |
| 4) Brassica rapa L. var oleifera D.C. (syn campestris) | – Rzepik ozimy i jary, |
| 5) Camelina sativa L. Crantz | – Lnianka (Lnicznik siewny), |
| 6) Cannabis sativa L. | – Konopie, |
| 7) Carum carvi L. | – Kminek zwyczajny, |
| 8) Cucurbita pepo L. var. oleifera Pieth | – Dynia oleista, |
| 9) Glicyne max (L.) Merr. | – Soja zwyczajna, |
| 10) Helianthus annus L. | – Słonecznik oleisty, |
| 11) Linum usitatissimum L. | – Len zwyczajny: |
|
| a) Len oleisty, |
|
| b) Len włóknisty, |
| 12) Papaver somniferum L. | – Mak, |
| 13) Sinapis alba L. | – Gorczyca biała, |
| 14) Crambe abyssinica Hochst. Fries | – Katran (kapusta abisyńska). |
3. Wymagania dotyczące wytwarzania materiału siewnego przy przeprowadzaniu oceny polowej:
3. 1. Ocena stanu plantacji:
1) obowiązuje jedna ocena stanu plantacji – lustracja (z wyjątkiem konopi jednopiennych) dla:
a) gorczycy sarepskiej, czarnej, białej, rzepaku, rzepiku, konopi dwupiennych, soi, lnu włóknistego, oleistego, maku, kminku zwyczajnego, słonecznika – w okresie od kwitnienia do początku zawiązywania nasion,
b) dyni oleistej – w okresie dojrzałości owoców,
2) obowiązują dwie oceny stanu plantacji dla konopi jednopiennych:
a) pierwsza – po wykształceniu się osobników dwupiennych, ale przed rozpoczęciem kwitnienia osobników męskich (płaskonii),
b) druga – w trzy tygodnie po wykonaniu pierwszej oceny stanu plantacji,
3) obowiązują trzy oceny stanu plantacji dla rzepaku mieszańcowego:
a) pierwsza – wczesną wiosną, przed kwitnieniem,
b) druga – w pełni kwitnienia,
c) trzecia – po zakończeniu kwitnienia.
3. 2. Zmianowanie:
1) plantacji nasiennych wyżej wymienionych gatunków, z wyjątkiem gatunków, o których mowa w pkt 2–4, nie należy zakładać na polu, na którym bezpośrednim przedplonem były te gatunki lub gatunki pokrewne,
2) dla rzepaku – plantacji nasiennej odmian podwójnie ulepszonych nie można zakładać na polu, na którym w ostatnich trzech latach uprawiano rośliny krzyżowe, a w ostatnich pięciu latach uprawiano inne odmiany rzepaku niż odmiany podwójnie ulepszone,
3) dla kminku zwyczajnego – plantacji nasiennej nie można zakładać na polu, na którym w ostatnich dwóch latach uprawiane były rośliny z rodziny baldaszkowatych,
4) dla soi – plantacji nasiennych nie można uprawiać na polu, na którym w ostatnich trzech latach uprawiano soję.
3. 3. Izolacja przestrzenna32).
Ustala się następujące odległości od sąsiadujących źródeł pyłku, które mogą spowodować niepożądane obce zapylenie:
| 1) dla wszystkich gatunków z grupy krzyżowych (Brassica ssp.), oprócz rzepaku jarego i ozimego, konopi, oprócz konopi jednopiennych, oraz dla kminku, gorczycy białej nie mniejsza niż: | |
| a) w przypadku produkcji nasion elitarnych | – 400 m, |
| b) w przypadku produkcji nasion kwalifikowanych | – 200 m, |
| 2) dla rzepaku jarego i ozimego odmian ustalonych: |
|
| a) w przypadku produkcji nasion elitarnych | – 200 m, |
| b) w przypadku produkcji nasion kwalifikowanych | – 100 m, |
| 3) dla rzepaku jarego i ozimego odmian mieszańcowych: |
|
| a) w przypadku produkcji nasion elitarnych | – 500 m, |
| b) w przypadku produkcji nasion kwalifikowanych | – 300 m, |
| 4) dla konopi jednopiennych: |
|
| a) w przypadku produkcji nasion elitarnych | – 5000 m, |
| b) w przypadku produkcji nasion kwalifikowanych | – 1000 m, |
| 5) dla słonecznika: |
|
| a) w przypadku produkcji nasion elitarnych mieszańców | – 1500 m, |
| b) w przypadku produkcji nasion elitarnych innych niż mieszańce | – 750 m, |
| c) w przypadku produkcji nasion kwalifikowanych | – 500 m. |
Jeżeli istnieje wystarczająca ochrona przed jakimkolwiek niepożądanym obcym zapyleniem, zachowanie odległości w pkt 1–5 nie jest wymagane.
3. 4. Czystość odmianowa:
| 1) dla gorczycy sarepskiej, gorczycy czarnej, kminku i konopi liczba roślin uznanych za nie należące do odmiany nie może przekraczać w: | |
| a) materiale elitarnym | – 1,0 rośliny na 30m2, |
| b) materiale kwalifikowanym | – 1,0 rośliny na 10m2, |
| 2) dla soi minimalna czystość odmianowa wynosi w: |
|
| a) materiale elitarnym | – 99,5%, |
| b) materiale kwalifikowanym | – 99,0%, |
| 3) dla gorczycy białej minimalna czystość odmianowa wynosi w: | |
| a) materiale elitarnym | – 99,7%, |
| b) materiale kwalifikowanym | – 99,0%, |
| 4) dla rzepaku i rzepiku minimalna czystość odmianowa wynosi w: | |
| a) materiale elitarnym | – 99,9%, |
| b) materiale kwalifikowanym | – 99,7%, |
| c) poziom męskiej jałowości (sterylności) w składniku matecznym nie mniej niż | – 98,0% w ocenie następczej, |
| 5) dla lnu minimalna czystość odmianowa wynosi w: |
|
| a) materiale elitarnym | – 99,7%, |
| b) materiale kwalifikowanym K1 | – 98,0%, |
| c) materiale kwalifikowanym K.2 | – 97,5%, |
| 6) dla maku minimalna czystość odmianowa wynosi w: |
|
| a) materiale elitarnym | – 99,0%, |
| b) materiale kwalifikowanym | – 98,0%. |
3. 5. Czystość gatunkowa.
Występowanie gatunków roślin, których nasiona trudno jest oddzielić podczas czyszczenia, nie może przekraczać:
| 1) dla gorczycy sarepskiej: |
|
| a) w materiale elitarnym | – 1,0 rośliny na 30 m2, |
| b) w materiale kwalifikowanym | – 1,0 rośliny na 10 m2, |
| 2) występowanie gorczycy innej niż oceniana: |
|
| a) w materiale elitarnym | – niedopuszczalne, |
| b) w materiale kwalifikowanym | – 1,0 rośliny na 10 m2, |
| 3) dla gorczycy czarnej i białej: |
|
| a) w materiale elitarnym | – 1,0 rośliny na 30 m2, |
| b) w materiale kwalifikowanym | – 1,0 rośliny na 10 m2, |
| 4) dla rzepaku, rzepiku: |
|
| a) w materiale elitarnym | – 1,0 rośliny na 30 m2, |
| b) w materiale kwalifikowanym | – 1,0 rośliny na 10 m2. |
Występowanie rzepaku jarego w ozimym oraz rzepiku jarego w ozimym i odwrotnie jest niedopuszczalne.
Dla konopi, kminku zwyczajnego, słonecznika, maku – plantacja ma być praktycznie wolna od roślin innych gatunków uprawnych.
Dla dyni oleistej występowanie innych odmian botanicznych dyni zwyczajnej jest niedopuszczalne.
Dla lnu – plantacja ma być praktycznie wolna od roślin Inianki.
Dla soi – plantacja ma być praktycznie wolna od roślin grochu siewnego i łubinu.
3. 6. Zachwaszczenie.
Występowanie chwastów z tej samej rodziny lub blisko spokrewnionych jest niedopuszczalne na plantacji w stopniu kwalifikacji – B.
Sporadyczne występowanie chwastów jest dopuszczalne na plantacji w stopniach kwalifikacji K1.
Silne zachwaszczenie plantacji chwastami niepozwalającymi na dobre wykształcenie nasion stanowi podstawę do dyskwalifikacji plantacji.
3. 7. Choroby i szkodniki:
1) len oleisty, len włóknisty:
a) występowanie roślin lnu porażonych przez pasmo lnu (Spharella linorum) powoduje dyskwalifikację plantacji,
b) dopuszczalny udział roślin porażonych na jednostkę kwalifikacyjną:
| – zgorzelą naczyniową (Fusarium ssp.) | – 1,8 rośliny, |
| – plamistością zgorzelową lnu (Colletotrichum linii) | – 1,8 rośliny, |
2) soja:
a) plantacja soi nie może być w większym stopniu porażona przez Diaporthe phaseolorum var. caulvora lub var. sojae, Phalophora gregata, Phytophtoraegasperma f sp. glycinea, lub Pseudomonas syringae cv. Glycinea,
b) silne porażenie przez choroby i szkodniki w stopniu powodującym pogorszenie jakości nasion stanowi podstawę do dyskwalifikacji plantacji.
4. Wymagania dotyczące jakości materiału siewnego:
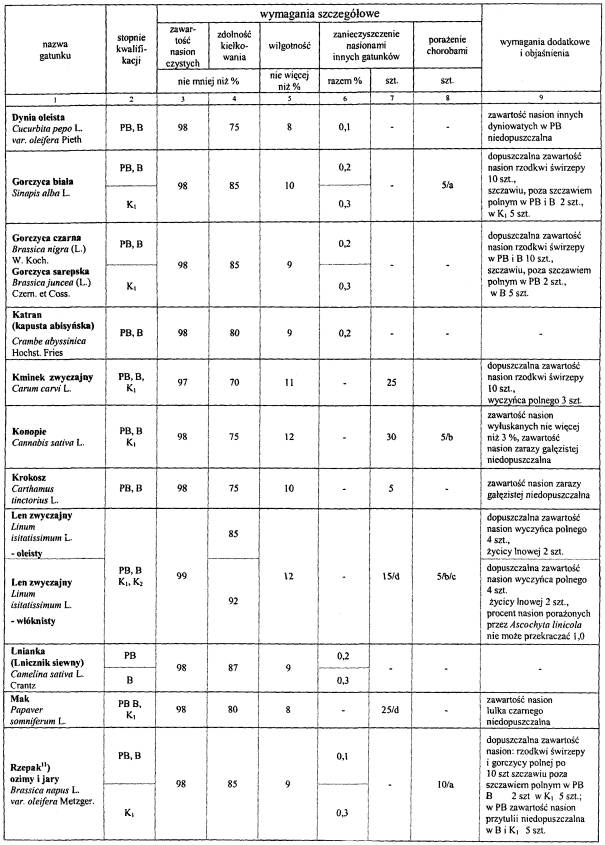
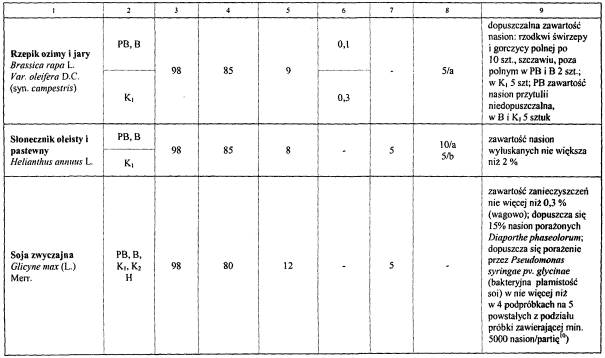
Objaśnienia
10) Gdy we wszystkich 5 podpróbkach stwierdzi się występowanie podejrzanych kolonii patogenu, można przeprowadzić ocenę z zastosowaniem odpowiednich testów biochemicznych, aby potwierdzić powyższe stwierdzenie. Określenie występowania bakteryjnej plamistości na nasionach soi nie musi być przeprowadzone, chyba że wystąpiły podejrzenia o ich występowanie.
11) Zawartość kwasu erukowego w oleju materiału siewnego niskoerukowych i podwójnie ulepszonych odmian rzepaku ozimego i jarego powinna wynosić nie więcej niż:
a) 0,5% w materiale siewnym zakwalifikowanym w stopniu PB,
b) 1,0% w materiale siewnym zakwalifikowanym w stopniu B i K1,
– zawartość glukozynolanów w całych nasionach podwójnie ulepszonych odmian rzepaku ozimego i jarego powinna wynosić nie więcej niż:
a) 13 mikromoli na gram w materiale siewnym zakwalifikowanym w stopniu PB,
b) 15 mikromoli na gram w materiale siewnym zakwalifikowanym w stopniu B i K1
a. Sklerocja lub ich fragmenty, w sztukach; choroba: zgnilizna twardzikowa (Sclerotinia sclerotiorum).
b. Liczba nasion porażonych, w procentach; choroba: szara pleśń (Botrytis cinerea).
c. Liczba nasion porażonych, w procentach; choroby: czerń krzyżowych (Alternaria ssp), zamieranie pędów (Ascochyta linicola syn. Phoma linicola) do 1%, plamistość zgorzelowa lnu (Colletotrichum lini), zgorzel naczyniowa (Fusarium ssp.).
d. Innych gatunków razem.
Uwaga:
Obecność kanianki, owsa głuchego i jego mieszańców jest niedopuszczalna.
VIII. Rośliny lekarskie i przyprawowe.
| 1. Stopnie kwalifikacji – materiał handlowy: | – H. |
2. Wymagania dotyczące jakości materiału siewnego:
| Lp. | nazwa gatunku | zawartość nasion czystych w % (m/m) nie mniej niż | dopuszczalna zawartość innych gatunków w % (m/m) nie więcej niż | zdolność kiełkowania w % (m/m) nie mniej niż | wilgotność w % (m/m) nie więcej niż |
| 1 | Arcydzięgiel litwor Archangelica officinalis Hoff. | 98 | 0,3 | 60 | 8 |
| 2 | Armica chamissa Arnica chamissonis Less. | 96 | 1 | 50 | 10 |
| 3 | Arnika wielkolistna Arnica filiosa Nutt. | 96 | 1 | 40 | 10 |
| 4 | Babka lancetowata Plantago lanceolata L | 97 | 1,5 | 75 | 10 |
| 5 | Babka plesznik Plantago psyllium L. | 98 | 0,7 | 75 | 10 |
| 6 | Bazylia pospolitaOcimum basilicum L. | 98 | 0,2 | 60 | 10 |
| 7 | Biedrzeniec anyż Pimpinella anisum L. | 98 | 0,5 | 60 | 10 |
| 8 | Biedrzeniec wielki Pimpinella major Huds. | 97 | 0,3 | 50 | 10 |
| 9 | Bieluń dziędzierzawa Datura stramonium L. | 98 | 0,2 | 65 | 11 |
| 10 | Bieluń indiański Datura innoxia Mill. | 97 | 0,2 | 60 do zdolności kiełkowania doliczyć 30% nasion niekiełkujących | 12 |
| 11 | Bławatek chaber Centaurea cyanus L. | 96 | 0,6 | 60 | 11 |
| 12 | Bukwica zwyczajna Betonica officinalis L. | 95 | 0,5 | 60 | 11 |
| 13 | Czarnuszka siewna Nigella sativa L. | 97 | 0,4 | 70 | 10 |
| 14 | Cząber ogrodowy Satureja hortensis L. | 97 | 0,8 | 65 | 10 |
| 15 | Doględka kalifornijska Grindelia rabusta Dun. | 97 | 0,6 | 70 | 10 |
| 16 | Drapacz lekarski Cnicus benedictus L. | 96 | 0,4 | 60 | 12 |
| 17 | Dziurawiec zwyczajny Hypencum perforatum L. | 97 | 0,4 | 70 | 10 |
| 18 | Fiolek polny Viola arvensis Afurr. | 97 | 0,6 | 60 | 10 |
| 19 | Fiolek trójbarwny Viola tricolor L. | 97 | 0,6 | 60 | 10 |
| 20 | Glistnik jaskółcze ziele Chelidonium majus L. | 98 | 0,5 | 60 | 10 |
| 21 | Hyzop lekarski Hyssopus officinalis L. | 97 | 1,2 | 65 | 10 |
| 22 | Jeżówka blada Echinacea pallida Nutt. | 97 | 1 | 55 | 11 |
| 23 | Jeżówka purpurowa Echinacea purpurea Mnch. | 97 | 1 | 60 | 11 |
| 24 | Karbieniec pospolity Lycopus europaeus L. | 96 | 1,2 | 60 | 12 |
| 25 | Kolendra siewna Coriandrnm sativum L. | 98 | 0,4 | 70 | 11 |
| 26 | Koper wioski Foeniculum capillaceum Gilib. | 97 | 0,5 | 60 | 11 |
| 27 | Kozieradka pospolita Trigonella foenum graecum L. | 97 | 1 | 80 | 11 |
| 28 | Kozłek lekarski; Valeriana officinalis L. | 96 | 0,3 | 65 | 8 |
| 29 | Krwawnik pospolity Achillea millefolium L. | 97 | 0,7 | 70 | 10 |
| 30 | Lawenda lekarska Lavendula officinalis Chaix. | 98 | 0,8 | 55 | 10 |
| 31 | Lebiodka pospolita Origanum vulgare L. | 97 | 0,5 | 70 | 10 |
| 32 | Lubczyk lekarski Levisticum officinale Koch. | 96 | 0,4 | 60 | 8 |
| 33 | Łopian większy Arctium lappa L. | 96 | 0,3 | 60 | 10 |
| 34 | Majeranek ogrodowy Origanum majorana L. | 97 | 0,6 | 70 | 10 |
| 35 | Malwa czarna Althea rosea L. var. nigra hort. | 97 | 0,2 | 60 | 12 |
| 36 | Marzanna barwierska Rubla tinctorum L. | 96 | 0,2 | 50 | 12 |
| 37 | Melisa lekarska Melissa officinalis L. | 97 | 1,2 | 70 | 11 |
| 38 | Mniszek pospolity Taraxacum officinale Web. | 96 | 0,3 | 60 | 10 |
| 39 | Mydlnica lekarska Saponaria officinalis L. | 97 | 0,3 | 55 | 12 |
| 40 | Naparstnica purpurowa Digitalis purpurea L. | 97 | 0,5 | 70 | 10 |
| 41 | Naparstnica wełnista Digitalis lanata Ehrh. | 97 | 0,5 | 70 | 10 |
| 42 | Ogórecznik lekarski Borago officinalis L. | 97 | 0,3 | 60 | 12 |
| 43 | Oman wielki lnula helenium L. | 95 | 0,4 | 65 | 10 |
| 44 | Ostropest plamisty Silybum marianum (L.) Gaertn. | 97 | 0,7 | 65 | 12 |
| 45 | Pieprzowiec roczny Capsicum annum L. | 98 | 0,2 | 70 | 10 |
| 46 | Pierwiosnka lekarska Primula officinalis Hill. | 97 | 0,6 | 60 | 10 |
| 47 | Pokrzyk wilcza jagoda Atropa belladonna L. | 97 | 0,2 | 60 | 9 |
| 48 | Prawoślaz lekarski Althea officinalis L. | 97 | 0,3 | 65 | 10 |
| 49 | Rozwar wielkokwiatowy Platycodon grandiflorum DC. | 97 | 0,3 | 70 | 10 |
| 50 | Rumianek pospolity Chamomilla recutita (L.) Rau. | 97 | 0,4 | 75 | 9 |
| 51 | Ruta zwyczajna Ruta graveolens L. | 97 | 0,3 | 60 | 10 |
| 52 | Rutwica lekarska Galega officinalis L. | 97 | 0,4 | 50 | 11 |
| 53 | Rzewień dłoniasty Rheum palmatum L. | 98 | 0,3 | 65 | 12 |
| 54 | Serdecznik pospolity Leonurus cardiaca L. | 97 | 1 | 65 | 10 |
| 55 | Siwiec żółty Glaucium flavum Cr | 98 | 0,5 | 50 | 10 |
| 56 | Stroiczka rozdęta Lobelia inflata L. | 96 | 0,2 | 60 | 8 |
| 57 | Szałwia lekarska Salvia officinalis L. | 98 | 0,3 | 70 | 10 |
| 58 | Szałwia muszkatołowa Salvia sclarea L. | 98 | 0,3 | 70 | 10 |
| 59 | Szanta zwyczajna Marrubium vulgare L. | 96 | 0,7 | 70 | 10 |
| 60 | Ślaz dziki Malva silvestris L. | 97 | 0,4 | 60 | 10 |
| 61 | Tymianek pospolity Thymus vulgaris L | 97 | 1,2 | 70 | 10 |
| 62 | Tysiącznik pospolity Centaurium umbellatum Gilib. | 95 | 0,2 | 60 | 8 |
| 63 | Wiesiołek dwuletni Oenothera biennis L. | 95 | 0,5 | 65 | 10 |
| 64 | Wiesiołek dziwny Oenothera paradoxa Hudziok | 95 | 0,5 | 60 | 10 |
| 65 | Złocień maruna Chrysanthemun parthenium Berh | 94 | 1 | 65 | 10 |
| 66 | Inne gatunki | 94 | 1 | 50 | 11 |
IX. Ziemniak.
1. Wymagania dotyczące wytwarzania kwalifikowanego materiału siewnego ziemniaka przy przeprowadzaniu oceny polowej:
1. 1. Jednostki kwalifikacyjne17).
Na plantacjach o powierzchni do 5 ha obowiązuje przeprowadzenie oceny szczegółowej co najmniej na 5 jednostkach kwalifikacyjnych, a na plantacjach o powierzchni powyżej 5 ha obowiązuje dodatkowo ocena jednej jednostki kwalifikacyjnej na każde rozpoczęte 5 ha. Czystość odmianowa plantacji, które mają być zakwalifikowane w stopniu superelity lub elity, musi być sprawdzona co najmniej na 10 jednostkach kwalifikacyjnych.
1. 2. Ocena stanu plantacji.
Na plantacjach obsadzonych materiałem przedbazowym i bazowym do zakwalifikowania w stopniu superelity obowiązują trzy oceny stanu plantacji, a na plantacjach pozostałych stopni kwalifikacji dwie oceny:
1) pierwsza w okresie, kiedy rośliny osiągną wysokość około 20 cm,
2) druga w okresie pełnego kwitnienia roślin,
3) trzecia w 2–3 tygodnie po terminie przeprowadzenia drugiej oceny, jednak nie później niż przed zakończeniem wegetacji (przed rozpoczęciem żółknięcia i zasychania liści).
Jeżeli na plantacji zamierza się przeprowadzić niszczenie naci, to trzecia ocena powinna być dokonana na kilka dni przed wykonaniem tego zabiegu. O zamierzonym terminie niszczenia naci producent obowiązany jest powiadomić kwalifikatora co najmniej z 7-dniowym wyprzedzeniem.
1. 3. Zmianowanie.
Plantacji nasiennych ziemniaka nie można zakładać na polu, na którym w ostatnich trzech latach uprawiano ziemniaki, tytoń lub pomidory.
1. 4. Izolacja przestrzenna32).
Od upraw tytoniu, pomidorów i niekwalifikowanych plantacji ziemniaka nie mniej niż:
| 1) dla materiału przedbazowego13) i bazowego14) | – 100 m, |
| 2) dla materiału kwalifikowanego15) | – 50 m. |
Izolacja przestrzenna może być zmniejszona do szerokości 2 redlin wolnych od ziemniaka, jeżeli z plantacją nasienną sąsiadują plantacje obsadzone kwalifikowanym materiałem ziemniaka co najmniej w klasie A.
1. 5. Czystość odmianowa:
1) na plantacjach nasiennych mogą występować rośliny innych odmian ziemniaka nie więcej jednak niż:
| a) dla materiału przedbazowego i bazowego | – 0,1% (1 roślina na 10 jednostek), |
| b) dla materiału kwalifikowanego | – 0,2% (1 roślina na 5 jednostek), |
| 2) liczba roślin niezachowująca cech charakterystycznych dla odmiany nie może przekraczać: | |
| a) dla materiału przedbazowego i bazowego | – 0,2% (1 roślina na 5 jednostek), |
| b) dla materiału kwalifikowanego | – 0,4% (2 rośliny na 5 jednostek). |
1. 6. Czystość gatunkowa.
Plantacja nasienna ziemniaka powinna być praktycznie wolna od roślin innych gatunków uprawnych.
1. 7. Zachwaszczenie.
Zachwaszczenie, niepozwalające na właściwy rozwój roślin ziemniaka bądź utrudniające ocenę ich zdrowotności, stanowi podstawę do dyskwalifikacji plantacji.
1. 8. Choroby i szkodniki:
1) występowanie organizmów szkodliwych podlegających obowiązkowi zwalczania jest niedopuszczalne i powoduje dyskwalifikację plantacji,
2) porażenie roślin ziemniaka przez inne choroby, np. zarazę ziemniaka, w stopniu uniemożliwiającym prawidłową ocenę porażenia roślin chorobami wirusowymi stanowi podstawę do dyskwalifikacji plantacji,
3) dopuszczalne porażenie roślin chorobami wirusowymi, grzybowymi i bakteryjnymi na iednostkę kwalifikacyjną podczas oceny stanu plantacji w ocenie polowej wynosi:
| Stopień kwalifikacji | Maksymalna liczba roślin z objawami chorób na jednostkę kwalifikacyjną | |||||
| wirusowych ogółem | w tym z objawami ciężkich schorzeń | zgorzeli naczyniowej | rizoktoniozy w silnym stopniu | czarnej nóżki w ocenie | ||
| I | II, III | |||||
| Superelita | 1 | 0,2 | 0 | 2 | 2 | 0,4 |
| Elita | 2 | 0,4 | 0 | 3 | 2 | 0,6 |
| Oryginał | 5 | 0,6 | 1 | 3 | 2 | 0,8 |
| Klasa A | 10 | 1,0 | 1 | 4 | 2 | 1,0 |
4) ciężkie choroby wirusowe:
a) porażenie wirusem PVY, niezależnie od charakteru objawów na roślinach (smugowatość, ostra mozaika, mozaika pomarszczona, kędzierzawka),
b) porażenie wirusem PLRV, niezależnie od charakteru objawów na roślinach (zwijanie dolnych liści z charakterystycznym rozjaśnieniem zieleni, zmiana pokroju rośliny, zahamowanie wzrostu i antocjanowe przebarwienie dolnych liści),
c) porażenie wirusem PVM – występujące w postaci zwijania się górnych liści, mozaiki, o ile tym objawom towarzyszy silna deformacja liści, smugi nekrotyczne lub skarlenie roślin,
5) lekkie choroby wirusowe – porażenia wirusowe inne niż te, o których mowa w pkt 4, a ponadto słabe mozaiki oraz miękkie zwijanie się górnych liści spowodowane wirusem M, bez większych zmian w pokroju rośliny,
6) rośliny porażone rizoktoniozą w silnym stopniu – rośliny z nekrozami obejmującymi co najmniej połowę podstawy łodygi, (występowanie opilśni łodygowej nie stanowi podstawy do uznania rośliny za porażoną w silnym stopniu),
7) rośliny porażone przez wirusy lub z objawami czarnej nóżki, pozostawione na plantacji po selekcji negatywnej, uznaje się za rośliny z ciężkimi chorobami,
8) pola, na których produkowane są sadzeniaki, powinny być wolne od cyst mątwika ziemniaczanego.
1. 9. Inne wymagania:
1) występowanie na roślinach ziemniaka innych szkodników (stonki ziemniaczanej) w nasileniu niepozwalającym na normalny rozwój roślin ziemniaka bądź uniemożliwiającym ocenę ich zdrowotności stanowi podstawę do dyskwalifikacji plantacji,
2) niewyrównanie roślin w silnym stopniu, a także występowanie pustych miejsc w ilości ponad 30% może stanowić podstawę do dyskwalifikacji plantacji,
3) wyraźnie opóźniona wegetacja roślin na plantacji w stosunku do przeciętnego stanu innych plantacji tej samej lub podobnych odmian w danym rejonie, spowodowana późnym terminem sadzenia, powoduje degradację sadzeniaków co najmniej o 1 stopień kwalifikacji lub może stanowić podstawę do dyskwalifikacji plantacji.
2. Wymagania dotyczące jakości materiału siewnego ziemniaka.
2. 1. Dopuszczalne porażenie wirusami w ocenie weryfikacyjnej dla poszczególnych stopni kwalifikacji:
| Stopień kwalifikacji | Ogółem wirusy [%] | W tym silne objawy chorobowe [%] |
| Superelita | 3 | 0,5 |
| Elita | 4 | 1,0 |
| Oryginał | 10 | 2,0 |
| Klasa A | 10 | 5,0 |
2. 2. Wymagania dotyczące kalibrażu bulw19):
| Cecha | Opis | |
| 1 | 2 | |
| Jakość sadzeniaków ziemniaka12) | Sadzeniaki ziemniaka powinny być dojrzałe, czyste, zdrowe, suche, nieuszkodzone, nienadmarznięte, nieporośnięte, o kształcie i zabarwieniu miąższu typowym dla odmiany; partia sadzeniaków18) powinna być jednolita pod względem wszystkich cech jakościowych | |
| Kalibraż (frakcja) sadzeniaków w mm | ||
| I | II | |
| Odmiany o bulwach okrągłych lub owalnych | 28¸45 | 45¸60 |
| Odmiany o bulwach podłużnych lub podłużno-owalnych | 25¸45 | 45¸55 |
Dopuszcza się, w przypadku określenia kontraktem, zastosowanie innego kalibrażu pod warunkiem, że maksymalne odchylenie wielkości bulw we frakcji nie przekroczy 20 mm przy zachowaniu podanych wyżej minimalnych wielkości bulw.
2. 3. Dopuszczalna tolerancja wad bulw ziemniaka:
| Lp. | Wyszczególnienia | Dopuszczalne wady, % wagowy, nie więcej niż |
| 1. | Zanieczyszczenia20) | 2 |
| 2. | Bulwy innych odmian: – w SE i E | niedopuszczalne |
| – w Oryg. I kl. A | 0,2 | |
| 3. | Bulwy o niewłaściwym kalibrażu | 3 |
| 4. | Wady wewnętrzne np. bulwy z objawami plamistości27) | 3 |
| 5. | Bulwy niedojrzałe) | 10 |
| 6. | Bulwy z objawami parcha prószystego25) w słabym* stopniu lub | 0,5 |
| ** wykazujące ospowatość26) w silnym stopniu | 2 | |
| 7. | Bulwy z objawami suchej lub mokrej zgnilizny30) (z wyjątkiem czynników dyskwalifikujących), porażone zarazą ziemniaka oraz nadmarznięte28) i zmarznięte29) | 1 |
| 8. | Wady zewnętrzne np. bulwy uszkodzone23) oraz o wadliwym kształcie22) | 3 |
| 9. | Bulwy porażone parchem zwykłym24) w silnym stopniu | 5 |
| 10. | Ogółem suma wad dla pozycji lp. 6, 7, 8, nie więcej niż: | 6 |
*Gdy łączna powierzchnia plam na bulwie wynosi więcej niż 1 cm2.
**Bulwy, na których porażenie przekracza łącznie powierzchnię 15%.
2. 4. Cechy dyskwalifikujące partię sadzeniaków ziemniaka:
1) zaparzenia31),
2) wystąpienie organizmów szkodliwych podlegających obowiązkowi zwalczania,
3) występowanie parcha prószystego (Spongospora subterranea) w silnym stopniu,
4) potraktowanie materiału siewnego ziemniaka środkami hamującymi kiełkowanie.
Objaśnienia:
12) Sadzeniaki ziemniaka – bulwy ziemniaka odpowiadające ustalonym standardom jakościowym, pochodzące z plantacji odpowiadającej określonym wymaganiom.
13) Sadzeniaki przedbazowe:
– minibulwy16) oraz pierwsze i drugie rozmnożenie polowe minibulw, spełniające wymagania minimum superelity,
– ostatnie rozmnożenie bulw w cyklu tradycyjnej hodowli zachowawczej objęte kontrolą Inspekcji Nasiennej spełniające wymagania nie niższe, niż przewidziane dla sadzeniaków w stopniu superelity.
14) Sadzeniaki bazowe – bulwy ziemniaka, które:
– zostały wyprodukowane zgodnie z przyjętą metodyką zachowania odmiany i zdrowotności,
– są przeznaczone głównie do produkcji sadzeniaków kwalifikowanych,
– spełniają minimalne warunki podane w „Wymaganiach" dla sadzeniaków kategorii bazowe,
– zostały uznane, w drodze badań urzędowych, za spełniające minimum z podanych wyżej warunków.
15) Sadzeniaki kwalifikowane – bulwy ziemniaka, które:
– zostały wyprodukowane z sadzeniaków bazowych lub na życzenie hodowcy,
– z sadzeniaków będących w kategorii ziemniaki przedbazowe,
– zostały wyprodukowane z sadzeniaków kwalifikowanych w stopniu oryginału,
– są przeznaczone głównie do produkcji ziemniaków innych niż sadzeniaki,
– spełniają minimalne warunki podane w „Wymaganiach" dla sadzeniaków kwalifikowanych,
– zostały uznane, w drodze badań urzędowych, za spełniające minimum z podanych wyżej warunków.
16) Minibulwy – bulwy wytwarzane z bezpośredniego rozmnożenia roślin wyhodowanych z kultur tkankowych z dokumentacją określającą ich pochodzenie, produkowane pod kontrolą Inspekcji Nasiennej.
17) Jednostka kwalifikacyjna – jest to powierzchnia kontrolna lub określona ilość roślin, wyznaczona losowo dla dokonania oceny: czystości odmianowej, określenia liczby roślin z objawami chorób lub porażonych przez szkodniki. Jednostką kwalifikacyjną na plantacjach nasiennych ziemniaka jest kolejnych 100 roślin w jednym rzędzie lub po 50 roślin w dwóch sąsiednich rzędach.
18) Partia ziemniaków – określona ilość sadzeniaków, nie więcej niż 25 ton jednej odmiany, tego samego kalibrażu i stopnia kwalifikacji, przedstawiona jednorazowo do oceny (dopuszcza się przekroczenie maksymalnej masy partii do 5%).
19) Kalibraż – określona kalibrownicą o boku oczka kwadratowego w milimetrach, dolna i górna granica średnic poprzecznych bulw w partii.
20) Zanieczyszczenia – substancje obce, organiczne i mineralne oraz części bulwy pozbawione oczek.
21) Bulwy niedojrzałe – bulwy, na których niezaschnięta skórka łuszczy się pod naciskiem palca lub przy ocieraniu o inne bulwy.
22) Bulwy o wadliwym kształcie:
a) zdeformowane – bulwy odbiegające wyraźnie od typu odmianowego oraz z nieregularnymi wgłębieniami i wypukłościami,
b) dzieciuchowate – bulwy z wtórnymi naroślami,
c) wrzecionowate – bulwy zakończone stożkowe przy stolonie.
23) Bulwy uszkodzone – bulwy uszkodzone mechanicznie lub przez szkodniki na łącznej powierzchni powyżej 2,5 cm2, lub na głębokości większej niż 0,5 cm oraz bulwy uszkodzone przez drutowce, jeśli liczba uszkodzeń przekracza 4 otwory, a ponadto bulwy z uszkodzonym oczkiem szczytowym, jeśli nawet inne uszkodzenia nie przekraczają wyżej wymienionych rozmiarów.
24) Bulwy porażone parchem zwykłym – Streptomyces scabies (Taxt) Waksm. et Henr. syn. Actinomyces scabies (Thax) Güss – bulwy, na których łączna powierzchnia plam jest większa niż 1/3 powierzchni bulwy.
25) Bulwy porażone parchem prószystym – Spongospora subterranea Wallr. /Johnson/:
a) w silnym stopniu – gdy łączna powierzchnia plam na bulwie wynosi więcej niż 1 cm2,
b) w słabym stopniu – gdy łączna powierzchnia plam na bulwie wynosi nie więcej niż 1 cm2.
26) Bulwy z objawami ospowatości – Rhizoctonia solani (Kühn) bulwy, na których porażenie przekracza łącznie powierzchnię 15%.
27) Bulwy z plamistością miąższu – bulwy z plamami miąższu na powierzchni większej niż 1/5 przekroju podłużnego.
2S) Bulwy nadmarznięte – bulwy uszkodzone przez niskie temperatury na powierzchni do 1/5 bulwy i nie głębiej niż 0,5 cm.
29) Bulwy zmarznięte – bulwy uszkodzone przez niskie temperatury na powierzchni większej niż 1/5 bulwy oraz głębiej niż 0,5 cm.
30) Bulwy z objawami zgnilizny – bulwy porażone w jakimkolwiek stopniu suchą zgnilizną – Fusarium sp. Alternaria sp., mokrą zgnilizną – Erwinia carotovora (Jones) Holand, Bacillus sp., Clostridium sp., Pseudomonas sp. oraz zarazą ziemniaka – Phytophthora infestans de Bary.
31) Zaparzenia – bulwy pozbawione tugoru, z oznakami więdnięcia, na przekroju z widocznym czerwienieniem miąższu rozciągającym się między powierzchnią bulwy a pierścieniem wiązek przewodzących, niekiedy sięgającym w głąb miąższu, a czasami z pękającym miąższem.
32) Jeżeli między plantacją nasienną a inną uprawą, od której obowiązuje izolacja, znajduje się naturalna osłona w postaci budynków, wzgórz lub lasu, stanowiąca dostateczną przeszkodę w przenoszeniu pyłku innych roślin lub zarodników chorób i przelotu owadów, izolacja może być zmniejszona o 1/3 minimalnej, wymaganej przepisami.
Załącznik nr 6
WYMAGANIA DOTYCZĄCE WYTWARZANIA KWALIFIKOWANEGO I STANDARDOWEGO MATERIAŁU SIEWNEGO, IZOLACJI PRZESTRZENNEJ OD INNYCH UPRAW, CZYSTOŚCI GATUNKOWEJ I ODMIANOWEJ, ZDROWOTNOŚCI ORAZ MAKSYMALNEJ ILOŚCI ROZMNOŻEŃ MATERIAŁÓW HODOWLANYCH, A W ZALEŻNOŚCI OD TEGO – STOPNI KWALIFIKACJI ORAZ JAKOŚCI MATERIAŁU SIEWNEGO ROŚLIN WARZYWNYCH
I. Rośliny kapustne i rzepowate.
1. Uprawa metodą tradycyjną:
1. 1. Przedmiot oceny:
1) odmiany ustalone – ocenie podlegają wysadki i plantacje nasienne kapusty głowiastej białej, kapusty głowiastej czerwonej, kapusty włoskiej, kapusty pekińskiej, kapusty brukselskiej, kalarepy, kalafiora, brokułu, jarmużu, rzodkiewki, rzodkwi, rzepy,
2) odmiany mieszańcowe F1 – ocenie podlegają plantacje, na których reprodukowane są:
a) nasiona komponentów rodzicielskich tego pokolenia, które jest używane do produkcji nasion odmian mieszańcowych F1 oraz mieszańców pojedynczych jako komponentów rodzicielskich używanych do wytwarzania odmian mieszańcowych F1,
b) nasiona odmian mieszańcowych F1.
1. 2. Ocena stanu plantacji:
1) dla roślin dwuletnich obowiązują trzy oceny:
a) pierwsza w okresie dojrzałości konsumpcyjnej,
b) druga przed wysadzeniem wysadek roślin dwuletnich: kapusty białej, kapusty czerwonej, kapusty brukselskiej, kapusty włoskiej, kalarepy, rzepy, rzodkwi,
c) trzecia w okresie kwitnienia i wiązania nasion,
2) dla roślin jednorocznych dwie oceny:
a) pierwsza w okresie dojrzałości konsumpcyjnej,
b) druga w pełni kwitnienia.
1. 3. Zmianowanie – plantacji nasiennych nie można zakładać na polu, na którym w poprzednich latach uprawiane były rośliny z tej samej rodziny:
1) dla roślin kapustnych – w ciągu ostatnich czterech lat,
2) dla roślin rzepowatych – w bezpośrednim przedplonie.
1. 4. Izolacja przestrzenna12) – od źródeł obcych pyłków zdolnych do spowodowania poważnej degradacji odmian gatunków kapustnych i rzepowatych oraz plantacji, na których występują pośpiechy:
| 1) dla nasion elitarnych | – 1000 m, |
| 2) dla nasion kwalifikowanych | – 600 m. |
1. 5. Czystość odmianowa – występowanie roślin innych odmian poszczególnych gatunków z rodziny krzyżowych
| 1) na plantacji elitarnej oraz plantacjach, na których produkuje | |
| się składniki rodzicielskie | – niedpuszczalne, |
| 2) na plantacji kwalifikowanej: | – 0,5 rośliny na jednostkę kwalifikacyjną, |
| a) podczas pierwszej oceny nie więcej niż | |
| b) podczas drugiej i trzeciej oceny | – niedopuszczalne. |
1. 6. Choroby i szkodniki – występowanie roślin porażonych czarną zgnilizną kapustnych, kiłą kapusty, suchą zgnilizną kapustnych lub czarną pierścieniową plamistością kapusty (TuMV – Tunip mosaic potyvirus) na jednostkę kwalifikacyjną dla każdej z tych chorób nie więcej niż 3 rośliny. Łącznie nie więcej niż 6 roślin na jednostkę kwalifikacyjną.
2. Uprawa metodą bezwysadkową1 roślin kapustnych.
Metodę bezwysadkową do produkcji nasion roślin kapustnych stosuje się przy rozmnażaniu nasion przedbazowych na bazowe.
2. 1. Obowiązują dwie oceny:
1) pierwsza – w fazie wegetatywnej (dla kapust późną jesienią, dla kalarepy wczesną wiosną),
2) druga – w okresie od kwitnienia roślin do dojrzewania nasion.
2. 2. Pozostałe wymagania jak przy metodzie tradycyjnej.
Objaśnienie:
1) – Nasiona wyprodukowane metodą bezwysadkową nie mogą być używane do dalszej reprodukcji.
II. Rośliny cebulowe.
1. Pierwszy rok uprawy – produkcja wysadek cebuli, pora, czosnku pospolitego.
1. 1. Przedmiot oceny – ocenie podlegają plantacje wysadek cebuli, pora oraz plantacje czosnku pospolitego do dalszej reprodukcji wegetatywnej.
1. 2. Ocena stanu plantacji – obowiązuje jedna ocena roślin cebuli i pora w końcowym okresie wegetacji przed załamaniem szczypioru i dwie oceny dla czosnku pospolitego:
1) pierwsza – w końcowym okresie wegetacji przed załamaniem szczypioru,
2) druga – ocena główek po wykopaniu i wysuszeniu.
1. 3. Zmianowanie – plantacji nasiennych roślin cebulowych nie można zakładać na polu, na którym w ciągu ostatnich czterech lat uprawiane były rośliny z tej samej rodziny.
1. 4. Izolacja przestrzenna12):
| 1) odległość plantacji wysadek od wszystkich stopni kwalifikacji cebuli i pora oraz innych | |
| upraw cebuli i pora z siewu lub rozsady nie mniejsza niż | – 2 m, |
| 2) odległość produkcji wysadek cebuli od plantacji cebuli nasiennej, upraw cebuli z | |
| dymki, od szalotki, czosnku i innych gatunków cebulowych rozmnażanych | |
| wegetatywnie nie mniejsza | – 500 m |
| niż ze względu na niebezpieczeństwo porażenia wysadek chorobami wirusowymi, | |
| 3) odległość uprawy kwalifikowanej czosnku pospolitego od innych upraw czosnku, | |
| cebuli nasiennej, szalotki i innych gatunków cebulowych nie mniejsza niż | – 500 m |
1. 5. Czystość odmianowa – występowanie na plantacji roślin innych odmian na jednostkę kwalifikacyjną nie więcej niż:
| 1) na plantacji elitarnej: | – 0,3 rośliny, |
| a) cebuli | |
| b) pora i czosnku pospolitego | – niedopuszczalne, |
| 2) na plantacji kwalifikowanej: | – 0,5 rośliny, |
| a) cebuli i czosnku pospolitego | |
| b) pora | – 3,0 rośliny. |
1. 6. Choroby i szkodniki:
1) cebula – występowanie niszczyka zjadliwego jest niedopuszczalne. Występowanie roślin porażonych żółtą karłowatością cebuli wywołanej wirusem OYDV (onion yellow dwarf potyvirus) lub mozaiką ogórka na jednostkę kwalifikacyjną łącznie nie więcej niż 5 roślin. Porażenie roślin cebuli przez inne choroby (szczególnie mączniaka rzekomego) i szkodniki powodujące pogorszenie wykształcenia bądź jakości wysadek stanowi podstawę do dyskwalifikacji i plantacji,
2) czosnek pospolity – występowanie roślin z objawami porażenia wirusem mozaiki czosnku OYDV, grzybami z grupy Fusarium sp. lub z grupy Penicillium sp. na jednostkę kwalifikacyjną dla wszystkich tych chorób łącznie nie więcej niż 5 roślin.
2. Ocena główek i ząbków czosnku pospolitego – ocenie podlegają główki czosnku po wykopaniu i wysuszeniu:
2. 1. Występowanie w partii czosnku:
1) główek nietypowych dla odmiany jest niedopuszczalne,
2) główek o masie mniejszej niż 30g i średnicy mniejszej niż 3 cm oraz ząbków o masie mniejszej niż 6g jest niedopuszczalne dla odmian zimowych,
3) główek o masie mniejszej niż 20g i średnicy mniejszej niż 2 cm oraz ząbków o masie mniejszej niż 4 g jest niedopuszczalne dla odmian letnich.
2. 2. Występowanie w partii czosnku główek zniekształconych, chorych, z uszkodzeniami mechanicznymi lub silnie spękanej łusce jest niedopuszczalne. Dopuszcza się niewielkie spękanie łuski okrywającej.
3. Drugi rok uprawy –produkcja nasienna cebuli i pora.
3. 1. Przedmiot oceny – ocenie podlegają wysadki cebuli i pora przed ich wysadzeniem w pole (na wiosnę) oraz plantacje nasienne.
3. 2. Ocena stanu plantacji:
1) pierwsza – na wiosnę przed wysadzeniem wysadek w pole,
2) druga – w okresie kwitnienia.
Ocena wysadek pora dotyczy roślin zimujących w gruncie w marcu lub kwietniu przed ich wysadzeniem.
3. 3. Zmianowanie – plantacji nasiennych roślin cebulowych nie można zakładać na polu, na którym w ciągu ostatnich czterech lat uprawiane były rośliny z tej samej rodziny.
3. 4. Izolacja przestrzenna12):
1) odległość plantacji nasiennej cebuli dla wszystkich stopni kwalifikacji od plantacji nasiennych:
| a) odmian o żółtej barwie łuski (typu Wolska) nie mniejsza niż | – 1000 m, |
| b) odmian o żółtej barwie łuski (typu Rijnsburger) oraz od odmian o czerwonej barwie łuski | |
| nie mniejsza niż | – 4500 m, |
| 2) odległość plantacji nasiennej pora od innych plantacji nasiennych pora dla wszystkich | |
| stopni kwalifikacji nie mniejsza niż | – 1000 m. |
3. 5. Czystość odmianowa:
1) występowanie wysadek innych odmian cebuli i pora jest niedopuszczalne,
2) występowanie wysadek cebul podwójnych, z wyrastającym szczypiorem i korzeniami, z łuską o nietypowej barwie dla danej odmiany jest niedopuszczalne.
3. 6. Choroby i szkodniki wysadek – występowanie cebul porażonych zgnilizną szyjki cebuli (Botrytis allii) i białą zgnilizną cebuli (Sclerotium cepivorum) oraz wirusem żółtej karłowatości cebuli (OYDV) na jednostkę kwalifikacyjną łącznie nie więcej niż 5 sztuk. Partia wysadek powinna być praktycznie wolna od cebul z objawami innych chorób i uszkodzeń mechanicznych.
3. 7. Zachwaszczenie – plantacje nasienne cebuli i pora powinny być praktycznie wolne od roślin następujących chwastów: czosnków, ostróżeczki, przytulii i rdestów.
3. 8. Choroby i szkodniki na plantacji nasiennej – występowanie na plantacji nasiennej cebuli roślin porażonych chorobami wirusowymi: żółtą karłowatością cebuli (OYDV)), mozaiką ogórka (Cucumis wirus}, żółtaczką astrów (Mycoplasma Ladila v. et Elford) jest niedopuszczalne. Porażenie roślin cebuli przez inne choroby, szczególnie mączniaka rzekomego, stanowi podstawę do dyskwalifikacji plantacji.
4. Cebula – odmiany mieszańcowe F1.
4. 1. Przedmiot oceny – ocenie podlegają:
1) plantacje wysadek komponentów rodzicielskich pokoleń stanowiących ostatni etap reprodukcji komponentów rodzicielskich przed ich bezpośrednim przekrzyźowaniem,
2) wysadki komponentów rodzicielskich służące do przekrzyżowania w celu uzyskania nasion odmian mieszańcowych F1 przed ich wysadzeniem.
4. 2. Ocena stanu plantacji.
W pierwszym i drugim roku uprawy cebuli obowiązują takie same oceny jak przy produkcji nasion cebuli odmian ustalonych oraz jedna dodatkowa ocena plantacji nasiennej na początku dojrzewania nasion.
Nieusunięcie roślin komponentu ojcowskiego (zapylacza) przed przystąpieniem do ostatniej oceny przy produkcji nasion odmian mieszańcowych F1 powoduje dyskwalifikację plantacji.
4. 3. Izolacja przestrzenna12) w pierwszym roku uprawy, przedplon w pierwszym i drugim roku uprawy, czystość odmianowa i gatunkowa w pierwszym roku, czystość gatunkowa w drugim roku uprawy (ocena wysadek), zachwaszczenie oraz występowanie chorób i szkodników takie same jak przy produkcji nasion odmian ustalonych.
4. 4. Izolacja przestrzenna12) w drugim roku uprawy:
| 1) odległość plantacji kwalifikowanej od plantacji nasiennej innych odmian i gatunków z grupy cebulowych, kwitnących w tym samym czasie – przy produkcji nasion komponentów rodzicielskich i odmian mieszańcowych F1 żółtołuskowych typu Wolska nie | |
| mniejsza niż, | – 1000 m |
| 2) odległość plantacji kwalifikowanej od plantacji nasiennej odmian żółtołuskowych (typu Rijnsburger) oraz plantacji nasiennej cebuli z czerwoną łuską | |
| nie mniejsza niż | – 4500 m. |
4. 5. Czystość odmianowa w drugim roku uprawy:
| 1) występowanie roślin nietypowych dla danego komponentu rodzicielskiego | ||
|
| – niedopuszczalne, | |
| 2) występowanie roślin męskopłodnych na jednostkę kwalifikacyjną w komponencie matecznym (linia A męskosterylna): | ||
| a) przy produkcji nasion komponentu matecznego nie więcej niż | – 5 roślin, | |
| b) przy produkcji nasion odmian mieszańcowych F1 nie więcej niż | – 10 roślin. | |
III. Rośliny korzeniowe.
1. Marchew jadalna, pietruszka korzeniowa, seler korzeniowy, pasternak – odmiany ustalone i mieszańcowe F1 uprawiane metodą tradycyjną.
1. 1. Pierwszy rok uprawy – produkcja wysadek.
1. 1. 1. Przedmiot oceny – ocenie podlegają plantacje, na których produkuje się:
1) wysadki odmian ustalonych marchwi, pietruszki, selera i pasternaku,
2) wysadki komponentów rodzicielskich pokolenia stanowiącego ostatni etap reprodukcji komponentów matecznych i ojcowskich,
3) wysadki komponentów rodzicielskich służące do przekrzyżowania w celu uzyskania nasion odmiany mieszańcowej F1.
1. 1. 2. Ocena stanu plantacji – obowiązuje jedna ocena we wrześniu przed wykopaniem wysadek.
1. 1. 3. Zmianowanie – plantacji nasiennych roślin korzeniowych nie można zakładać na polu, na którym w ciągu ostatnich czterech lat uprawiane były rośliny z tej samej rodziny.
1. 1. 4. Izolacja przestrzenna12) – odległość od innych plantacji kwalifikowanych roślin korzeniowych oraz niekwalifikowanych zasiewów tych roślin nie mniejsza niż – 5 m.
1. 1. 5. Czystość odmianowa – występowanie wysadek innych odmian i typów na jednostkę kwalifikacyjną plantacji ocenianej:
1) dla marchwi – niedopuszczalne,
2) dla pietruszki, pasternaku i selera – na plantacji elitarnej – niedopuszczalne,
3) dla pietruszki na plantacji kwalifikowanej – nie więcej niż 2 rośliny,
4) dla selera i pasternaku – nie więcej niż 0,5 rośliny.
1. 1. 6. Choroby i szkodniki – występowania czarnej zgnilizny marchwi (Alternaria radicind) oraz zgnilizny twardzikowej {Sclerotinia sclerotiorum) na korzeniach wysadek przed sadzeniem nie dopuszcza się.
1. 2. Drugi rok uprawy.
1. 2. 1. Przedmiot oceny.
Ocenie podlegają przed wysadzeniem wysadki marchwi, pietruszki, pasternaku i selera korzeniowego oraz plantacje nasienne:
1) odmian ustalonych marchwi, pietruszki, pasternaku i selera korzeniowego,
2) komponentów rodzicielskich tego pokolenia, które jest używane do produkcji nasion odmiany mieszańcowej F1,
3) odmian mieszańcowych F1,
1. 2. 2. Ocena stanu plantacji:
1) pierwsza – wysadek (przed ich wysadzeniem w pole) odmian ustalonych i komponentów rodzicielskich, które używane są do produkcji nasion odmian mieszańcowych F1,
2) druga – odmian ustalonych i komponentów rodzicielskich w okresie pełnego kwitnienia,
3) trzecia – w okresie dojrzewania nasion.
1. 2. 3. Zmianowanie jak w pierwszym roku uprawy.
1. 2. 4. Izolacja przestrzenna12) – odległość plantacji kwalifikowanej od plantacji nasiennej innej odmiany lub formy marchwi, pietruszki, selera i pasternaku w drugim roku uprawy, mogącej spowodować niepożądane przekrzyźowanie, nie mniejsza niż:
| 1) przy produkcji odmian ustalonych i mieszańcowych F1 marchwi i odmian ustalonych pietruszki i pasternaku oraz zasiewów roślin baldaszkowatych | |
| w których występują pośpiechy | – 500 m, |
| 2) przy produkcji nasion komponentów rodzicielskich marchwi wykorzystywanych do odmian mieszańcowych F1 i przy produkcji odmian | |
| ustalonych selera | – 1000 m. |
1. 2. 5. Czystość odmianowa:
1) występowanie wysadek innych odmian i typów oraz roślin innych odmian i typów gatunków korzeniowych zarówno na plantacji nasiennej odmian ustalonych marchwi, pietruszki, pasternaku i selera korzeniowego, jak i odmian mieszańcowych F1 marchwi jest niedopuszczalne,
2) przy produkcji odmian mieszańcowych F1 marchwi występowanie roślin częściowo męskopłodnych13) w linii męskosterylnej nie więcej niż 15%,
3) nieusunięcie linii zapylającej marchwi przy produkcji odmian mieszańcowych F1 przed ostatnią lustracją powoduje dyskwalifikację plantacji.
Objaśnienie:
13) Rośliny częściowo męskopłodne marchwi to takie, które posiadają wyraźnie zmniejszoną liczbę pylników w stosunku do roślin linii zapylającej.
Ocenę płodności przeprowadza się na baldachach pierwszego rzędu. Jeżeli na ocenianych baldachach pylniki występują sporadycznie, rośliny takie zalicza się do męskosterylnych.
1. 2. 6. Zachwaszczenie – występowanie na plantacji kwalifikowanej oraz w odległości do 200 m od tej plantacji marchwi dzikiej, kwitnącej w tym samym czasie co rośliny na plantacji kwalifikowanej, mogące spowodować niepożądane przekrzyźowanie oraz występowanie na polach bezpośrednio sąsiadujących z plantacją dużych ilości chwastów z rodziny baldaszkowatych kwitnących w tym samym czasie, stanowi podstawę do dyskwalifikacji plantacji.
1. 2. 7. Choroby i szkodniki – występowanie czarnej zgnilizny marchwi (Alternaria radicina) oraz zgnilizny twardzikowej (Sclerotinia sclerotiorum) na korzeniach marchwi przed sadzeniem jest niedopuszczalne. Występowanie alternariozy naci marchwi (Alternaria dauci), bakteriozy (Xanthomonas campestris pv.carotae), mozaiki marchwi (Carrot mottie dwarf virus), igiełkowatości liści marchwi (Carrot thin leaf virus) i zmieników (Ligus spp.) w ilości ponad 10% powoduje dyskwalifikacje plantacji.
1. 3. Uprawa metodą bezwysadkową1) marchwi, pietruszki i selera korzeniowego. Metodę bezwysadkową do produkcji nasion roślin korzeniowych można stosować tylko przy rozmnażaniu nasion przedbazowych na bazowe odmian ustalonych oraz przy produkcji nasion odmian mieszańcowych F1 marchwi.
1. 3. 1. Ocena stanu plantacji – obowiązują dwie oceny:
1) dla marchwi:
a) odmiany ustalone:
– pierwsza – w okresie formowania pędów kwiatostanowych,
– druga – w okresie od kwitnienia roślin do dojrzewania nasion,
b) odmiany mieszańcowe F1:
– pierwsza – w okresie pełnego kwitnienia baldachów pierwszego rzędu,
– druga – w okresie dojrzewania nasion.
2) dla pietruszki i selera korzeniowego w okresie od kwitnienia roślin do dojrzewania nasion.
Pozostałe zasady jak przy uprawie metodą tradycyjną.
Uwaga:
Stwierdzenie występowania na plantacji wad niedopuszczalnych, niezależnie od tego czy ujawniono je przy badaniach jednostek kwalifikacyjnych, czy w jakimkolwiek innym miejscu, dyskwalifikuje plantację.
2. Burak ćwikłowy – odmiany ustalone.
2. 1. Pierwszy rok uprawy – produkcja wysadek.
2. 1. 1. Ocena stanu plantacji – obowiązuje jedna lustracja jesienią przed zbiorem korzeni.
2. 1. 2. Zmianowanie – plantacji nasiennych roślin korzeniowych nie można zakładać na polu, na którym w ciągu ostatnich czterech lat uprawiane były rośliny z tej samej rodziny.
2. 1. 3. Izolacja przestrzenna12) – odległość dla wszystkich stopni kwalifikacji od upraw wszystkich gatunków uprawnych buraka nie mniejsza niż – 200 m. Izolacja ta może być zmniejszona do 2 m, jeżeli sąsiadujące uprawy buraka są praktycznie wolne od chorób i szkodników.
2. 1. 4. Czystość odmianowa – występowanie wysadek innych odmian buraka ćwikłowego:
| 1) na plantacjach elitarnych | – niedopuszczalne, |
| 2) na plantacjach kwalifikowanych nie więcej niż | – 0,2 rośliny. |
2. 1. 5. Choroby i szkodniki – występowanie skośnika buraka powoduje dyskwalifikację plantacji.
2. 2. Drugi rok uprawy – produkcja nasion.
2. 2. 1. Przedmiot oceny:
1) wysadek przed sadzeniem na wiosnę,
2) plantacji nasiennej.
2. 2. 2. Ocena stanu plantacji – obowiązują dwie oceny:
1) pierwsza – wiosną, przed wysadzeniem wysadek,
2) druga – plantacji nasiennej, w okresie od kwitnienia roślin do początku dojrzewania nasion.
2. 2. 3. Zmianowanie jak w pierwszym roku uprawy.
2. 2. 4. Izolacja przestrzenna12) – odległość od jakichkolwiek źródeł pyłku z rodzaju Beta:
| 1) dla nasion elitarnych | – 1000 m, |
| 2) dla nasion kwalifikowanych | – 600 m. |
2. 2. 5. Choroby i szkodniki – jak w pierwszym roku uprawy.
2. 3. Odmiany mieszańcowe F1.
2. 3. 1. Przedmiot oceny – ocenie podlegają:
1) w pierwszym roku uprawy:
a) plantacje, na których produkuje się wysadki komponentów rodzicielskich pokolenia stanowiącego ostatni etap reprodukcji komponentów matecznych i ojcowskich przed ich bezpośrednim przekrzyźowaniem,
b) wysadki komponentów rodzicielskich stanowiące komponenty do przekrzyżowania w celu uzyskania nasion odmiany mieszańcowej F1,
2) w drugim roku uprawy:
a) plantacje, na których produkuje się nasiona form rodzicielskich pokolenia używanego do produkcji nasion odmiany mieszańcowej F1,
b) plantacje, na których produkuje się nasiona odmian mieszańcowych F1.
2. 3. 2. Ocena stanu plantacji:
1) w pierwszym roku uprawy – jesienią przed zbiorem korzeni,
2) w drugim roku uprawy:
a) pierwsza – wysadek przed wysadzeniem,
b) druga – w okresie pełnego kwitnienia roślin,
c) trzecia – w okresie dojrzewania nasion.
2. 3. 3. Czystość odmianowa:
1) występowanie na plantacji w pierwszym roku uprawy oraz w wysadkach komponentów rodzicielskich przed sadzeniem na wiosnę innych odmian i typów użytkowych
|
| buraka | – niedopuszczalne, |
| 2) występowanie innych odmian i typów użytkowych buraka w produkcji nasion odmian mieszańcowych Fi nie więcej niż | – 1%, | |
3) przy produkcji nasion dopuszczalna liczba roślin męskopłodnych (pylących):
a) w komponencie matecznym (linii męskosterylnej) używanych do produkcji nasion odmian mieszańcowych F1
|
| nie więcej niż | –10%, |
| b) w odmianach mieszańcowych F1 nie więcej niż | –15%. | |
Nieusunięcie linii zapylającej buraka ćwikłowego przed ostatnią lustracją powoduje dyskwalifikację plantacji.
2. 3. 4. Zmianowanie jak dla odmian ustalonych.
2. 3. 5. Izolacja przestrzenna12):
1) w pierwszym roku uprawy taka sama, jak przy produkcji nasion odmian ustalonych,
2) w drugim roku uprawy odległość plantacji ocenianej od plantacji nasiennej innej odmiany lub innego komponentu rodzicielskiego oraz od plantacji i zasiewów innych gatunków uprawnych buraka mogących spowodować przekrzyźowanie:
a) przy produkcji nasion komponentu rodzicielskiego i nasion odmiany mieszańcowej F1
| nie mniejsza niż | – 3000 m, |
b) od zasiewów buraka ćwikłowego, pastewnego lub cukrowego, na których mogą wystąpić pośpiechy,
| nie mniejsza niż | – 1000 m. |
3. Chrzan.
3. 1. Przedmiot oceny.
Ocenie podlegają plantacje rozmnoźeniowe chrzanu, na których produkowane są sadzonki.
3. 2. Ocena stanu plantacji – obowiązują dwie oceny:
1) pierwsza w pełni okresu wegetacji roślin,
2) druga wiosną przed wprowadzeniem sadzonek do obrotu.
3. 3. Zmianowanie – plantacji nasiennych nie można zakładać na polu , na którym w ciągu ostatnich trzech lat uprawiane były rośliny z tej samej rodziny.
3. 4. Izolacja przestrzenna12) – odległość plantacji od upraw innych typów lub odmian chrzanu oraz upraw roślin krzyżowych nie mniejsza niż:
| 1) dla plantacji elitarnych | – 300 m, |
| 2) dla plantacji kwalifikowanych | – 100 m. |
3. 5. Czystość odmianowa – występowanie innych typów i odmian chrzanu na jednostkę kwalifikacyjną:
| 1) dla plantacji elitarnych | – niedopuszczalne |
| 2) dla plantacji kwalifikowanych | – nie więcej niż 1 roślina |
4. Skorzonera.
4. 1. Pierwszy rok uprawy – produkcja wysadek.
4. 1. 1. Ocena stanu plantacji – obowiązuje jedna ocena przed zbiorem wysadek.
4. 1. 2. Zmianowanie jak dla innych roślin korzeniowych.
4. 1. 3. Izolacja przestrzenna12) – odległość od plantacji wysadek i zasiewów innych odmian skorzonery lub innych roślin korzeniowych nie mniejsza niż 2 m.
4. 1. 4. Czystość odmianowa – występowanie roślin innych odmian skorzonery na jednostkę kwalifikacyjną:
1) na plantacji elitarnej – niedopuszczalne,
2) na plantacji kwalifikowanej – nie więcej niż 1 roślina.
4. 2. Drugi rok uprawy – produkcja nasion.
4. 2. 1. Ocena stanu plantacji – obowiązuje jedna ocena w okresie kwitnienia roślin.
4. 2. 2. Zmianowanie jak w pierwszym roku uprawy.
4. 2. 3. Izolacja przestrzenna12) – odległość dla wszystkich stopni kwalifikacji od plantacji nasiennej innych odmian skorzonery nie mniejsza niż 300 m.
4. 2. 4. Czystość odmianowa – występowanie roślin innych odmian skorzonery jest niedopuszczalne.
4. 2. 5. Zachwaszczenie – plantacja skorzonery powinna być praktycznie wolna od roślin następujących chwastów: mleczu polnego, ostrożenia lancetowatego, komosy białej i rdestów.
IV. Rośliny dyniowate.
1. Ogórek, melon, kawon, dynia olbrzymia, dynia zwyczajna – odmiany ustalone.
1. 1. Przedmiot kwalifikacji – plantacje nasienne ogórka, melona, kawona, dyni olbrzymiej, dyni zwyczajnej (kabaczek, cukinia, patison, dynia makaronowa, dynia bezłupinowa).
1. 2. Ocena stanu plantacji:
1) ogórek, melon i kawon – obowiązują dwie oceny:
a) pierwsza – w okresie kwitnienia i zawiązywania pierwszych owoców,
b) druga – w okresie dojrzewania nasienników przed zbiorem,
2) dynia olbrzymia i dynia zwyczajna – obowiązuje jedna ocena w okresie dojrzałości konsumpcyjnej owoców.
1. 3. Zmianowanie – plantacji nasiennych nie można zakładać na polu, na którym w ciągu ostatnich dwóch lat uprawiane były rośliny z tej samej rodziny.
1. 4. Izolacja przestrzenna12) – odległość od plantacji i zasiewów wszystkich stopni kwalifikacji nie mniejsza niż:
| 1) dla odmian ogórka | – 500 m, |
| 2) dla odmian melona, kawona, dyni olbrzymiej i zwyczajnej | – 1000 m. |
Odmiany botaniczne, takie jak: kabaczek, cukinia, patison, dynia makaronowa czy dynia bezłupinowa, krzyżujące się ze sobą, nie mogą być reprodukowane obok siebie. Dynia zwyczajna może być natomiast uprawiana obok dyni olbrzymiej, ponieważ te dwa gatunki nie krzyżują się w warunkach naturalnych – niezbędna odległość chroniąca przed mechanicznym zamieszaniem nie mniejsza niż 5 m.
1. 5. Czystość odmianowa:
1) ogórek, dynia olbrzymia i dynia zwyczajna – występowanie roślin innych odmian jest niedopuszczalne2),
2) melon i kawon – występowanie roślin innych odmian we wszystkich stopniach kwalifikacji jest niedopuszczalne.
1. 6. Czystość gatunkowa:
1) ogórek – nie określa się wymagań,
2) melon i kawon – plantacja powinna być praktycznie wolna od innych gatunków uprawnych,
3) dynia olbrzymia i dynia zwyczajna – występowanie na plantacji innych odmian i form botanicznych jest niedopuszczalne.
1. 7. Choroby i szkodniki:
1) ogórek – roślin porażonych kanciastą plamistością nie więcej niż 20%,
2) melon i kawon – występowanie roślin melona z objawami porażenia mączniakiem rzekomym, mączniakiem prawdziwym lub chorobami wywołanymi przez grzyby glebowe z rodzaju Fusarium sp. na jednostkę kwalifikacyjną łącznie dla tych chorób nie więcej niż 10 roślin.
Silne porażenie roślin dyniowatych przez choroby wirusowe, parcha dyniowatych, antraknozę, mączniaka rzekomego i mączniaka prawdziwego, powodujące istotne pogorszenie jakości produkowanych nasion, może być przyczyną dyskwalifikacji plantacji.
2. Ogórek – odmiany mieszańcowe F1
2. 1. Przedmiot oceny – ocenie podlegają plantacje nasienne, na których produkuje się:
1) nasiona komponentów rodzicielskich tego pokolenia, które jest używane do produkcji nasion odmian mieszańcowych F1,
2) nasion odmian mieszańcowych F1,
3) nasion zapylacza do nasion odmian mieszańcowych.
2. 2. Ocena stanu plantacji – obowiązują dwie oceny:
1) pierwsza – w pełni kwitnienia pędu głównego, ale po uformowaniu się pierwszego owocu w celu stwierdzenia przede wszystkim tożsamości płci komponentów rodzicielskich,
2) druga – w okresie dojrzewania nasienników.
Nieusunięcie roślin linii zapylającej przed przystąpieniem do drugiej lustracji powoduje dyskwalifikację plantacji.
W uprawach pod osłonami przed wysadzeniem roślin konieczna jest wymiana podłoża lub jego odkażenie.
2. 3. Zmianowanie jak dla odmian ustalonych:
2. 4. Izolacja przestrzenna12):
1) przy produkcji pod osłonami produkcja każdej formy rodzicielskiej oraz każdej odmiany mieszańcowej F1 musi być prowadzona w oddzielnej szklarni lub tunelu foliowym z zaizolowanymi otworami,
2) przy produkcji polowej:
a) odległość plantacji, na której produkuje się nasiona komponentu rodzicielskiego od zasiewów innej odmiany lub formy ogórka niż ta, której pyłkiem mają być zapylone rośliny na kwalifikowanej plantacji
| nie mniejsza niż | –1000 m, |
b) odległość plantacji, na której produkuje się nasiona odmiany mieszańcowej F1, od zasiewów odmiany lub formy ogórka innej niż komponent ojcowski
| nie mniejsza niż | – 1000 m, |
c) odległość plantacji, na której produkuje się nasiona odmiany mieszańcowej F1, od zasiewów odmiany lub formy ogórka takiej samej jak komponent ojcowski
| nie mniejsza niż | – 100 m, |
d) odległość plantacji, na której produkuje się nasiona odmiany mieszańcowej F1, od plantacji innej odmiany, na której produkuje się nasiona odmiany mieszańcowej F1 przy użyciu tego samego komponentu ojcowskiego,
| nie mniejsza niż | – 200 m, |
e) przy produkcji nasion mieszańca F1 i reprodukcji komponentu matecznego za pomocą linii dopełniającej (hermafrodytycznej) odległość pomiędzy komponentami rodzicielskimi chroniąca przed mechanicznym zamieszaniem nie może być mniejsza niż podwójna odległość między rzędami matecznego komponentu,
f) odległość plantacji, na której produkuje się nasiona komponenta ojcowskiego (drugi rok reprodukcji) służące do dosypania do nasion odmiany mieszańcowej od zasiewów innej odmiany lub komponentu rodzicielskiego ogórka niż ta, której pyłkiem mogą być zapylane rośliny na kwalifikowanej plantacji,
| nie mniejsza niż | – 1000 m. |
2. 5. Czystość odmianowa:
1) przy produkcji komponentów rodzicielskich występowanie roślin innych odmian i form
| nietypowych ogórka | – niedopuszczalne, |
2) roślin typowo jednopiennych3) bądź hermafrodytycznych w formie matecznej nie może być więcej niż:
| a) u odmian typu sałatkowego | – 3%, |
| b) u odmian typu konserwowego | – 5%, |
3) przy produkcji nasion odmiany mieszańcowej F1 występowanie roślin innych odmian i form nietypowych ogórka:
| a) w komponencie matecznym | – niedopuszczalne, |
| b) w komponencie ojcowskim nie więcej niż | – 0,5 rośliny, |
4) roślin typowo jednopiennych3) bądź hermafrodytycznych w komponencie matecznym nie może być więcej niż:
| a) u odmian typu sałatkowego | – 8%, |
| b) u odmian typu konserwowego | – 10%. |
2. 6. Choroby i szkodniki.
Silne porażenie roślin ogórka przez kanciastą plamistość, parcha dyniowatych, antraknozę, mączniaka rzekomego i mączniaka prawdziwego oraz choroby wirusowe zwłaszcza wirusem zielonej mozaiki ogórka (YGMMV – cucumber mottie mosaik tobamovirus), powodujące istotne pogorszenie jakości produkowanych nasion, może być przyczyną dyskwalifikacji plantacji.
3. Melon i kawon - odmiany mieszańcowe F1.
3. 1. Przedmiot oceny – ocenie podlegają plantacje nasienne, na których produkowane są nasiona mieszańca F1.
3. 2. Ocena stanu plantacji – obowiązują dwie oceny:
1) pierwsza – w pełni kwitnienia roślin (około 15 lipca) w celu sprawdzenia typu kwiatów na roślinach rodzicielskich. Na komponencie matecznym zapylanym przez pszczoły, po zastosowaniu ETEFONU mogą być tylko kwiaty żeńskie. Po zakończonym okresie zapylenia wszystkie nowe zawiązki (powstałe z samozapylenia) powinny być usunięte,
2) druga – w okresie dojrzewania nasienników.
Nieusunięcie zawiązków powstałych na komponencie matecznym w wyniku samozapylenia oraz owoców z roślin komponenta ojcowskiego przed przystąpieniem do drugiej lustracji powoduje dyskwalifikację plantacji.
3. 3. Zmianowanie jak dla odmian ustalonych.
3. 4. Izolacja przestrzenna12):
1) w uprawie polowej odległość od plantacji i zasiewów innych odmian
| nie mniejsza niż | – 1000 m, |
2) produkcja nasion odmiany mieszańcowej pod osłonami musi być prowadzona w oddzielnej szklarni lub tunelu foliowym z zaizolowanymi otworami (siatką nieprzepuszczająca owadów zapylających).
Objaśnienia:
2) – Stwierdzenie występowania na plantacji innej odmiany, niezależnie od tego, czy ujawniono ją przy badaniu jednostek kwalifikacyjnych, czy w jakimkolwiek innym miejscu, dyskwalifikuje plantacje.
3) – Roślina typowo jednopienna to taka roślina, która na pędzie głównym do 10 węzła wytwarza najczęściej same kwiaty męskie, a w następnych węzłach na zmianę występują kwiaty męskie z żeńskimi do końca wegetacji. Na pędach bocznych kwiaty żeńskie występują częściej niż na pędzie głównym. Do roślin jednopiennych nie należy zaliczać takich roślin, na których występują nieliczne kwiaty męskie przy ciągłym tworzeniu się kwiatów żeńskich na kolejnych węzłach.
3. 5. Czystość odmianowa – przy produkcji nasion odmiany mieszańcowej F1 występowanie roślin innych odmian bądź linii jest niedopuszczalne.
4. Dynia olbrzymia, dynia zwyczajna (kabaczek, cukinia, patison, dynia makaronowa, dynia bezłupinowa) – odmiany mieszańcowe F1.
4. 1. Przedmiot oceny – ocenie podlegają plantacje nasienne, na których produkowane są:
1) nasiona pokoleń komponentów rodzicielskich używanych do produkcji nasion odmian mieszańcowych F1,
2) nasiona odmian mieszańcowych F1.
4. 2. Ocena stanu plantacji – obowiązują dwie oceny:
1) pierwsza – w pełni kwitnienia roślin (około 15 lipca) w celu sprawdzenia typu kwiatów na roślinach rodzicielskich. Na komponencie matecznym zapylanym przez pszczoły mogą być tylko kwiaty żeńskie. Po zakończonym okresie zapylenia wszystkie nowe zawiązki (powstałe z samozapylenia) powinny być usunięte,
2) druga – w okresie dojrzewania nasienników. Nieusunięcie zawiązków powstałych na komponencie matecznym w wyniku samozapylenia oraz owoców z roślin komponenta ojcowskiego przed przystąpieniem do drugiej lustracji powoduje dyskwalifikację plantacji.
4. 3. Zmianowanie jak u innych roślin dyniowatych.
4. 4. Izolacja przestrzenna12):
1) odległość plantacji nasiennych poszczególnych mieszańców od zasiewów innych odmian
| nie mniejsza niż | – 1000 m, |
2) produkcja nasion mieszańca pod osłonami musi być prowadzona w oddzielnej szklarni lub tunelu foliowym z zaizolowanymi otworami (siatką nieprzepuszczająca owadów zapylających).
4. 5. Czystość odmianowa – przy produkcji nasion odmian mieszańcowych F1 występowanie roślin innych odmian bądź linii komponentu matecznego i ojcowskiego jest niedopuszczalne.
V. Warzywa psiankowate.
1. Pomidor, miechunka pomidorowa i papryka – odmiany ustalone.
1. 1. Ocena stanu plantacji – obowiązujące oceny dla:
1) pomidora:
a) pierwsza – w okresie kwitnienia,
b) druga – w okresie dojrzewania owoców ze środkowych gron,
2) papryki i miechunki pomidorowej – jedna w okresie dojrzewania owoców.
1. 2. Zmianowanie – plantacji nasiennych roślin psiankowatych nie można zakładać na polu, na którym w bezpośrednim przedplonie uprawiane były rośliny z tej rodziny.
1. 3. Izolacja przestrzenna12) – odległość od innych zasiewów odmian pomidora, miechunki i papryki oraz upraw ziemniaka nie mniejsza niż 50 m.
1. 4. Czystość odmianowa dla pomidora, miechunki i papryki – występowanie roślin innych odmian pomidora i papryki na jednostkę kwalifikacyjną we wszystkich stopniach kwalifikacji jest niedopuszczalne.
1. 5. Zachwaszczenie:
1) plantacja pomidora, miechunki i papryki powinna być praktycznie wolna od następujących chwastów: lulka czarnego, bielunia dziędzierzawy, psianki czarnej,
2) plantacja papryki i miechunki od gwiazdnicy pospolitej.
1. 6. Choroby i szkodniki:
1) pomidor:
a) występowanie żółtego liściozwoju pomidora (TLCV – tomato leav curl gemini virus) i raka bakteryjnego pomidora (Corynebacterium michiganensis) – niedopuszczalne,
b) silne porażenie roślin mozaiką pomidora (ToMV – tomato mosaic tobamovirus), bakteryjną cętkowatością pomidora (Pseudomonas syringae pv. tomato), bakteryjną zgnilizną rdzenia (Pseudomonas corugata), śluzakiem (Pseudomonas solanacearum), alternariozami (Alternaria solani i Altemrnia alternari), mątwikiem ziemniaczanym (Globodera rostochiensis) i innymi chorobami oraz szkodnikami powodującymi gorsze wykształcenie owoców stanowi podstawę do dyskwalifikacji plantacji,
2) miechunka – plantacja powinna być praktycznie wolna od roślin z objawami porażenia wirusem mozaiki miechunki,
3) papryka – plantacja powinna być praktycznie wolna od roślin z objawami porażenia przez czarną plamistość bakteryjną (Xantomonas vesicatoria), wirus mozaiki papryki, fuzariozy i szarej pleśni.
2. Pomidor i papryka – odmiany mieszańcowe F1
2. 1. Przedmiot oceny – ocenie podlegają plantacje nasienne, na których produkuje się:
1) nasiona komponentów rodzicielskich pokolenia stanowiącego ostatni etap reprodukcji komponentów matecznych i ojcowskich przed ich bezpośrednim przekrzyżowaniem,
2) nasiona odmian mieszańcowych F1
2. 2. Ocena stanu plantacji:
1) dla pomidora:
a) pierwsza – w okresie pełni kwitnienia,
b) druga – w okresie pełnej dojrzałości owoców ze środkowych gron,
2) dla papryki – jedna w okresie dojrzewania owoców.
2. 3. Izolacja przestrzenna12):
1) w uprawach polowych – odległość plantacji nasiennych poszczególnych mieszańców lub komponentów rodzicielskich:
a) pomidora od upraw roślin z rodziny psiankowatych
|
| nie mniejsza niż | – 50 m, |
| b) papryki od innych odmian nie mniejsza niż | – 400 m, | |
2) w uprawach pod osłonami – produkcja nasion poszczególnych mieszańców, jak również produkcja nasion komponentów rodzicielskich pomidora i papryki powinna być prowadzona w oddzielnych szklarniach, tunelach lub wydzielonych za pomocą osłon częściach szklarni.
2. 4. Czystość odmianowa:
1) występowanie roślin innych odmian i linii pomidora i papryki w każdym komponencie rodzicielskim jest niedopuszczalne,
2) dla pomidora – występowanie roślin zapylonych wsobnie w komponencie matecznym przy produkcji nasion mieszańcowych:
a) przy zastosowaniu komponentu matecznego płodnego
| nie więcej niż | – 2%4), |
b) przy zastosowaniu komponentu z cechą funkcjonalnej męskiej sterylności, roślin z kwiatami zapylonymi wsobnie co najmniej na dwóch kolejnych gronach
| nie więcej niż | – 5%5). |
Dla określenia występowania roślin zapylonych wsobnie oznaczone przez kwalifikatora rośliny nie mogą być zapylane sztucznie.
2. 5. Zachwaszczenie – występowanie chwastów takich jak: lulek czarny, bieluń dziędzierzawa, psianka czarna i gwiazdnica pospolita jest niedopuszczalne.
2. 6. Choroby i szkodniki – obowiązują zasady kwalifikacji jak przy uprawie odmian ustalonych dla pomidora i papryki.
Objaśnienia:
4) W matecznym składniku pomidora, płodnym sprawdzenia, czy nastąpiło wsobne zapylenie kwiatów, dokonuje się w okresie usuwania pylników. Stwierdzenie rozchylenia działek kielicha ponad 90 stopni na którymkolwiek ze sprawdzanych kwiatów i zmiana barwy płatków korony na ciemnożółtą oznacza, że nastąpiło zapylenie wsobne.
5) W matecznym składniku pomidora z cechą funkcjonalnej męskiej sterylności dla określenia występowania roślin zapylonych wsobnie kwalifikator podczas pierwszej lustracji wybiera losowo 1% roślin, które odpowiednio oznacza. Podczas drugiej lustracji na tych roślinach dokonuje obliczenia roślin z kwiatami zapylonymi wsobnie.
VI. Warzywa strączkowe.
1. Groch, fasola, bób.
1. 1. Ocena stanu plantacji – obowiązuje jedna ocena plantacji dla:
1) grochu i bobu – w okresie od kwitnienia do zawiązywania strąków,
2) fasoli zwyczajnej i wielokwiatowej – w okresie pełnego wykształcania strąków ale przed ich zasychaniem.
1. 2. Zmianowanie – plantacji nasiennych roślin strączkowych nie można zakładać na polu, na którym w ciągu ostatnich czterech lat uprawiane były rośliny z tej samej rodziny.
1. 3. Izolacja przestrzenna12):
1) odległość wszystkich stopni kwalifikacji od plantacji i zasiewów innych odmian i typów grochu oraz od innych gatunków roślin strączkowych
| nie mniejsza niż | – 2 m, |
2) odległość wszystkich stopni kwalifikacji od plantacji i zasiewów innych odmian fasoli zwykłej
| nie mniejsza niż | – 50 m, |
3) odległość od plantacji i zasiewów fasoli wielokwiatowej
| nie mniejsza niż | – 200 m, |
4) odległość wszystkich stopni kwalifikacji od plantacji i zasiewów innych odmian fasoli
| wielokwiatowej nie mniejsza niż | – 500 m, |
5) odległość od plantacji nasiennych innych odmian i niekwalifikowanych zasiewów bobu oraz
| od upraw bobiku nie mniejsza niż | – 500 m. |
1. 4. Czystość odmianowa – występowanie innych odmian i typów na jednostkę kwalifikacyjną:
| 1) na plantacji elitarnej grochu, fasoli i bobu | – niedopuszczalne, |
| 2) na plantacji kwalifikowanej grochu i bobu | – nie więcej niż 0,3 rośliny, |
| 3) na plantacji kwalifikowanej fasoli | – nie więcej niż 0,1 rośliny. |
1. 5. Choroby i szkodniki – występowanie ostrej bakteriozy fasoli (Xantomonas campestris pv. phaseoli) jest niedopuszczalne.
VII. Warzywa liściowe.
1. Sałata (głowiasta, liściowa, łodygowa, rzymska) – uprawa metodą tradycyjną.
1. 1. Ocena stanu plantacji – obowiązują dwie oceny:
1) pierwsza – w okresie dojrzałości konsumpcyjnej,
2) druga – w okresie dojrzewania nasion.
1. 2. Zmianowanie – plantacji nasiennych roślin liściowych nie można zakładać na polu, na którym w ciągu ostatnich dwóch lat uprawiane były rośliny z tej samej rodziny, z wyjątkiem selera liściowego i pietruszki liściowej, które można uprawiać na tym samym polu co pięć lat.
1. 3. Izolacja przestrzenna12) – odległość od źródeł obcych pyłków zdolnych do spowodowania poważnej degeneracji odmian:
| 1) dla nasion elitarnych | – 500 m, |
| 2) dla nasion kwalifikowanych | – 300 m. |
1. 4. Czystość odmianowa – występowanie roślin innych odmian i typów sałaty na jednostkę kwalifikacyjną:
| 1) na plantacji elitarnej | – niedopuszczalne, |
2) na plantacji kwalifikowanej – podczas pierwszej lustracji
| nie więcej niż | – 0,5 rośliny, |
| 3) podczas drugiej lustracji | – niedopuszczalne. |
1. 5. Zachwaszczenie – plantacja sałaty powinna być praktycznie wolna od następujących chwastów: cykorii podróżnika, mniszka pospolitego, łoczygi pospolitej, komosy białej i przymiotna kanadyjskiego.
2. Sałata głowiasta – uprawa metodą bezgłówkową.
Metodę bezgłówkową do produkcji nasion sałaty stosuje się przy uprawach kwalifikowanych.
2. 1. Ocena stanu plantacji – jedna ocena w okresie dojrzewania nasion. W celu sprawdzenia wyrównania i tożsamości odmiany obowiązuje założenie jednego poletka kontrolnego o powierzchni 10 m2 z każdej wysianej partii nasion elitarnych. Poletko powinno być zlokalizowane w jednym gospodarstwie na terenie działalności wojewódzkiego inspektoratu Inspekcji Nasiennej, gdzie prowadzona jest kwalifikacja plantacji pochodzących z tych partii.
2. 2. Czystość odmianowa – występowanie roślin innych odmian sałaty na jednostkę kwalifikacyjną w
| materiale elitarnym. | – niedopuszczalne |
Pozostałe zalecenia jak przy uprawie metodą tradycyjną.
3. Cykoria liściowa (sałatowa).
3. 1. Pierwszy rok uprawy – produkcja wysadek.
3.1. 1. Ocena stanu plantacji – obowiązuje jedna ocena przed wykopaniem wysadek.
3. 1. 2. Izolacja przestrzenna12) – odległość od plantacji i zasiewów innych odmian cykorii i innych gatunków roślin korzeniowych nie mniejsza niż 2 m.
3. 1. 3. Czystość odmianowa – występowanie na plantacji roślin innych odmian cykorii sałatowej jest niedopuszczalne.
3. 2. Drugi rok uprawy – produkcja nasion.
3. 2. 1. Ocena stanu plantacji – obowiązuje jedna ocena w okresie od kwitnienia roślin do początku dojrzewania nasion.
3. 2. 2. Izolacja przestrzenna12) – odległość nie mniejsza niż:
| 1) od plantacji wysadek innych odmian cykorii | – 1000 m, |
2) od wszystkich zasiewów cykorii w pierwszym roku, na których występują pośpiechy mogące
| spowodować niepożądane zapylenie (zgodność okresu kwitnienia) | – 500 m, |
3) od nieusuniętych przed kwitnieniem wysadek
| roślin dziko rosnącej cykorii | – 50 m. |
3. 2. 3. Czystość odmianowa – występowanie na plantacji kwalifikowanej roślin innych odmian cykorii sałatowej jest niedopuszczalne.
3. 2. 4. Zachwaszczenie – występowanie roślin dziko rosnącej cykorii jest niedopuszczalne.
4. Szpinak – odmiany ustalone.
4. 1. Ocena stanu plantacji – obowiązują dwie oceny:
1) pierwsza – w okresie dojrzałości konsumpcyjnej,
2) druga – w okresie dojrzewania nasion.
4. 2. Izolacja przestrzenna12) – odległość plantacji dla wszystkich stopni kwalifikacji:
| 1) od innych odmian szpinaku nie mniejsza niż | – 700 m, |
2) od plantacji nasiennych buraka i szpinaku uprawianego na konsumpcję
| nie mniejsza niż | – 100 m. |
4. 3. Czystość odmianowa – występowanie roślin innych odmian szpinaku na jednostkę kwalifikacyjną:
| 1) na plantacjach elitarnych | – niedopuszczalne, |
| 2) na plantacjach kwalifikowanych nie więcej niż | – 0,5 rośliny. |
5. Szpinak6) – odmiany mieszańcowe F1.
5. 1. Przedmiot oceny – ocenie podlegają plantacje, na których produkuje się:
1) nasiona komponentów rodzicielskich tego pokolenia, które jest używane do produkcji nasion odmiany mieszańcowej F1,
2) nasiona odmian mieszańcowych F1.
5. 2. Ocena stanu plantacji – obowiązują dwie oceny:
1) pierwsza – na początku wybijania pędów kwiatostanowych,
2) druga – w okresie dojrzewania nasion.
5. 3. Izolacja przestrzenna12) – odległość plantacji kwalifikowanej od zasiewów innej odmiany lub formy szpinaku niż ta, której pyłkiem mają być zapylane rośliny kwalifikowanej plantacji, jest:
1) przy produkcji nasion komponentów rodzicielskich
| nie mniejsza niż | – 3000 m, |
2) przy produkcji nasion mieszańca F1
| nie mniejsza niż | – 1000 m. |
5. 4. Czystość odmianowa – przy produkcji nasion:
1) składnika matecznego:
a) jeśli jest nią linia dwupienna – roślin jednopiennych
| nie może być więcej niż | – 5%, |
b) jeśli jest nią linia żeńska, jednopienna – roślin jednopiennych
|
| nie może być więcej niż | – 10%, |
| |||||
|
| c) obecność roślin męskich | – niedopuszczalna, |
| |||||
| 2) | przy produkcji nasion jednopiennego składnika ojcowskiego roślin czysto męskich nie więcej niż | – 1%, | ||||||
| 3) | przy produkcji nasion odmian mieszańcowych F1 w składniku matecznym i ojcowskim roślin czysto męskich nie więcej niż | – 1%, | ||||||
| 4) | występowanie roślin innych odmian oraz roślin wyraźnie różniących się pod względem cech morfologicznych | – niedopuszczalne. | ||||||
Objaśnienia:
6) Rozróżnia się następujące typy roślin szpinaku:
– rośliny żeńskie, jednopienne o żeńskim typie wzrostu, wytwarzające pod koniec kwitnienia kwiaty męskie,
– rośliny żeńskie wytwarzające w 100% kwiaty żeńskie,
– rośliny jednopienne o zbliżonym stosunku liczby kwiatów męskich do żeńskich jak 1:1,
– rośliny męskie wytwarzające w 100% kwiaty męskie.
Uwagi:
Linia dwupienna – linia składająca się z roślin żeńskich i męskich.
Linia żeńska, jednopienna – linia składająca się w przeważającej części z roślin żeńskich, jednopiennych,
Linia jednopienna – linia składająca się z roślin jednopiennych.
6. Koper.
6. 1. Ocena stanu plantacji – obowiązuje jedna ocena w okresie od kwitnienia do zawiązywania nasion.
6. 2. Izolacja przestrzenna12) – odległość dla wszystkich stopni kwalifikacji od plantacji innych odmian i zasiewów kopru ogrodowego nie mniejsza niż 1000 m.
6. 3. Czystość odmianowa – występowanie roślin innych odmian kopru na jednostkę kwalifikacyjną:
| 1) na plantacjach elitarnych | – niedopuszczalne, |
| 2) na plantacjach kwalifikowanych nie więcej niż | – 1 roślina. |
7. Seler liściowy.
Obowiązują takie same zasady oceny plantacji jak przy produkcji nasion selera korzeniowego w drugim roku uprawy.
7. 1. Ocena stanu plantacji – obowiązują dwie oceny stanu plantacji:
1) pierwsza – w okresie dojrzałości konsumpcyjnej roślin,
2) druga – w okresie kwitnienia.
8. Pietruszka liściowa.
8. 1. Pierwszy rok uprawy.
8. 1. 1. Przedmiot oceny – ocenie podlegają rośliny w okresie wegetacji.
8. 1. 2. Ocena stanu plantacji – jedna ocena od momentu tworzenia się rozety.
8. 1. 3. Izolacja przestrzenna12) – odległość od innych odmian i roślin korzeniowych i baldaszkowatych nie mniejsza niż 2 m.
8. 1. 4. Czystość odmianowa – występowanie innych odmian pietruszki liściowej na jednostkę kwalifikacyjną:
| 1) na plantacji elitarnej | – niedopuszczalne, |
| 2) na plantacji kwalifikowanej i standardowej nie więcej niż | – 1 roślina. |
8. 1. 5. Czystość gatunkowa – występowanie roślin pietruszki korzeniowej, pasternaku i innych roślin z rodziny baldaszkowatych jest niedopuszczalne.
8. 2. Drugi rok uprawy.
8. 2. 1. Przedmiot oceny – ocenie podlegają plantacje nasienne pietruszki liściowej.
8. 2. 2. Ocena stanu plantacji – jedna ocena w okresie kwitnienia.
8. 2. 3. Izolacja przestrzenna12):
| 1) | odległość plantacji od innej odmiany pietruszki liściowej, korzeniowej i pasternaku nie może być mniejsza niż | – 500 m, |
| 2) | odległość od innej odmiany pietruszki liściowej o innym typie liści nie może być mniejsza niż | – 800 m. |
8.2. 4. Czystość odmianowa i gatunkowa – występowanie innych odmian pietruszki liściowej, pietruszki korzeniowej i pasternaku jest niedopuszczalne.
VIII. Warzywa różne.
1. Rabarbar (rzewień).
1. 1. Ocena stanu plantacji – obowiązuje jedna ocena w każdym roku plonowania, w okresie pełnego wykształcenia ogonków liściowych.
1. 2. Zmianowanie – plantacji nasiennych nie można zakładać na polu, na którym w bezpośrednim przedplonie uprawiane były rośliny z tej samej rodziny.
1. 3. Izolacja przestrzenna12) – odległość od plantacji pierwszorocznej nie mniejsza niż 4 m.
1. 4. Czystość odmianowa – występowanie roślin innych odmian rabarbaru jest niedopuszczalne.
1. 5. Choroby i szkodniki – silne porażenie roślin rabarbaru przez choroby, zwłaszcza mozaikę wirusową liści rabarbaru lub szkodniki w stopniu powodującym niewłaściwy rozwój roślin rabarbaru stanowi podstawę do dyskwalifikacji plantacji.
1. 6. Inne wymagania
1) puste miejsca – występowanie na plantacji rabarbaru pustych miejsc w ilości powyżej 30% w pierwszym roku uprawy i powyżej 50% w drugim i dalszych powoduje dyskwalifikację plantacji,
2) rośliny słabe – plantacja rabarbaru powinna być praktycznie wolna od roślin opóźnionych w rozwoju wegetatywnym.
2. Kukurydza pękająca, kukurydza cukrowa – odmiany ustalone.
2. 1. Ocena stanu plantacji – obowiązuje jedna ocena w okresie dojrzewania nasion.
2. 2. Zmianowanie – plantacji nasiennych nie można zakładać na polu, na którym w bezpośrednim przedplonie uprawiane były rośliny z tej samej rodziny.
2. 3. Izolacja przestrzenna12) – odległość dla wszystkich stopni kwalifikacji:
| 1) od zasiewów innej odmiany lub formy kukurydzy | |
| nie mniejsza niż | – 500 m, |
| 2) od plantacji kukurydzy tej samej odmiany lecz silnie wyrodzonej | |
| nie mniejsza niż | – 300 m. |
2. 4. Czystość odmianowa – występowanie roślin innych odmian kukurydzy cukrowej na jednostkę kwalifikacyjną:
| 1) na plantacjach elitarnych | – niedopuszczalne, |
| 2) na plantacjach kwalifikowanych nie więcej niż | – 0,1 rośliny. |
3. Kukurydza pękająca, kukurydza cukrowa – odmiany mieszańcowe F1.
3. 1. Przedmiot kwalifikacji – kwalifikacji podlegają plantacje nasienne, na których produkuje się:
1) nasiona komponentów rodzicielskich tego pokolenia, które jest używane bezpośrednio do produkcji nasion odmian mieszańcowych,
2) nasiona odmian mieszańcowych F1.
3. 2. Ocena stanu plantacji:
1) przy kwalifikacji komponentów rodzicielskich obowiązują dwie oceny:
a) pierwsza – w pełni kwitnienia kwiatostanów żeńskich,
b) druga – w okresie dojrzałości nasion,
2) przy kwalifikacji nasion odmian mieszańcowych F1 obowiązują cztery oceny:
a) w okresie kwitnienia kwiatostanów żeńskich komponentu matecznego trzy oceny, przy czym pierwsza ocena powinna być wykonana, gdy około dziesięć procent roślin matecznych ma widoczne słupki, dwie następne w odstępach parodniowych od dnia pierwszej oceny,
b) czwarta w okresie dojrzewania nasion.
3. 3. Izolacja przestrzenna12) – odległość od zasiewów innej odmiany lub komponenta rodzicielskiego kukurydzy niż ten, którego pyłkiem mają być zapylane rośliny na kwalifikowanej plantacji, nie mniejsza niż 500 m.
3. 4. Czystość odmianowa:
1) występowanie roślin innych odmian i form nietypowych:
| a) przy produkcji nasion składników rodzicielskich | – niedopuszczalne, | |
| b) przy produkcji nasion odmian mieszańcowych F1 | ||
| nie więcej niż | – 0,3 rośliny na jednostkę kwalifikacyjną. | |
Nieusunięcie roślin linii zapylającej (przy produkcji nasion odmian mieszańcowych F1) przed ostatnią lustracją powoduje dyskwalifikację plantacji.
2) występowanie wiech pylących w rzędach składnika matecznego przy produkcji:
| a) nasion komponentów rodzicielskich | – niedopuszczalne, |
| b) nasion odmian mieszańcowych F1 | – 1,5 rośliny na jednostkę łącznie podczas trzech lustracji. |
3. 5. Choroby i szkodniki – występowanie na plantacji roślin porażonych zgnilizną fuzaryjną kolb lub uwiądem bakteryjnym kukurydzy stanowi podstawę do dyskwalifikacji plantacji.
IX. Stopnie kwalifikacji materiału siewnego roślin warzywnych.
1. Odmiany ustalone:
| 1) materiał elitarny: |
| |
|
| a) nasiona przedbazowe | – PB, |
|
| b) nasiona bazowe | – B, |
| 2) materiał kwalifikowany | – K, | |
| 3) materiał standardowy | – St, | |
| 4) materiał handlowy | – H. | |
2. Odmiany mieszańcowe:
| 1) materiał elitarny | – Ro, Rm, |
| 2) materiał kwalifikowany | – F1. |
X. Nazwy gatunków roślin warzywnych:
| 1. Allium cepa L. | – cebula, |
| 2. Allium fistulosum L. | – cebula siedmiolatka, |
| 3. Allium porrum L. | – por, |
| 4. Allium x proliferum (Moench) Schrad ex Willd. | – cebula wielopiętrowa, |
| 5. Allium schoenoprasum L. | – szczypiorek, |
| 6. Anethum graveolens L. | – koper ogrodowy, |
| 7. Anthriscus cerefolium (L.) Hoffm. | – trybuła ogrodowa, |
| 8. Apium graveolens L. var. dulce (Mill.) Pers. | – seler liściowy, |
| 9. Apium graveolens L. var. rapaceum (Mill.) Gaud. | – seler korzeniowy, |
| 10. Asparagus officinalis L. | – szparag, |
| 11. Beta vulgaris L. var. vulgaris | – burak ćwikłowy, |
| 12. Beta vulgaris L. var. conditiva Alef.L. | – burak liściowy, |
| 13. Brassica napus L. emend.Metzg.ssp.rapifera | – brukiew, |
| 14. Brassica oleracea L. convar. caulocarpa (DC) Alef. var. gongylodes L. | – kalarepa, |
| 15. Brassica oleracea L. convar, acephala (DC) Alef. var. sabellica L. | – jarmuż, |
| 16. Brassica oleracea L. convar. botrytis (L.) Alef. var. botrytis L. | – kalafior, |
| 17. Brassica oleracea L. convar. botrytis (L.) Alef. var. italica Plenck | – brokuł, |
| 18. Brassica oleracea L. convar. capitata (L.) Alef. var. alba DC | – kapusta biała, |
| 19. Brassica oleracea L. convar.capitata (L.) Alef. var. rubra DC | – kapusta czerwona, |
| 20. Brassica oleracea L. convar.capitata (L.) Alef. var. sabauda L. | – kapusta włoska, |
| 21. Brassica oleracea L. convar. fruticosa (Metzg.) | – kapusta brukselska, |
| Alef. var.gemmifera DC | |
| 22. Brassica rapa L.emend.Metzg. ssp.pekinensis (Lour.) Haneit | – kapusta pekińska, |
| 23. Brassica rapa L.emend Metzg.ssp. rapa | – rzepa jadalna, |
| 24. Capsicum annuum L. | – papryka, |
| 25. Cicer arietinum L. | – ciecierzyca pospolita, |
| 26. Cichorium endivia L. | – endywia, |
| 27. Cichorium intybus L | – cykoria liściowa, |
| 28. Citrullus Matsum lanatus.et Nakai ssp. vulgaris Fursa var. vulgaris | – kawon |
| 29. Cucumis melo L. | – melon |
| 30. Cucumis sativus L. | – ogórek |
| 31. Cucurbita ficifolia C. Bouche | – dynia figolistna, |
| 32. Cucurbita maxima Duch. | – dynia olbrzymia, |
| 33. Cucurbita moschata Duch, ex Poir. | – dynia piżmowa, |
| 34. Cucurbita pepo L. | – dynia zwyczajna, |
| 35. Cynara cardunculus L. | – kard, |
| 36. Cynara scolymus L. | – karczoch, |
| 37. Daucus carota L. ssp.sativus (Hoffm.) | – marchew jadalna, |
| 38. Foeniculum vulgare Mill.ssp. vulgare var. azoricum | – koper włoski, fenkuł, |
| 39. Fragaria vesca L. | – poziomka, |
| 40. Helianthus annuus L. | – słonecznik ogrodowy, |
| 41. Lactuca sativa L. | – sałaty, |
| 42. Lathyrus sativus L. | – lędźwian siewny, |
| 43. Lens culinaris Medikus | – soczewica jadalna, |
| 44. Lepidium sativum L. | – rzeżucha, |
| 45. Lycopersicon esculentum Mill. | – pomidor, |
| 46. Pastinaca sativa L. | – pasternak, |
| 47. Petroselinum crispum (Mill.) Nym. convar. crispum | – pietruszka liściowa, |
| 48. Petroselinum crispum (Mill.) Nym. convar. radicosum | – pietruszka korzeniowa, |
| 49. Phaseolus coccineus L. | – fasola wielokwiatowa, |
| 50. Phaseolus vulgaris L. | – fasola zwykła, |
| 51. Physalis ixocarpa Brot. ex. Hornem. | – miechunka pomidorowa, |
| 52. Physalis peruviana L. | – rodzynek brazylij ski, |
| 53. Pisum sativum L.(partim) | – groch siewny |
| 54. Portulaca oleracea L. | – portulaka warzywna, |
| 55. Raphanus sativus L. var. niger (Mill.) | – rzodkiew, |
| 56. Raphanus sativus L. var. sativus | – rzodkiewka, |
| 57. Rheum rhabarbarum L. | – rabarbar, |
| 58. Rumex acetosa L. | – szczaw zwyczajny, |
| 59. Scorzonera hispanica L. | – skorzonera, |
| 60. Solanum melongena L. | – oberżyna, |
| 61. Spinacia oleracea L. | – szpinak, |
| 62. Tetragonia expansa Thumb. ex. Murr O. Kuntze | – szpinak nowozelandzki, |
| 63. Tragopogon porrifolius L. | – salsefia, |
| 64. Valerianella locusta (L.) Laterrade | – roszponka warzywna, |
| 65. Vicia faba L. var. major Harz | – bób, |
| 66. Zea mays L. convar. saccharata Koern. | – kukurydza cukrowa, |
| 67. Zea mays L. convar. microsperma Koern. | – kukurydza pękająca. |
XI. Wymagania jakościowe dla wszystkich kategorii materiału siewnego roślin warzywnych:
1. Nasiona powinny posiadać dostateczną tożsamość odmianową i czystość odmianową.
2. Choroby i organizmy szkodliwe, które obniżają przydatność nasion, powinny być na najniższym możliwym poziomie.
3. Nasiona powinny spełniać następujące wymagania:
| Gatunek | Minimal-na czystość analityczna (% wag.) | Maksymal-na zawartość nasion innych gatunków (% wag.) | Minimalna zdolność kiełkowania czystych nasion lub kłębków (w %) | Wilgotność nie więcej niż % | Inne wymagania – nie więcej niż | |
| Nasiona w opakowaniach | ||||||
| Nie-herme-tyc-nych | Herme-tycznych | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Allium cepa | 99 | 0,3 | 75 | 10 | 7 | 3% porośniętych |
| Allium fistulosum Cebula siedmiolatka | 98 | 0,3 | 70 | 10 | 10 | 4% porośniętych |
| Allium x proliferum Cebula wielopiętrowa | 65 | |||||
| Allium porrum | ||||||
| Allium schocnoprasum Szczypiorek | 0,2 | 70 | ||||
| Anethum graveolens Koper ogrodowy | 97 | 0,5 | 55 | 10 | 7 | – |
| Antriscus cerefolium Trybuła ogrodowa | 96 | 1 | 70 | 10 | 10 | – |
| Apium grayeolens Seler liściowy i korzeniowy | 97 | 0,5 | 70 | 9 | 9 | – |
| Asparagus officinalis Szparag | 99 | 0,1 | 70 | 11 | 11 | – |
| Beta vulgaris | 98 | 0,3 | 70 | 13 | 8 | – |
| Brassica napus L | 99 | 0,2 | 70 | 9 | 6 | 4% nasion o pęknietej okrywie |
| Brassica oleracea L. ssp.: Kalarepa, jarmuż, kalafior, brokuł | 99 | 0,2 | 75 | 9 | 6 | |
| Brassica oleracea L. Kapusta biała, czerwona, włoska, brukselska | 99 | 0,2 | 80 | 9 | 6 | |
| Brassica pekinensis Kapusta pekińska | 97 | 0,2 | 75 | 9 | 6 | |
| Brassica rapa Rzepa jadalna | 98 | 0,2 | 80 | 9 | 6 | |
| Capsicum annuum Patryka | 98 | 0,1 | 75 | 10 | 10 | – |
| Cicer arietinum Ciecierzyca pospolita | 98 | – | 80 | 15 | – | – |
| Cichorium endivia Endywia | 95 | 0,3 | 65 | 12 | 12 | – |
| Cichorium intybus Cykoria liściowa | 95 | 0,3 | 65 | 11 | 11 | – |
| Cichorium intybus Cykoria przemysłowa | 97 | 1 | 80 | 11 | 11 | – |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Citrullus lanatus | 99 | 0,1 | 75 | 12 | 6 | – |
| Cucumis melo | 99 | 0,1 | 75 | 12 | 6 | – |
| Cucumis sativus Ogórek | 99 | 0,1 | 80 | 9 | 6 | – |
| Cucurbita ficifolia | 99 | 0,1 | 75 | 11 | 6 | – |
| Cucurbita maxima Dynia olbrzymia | 99 | 0.1 | 80 | 11 | 6 | – |
| Cucurbita moschata Dynia piżmowa | 99 | 0,1 | 75 | 11 | 6 | – |
| Cucurbita pepo | 99 | 0,1 | 75 | 11 | 6 | – |
| Cynara cardunculus Kard | 98 | 0,1 | 65 | 12 | 12 | – |
| Cynara scolymus Karczoch | 98 | 0,5 | 65 | 12 | 12 | – |
| Daucus carota Marchew jadalna | 957) | 0,7 | 65 | 10 | 7 | 15%8) nasion porażonych |
| Foenicum vulgare Koper włoski (fenkuł) | 96 | 1 | 70 | 10 | 7 | – |
| Fragaria vesca Poziomka | 95 | 0,1 | 50 | 9 | 9 | – |
| Helianthus annuus Słonecznik ogrodowy | 98 | 0,3 | 80 | 11 | 11 | – |
| Lactuca sativa | 97 | 0,3 | 75 | 9 | 4–6 | – |
| Lathyrus sativus Lędźwian siewny | 98 | 0,3 | 80 | 15 | 15 | – |
| Lens culinaris Soczewica jadalna | 98 | 0,3 | 80 | 12 | 12 | – |
| Lepidium sativum Rzeżucha | 98 | 0,3 | 80 | 10 | 6 | – |
| Lycopersicon lycopersicum Pomidor | 98 | 0,2 | 75 | 9 | 7 | – |
| Pastinaca sativa Pasternak | 97 | 0,5 | 70 | 10 | 10 | – |
| Petroselinum crispum Pietruszka korzeniowa i liściowa | 97 | 0,5 | 65 | 10 | 7 | – |
| Phaseolus coccineus Fasola wielokwiatowa | 99 | 0,1 | 80 | 17 | 5–8 | 8%9) nasion porażonych oraz 17% łącznie nasion z uszkodzeniami i nakłuciami |
| Phaseolus vulgaris Fasola zwykła drobno- i średnionasienna | 99 | 0,1 | 80 | 15 | ||
| Phaseolus vulgaris Fasola zwykła grubonasienna | 99 | 0,1 | 75 | 16 | ||
| Physalis ixocarpa Miechunka pomidorowa | 98 | 0,2 | 65 | 9 | 9 | – |
| Physalis peruviana Rodzynek brazylijski | 97 | 0,1 | 50 | 12 | 12 | – |
| Pisum sativum | 99 | 0,1 | 80 | 14 | 5–8 | 8%10) nasion porażonych oraz 10% nasion uszkodzonych |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Portulaca oleracea Portulaka warzywna | 95 | 0,3 | 70 | 9 | 9 | – |
| Raphanus sativus Rzodkiew, rzodkiewka | 98 | 0,2 | 70 | 9 | 6 | 8% nasion uszkodzonych |
| Rheum rabarbarum Rabarbar | 96 | 0,5 | 60 | 12 | 12 | – |
| Rumex acetosa Szczaw zwyczajny | 96 | 0,4 | 65 | 10 | 10 | – |
| Scorzonera hispanica Skorzonera | 97 | 0,4 | 70 | 10 | 10 | – |
| Solanum melongena Oberżyna | 99 | 0,1 | 65 | 12 | 12 | – |
| Spinacia oleracea Szpinak zwyczajny | 98 | 0,3 | 75 | 13 | 8 | – |
| Tetragonia expansa Szpinak nowozelandzki | 95 | 0,1 | 65 | 13 | 13 | – |
| Tragopogon porrifolius Salsefia | 97 | 0,4 | 70 | 11 | 11 | – |
| Valerianella locusta Roszponka warzywna | 97 | 0,3 | 65 | 10 | 10 | – |
| Vicia faba | 99 | 0,1 | 80 | 15 | 5–8 | 8%11) nasion porażonych oraz 10% nasion uszkodzonych |
| Zea mays | 98 | 0,1 | 75 | 12 | 5–8 | – |
| Pozostałe gatunki | 95 | 0,5 | 55 | 12 | 7–12 | – |
Objaśnienia:
7) Dotyczy nasion otartych.
8) Dotyczy nasion porażonych łącznie przez Alternaria radicina i Alternaria dauci.
Nasiona o większym porażeniu mogą być dopuszczone do obrotu pod warunkiem zaprawienia. Zwalnia się od zaprawienia nasiona przeznaczone do sprzedaży detalicznej w opakowaniach nie większych niż 20 g w przypadku porażeniu wyżej wymienionymi grzybami nie większego niż 20%.
9) Dotyczy nasion porażonych łącznie przez Botrytis ssp., Colletotrichum lindemutianum, Fusarium ssp.
Nasiona o większym porażeniu mogą być dopuszczone do obrotu pod warunkiem zaprawienia. Dla nasion przeznaczonych do sprzedaży detalicznej w opakowaniach nie większych niż 500 g dopuszcza się niezaprawianie w przypadku porażenia wyżej wymienionymi grzybami nie większego niż 15%.
10) Dotyczy nasion porażonych łącznie przez Ascochyta ssp., Botrytis ssp., Fusarium ssp
Nasiona o większym porażeniu mogą być dopuszczone do obrotu pod warunkiem zaprawienia. Zwalnia się od zaprawienia nasiona przeznaczone do sprzedaży detalicznej w opakowaniach nie większych niż 500 g w przypadku porażenia ww. grzybami nie większego niż 15%.
11) Dotyczy nasion porażonych łącznie przez Botrytis fabae, Botrytis cinerea, Fusarium ssp.,Ascochyta fabae, Sclerotinia ssp., Rhizoctonia.
Nasiona o większym porażeniu mogą być dopuszczone do obrotu pod warunkiem zaprawienia. Zwabia się od zaprawienia nasiona przeznaczone do sprzedaży detalicznej w opakowaniach nie większych niż 500 g w przypadku porażenia wyżej wymienionymi grzybami nie większego niż 15%.
12) Jeżeli między plantacją nasienną a inną uprawą, od której obowiązuje izolacja, znajduje się naturalna osłona w postaci budynków, wzgórz lub lasu, stanowiąca dostateczną przeszkodę w przenoszeniu pyłku innych roślin lub zarodników chorób i przelotu owadów, izolacja może być zmniejszona o 1/3 minimalnej, wymaganej przepisami.
Uwagi:
Nasiona warzyw strączkowych nie mogą być porażone przez następujące gatunki żywych owadów:
– Acanthoscelides obtectus Sag.,
– Bruchus affinis Froel.,
– Bruchus atomarius L.,
– Bruchus pisorum L.,
– Bruchus rufimanus Boh.
Nasiona nie mogą być porażone przez żywe Acarina.
W przypadku fasoli wielokwiatowej, fasoli zwykłej (karłowej i tycznej) i grochu wszystkie świeże i zdrowe nasiona nieskiełkowane w czasie traktowania wstępnego uważa się za skiełkowane; w przypadku fasoli wielokwiatowej, fasoli karłowej – maksymalnie 5% nasion o twardej łupinie uznaje się za zdolne do kiełkowania.
Na małych opakowaniach do 500 g, poza wymaganym oznakowaniem, umieszcza się termin przydatności do siewu liczony od daty wykonanej analizy:
– na opakowaniach hermetycznych termin ten wynosi 36 miesięcy,
– na opakowaniach zwykłych – 24 miesiące.
Nasiona znajdujące się w obrocie przez cały okres sprzedaży mają utrzymywać parametry zgodne z obowiązującymi przepisami.
XII. Wymagania obowiązujące przy wytwarzaniu i obrocie cebuli dymki.
1. Cel – przestrzeganie przez producentów obowiązujących zasad przy produkcji cebuli dymki i jej obrocie zapewni uzyskanie materiału siewnego właściwej jakości.
2. Zmianowanie – cebula na dymkę nie może być uprawiana na polu, na którym w ciągu ostatnich 4 lat uprawiano rośliny cebulowe.
Ze względu na niebezpieczeństwo występowania niszczyka zjadliwego nie powinno się jej uprawiać także po: pietruszce, selerze, bobie, bobiku, koniczynie czerwonej, ziemniakach i owsie.
3. Ocena stanu plantacji:
1) przeprowadza się jedną urzędową ocenę stanu plantacji każdego pola produkcyjnego w pełni wegetacji i określa szacunkowy plon cebuli dymki,
2) wyniki oceny stanu plantacji mają być udokumentowane zaświadczeniem stanowiącym wyciąg z arkusza oceny polowej.
4. Izolacja przestrzenna12) – pola produkcyjne muszą być usytuowane co najmniej 50 metrów od innych upraw roślin cebulowych.
5. Ocena weryfikacyjna – ocenę weryfikacyjną wykonuje producent, a wyrywkową kontrolę przeprowadzaj ą inspektorzy Inspekcji Nasiennej.
6. Wymagania dla dymki:
1) cebule dymki powinny być wolne od mszyc, przylżeńców lub innych owadów,
2) liczba cebulek porażonych Penicillium i innymi chorobami nie może przekraczać 3% wagowych,
3) dopuszczalna norma dla cebulek nietypowych dla odmiany nie może przekraczać 1% wagowego,
4) dopuszczalna norma dla cebulek uszkodzonych lub pozbawionych łuski nie może przekraczać 3% wagowych,
5) dopuszczalna norma dla cebulek skiełkowanych nie może przekraczać 3% wagowych,
6) dopuszczalna norma dla cebulek z zaschniętym szczypiorem dłuższym niż 2 cm nie może przekraczać 5% wagowych,
7) dopuszczalna norma dla cebulek z zaschniętymi korzeniami dłuższymi niż 4 cm nie może przekraczać 5% wagowych; nie dopuszcza się świeżych korzeni,
8) dopuszczalna norma dla cebulek o niewłaściwej wielkości nie może przekraczać 5% wagowych,
9) dymka musi mieć dobrą wartość rynkową, powinna być sucha, z dobrze przylegającą zewnętrzną łuską. Łączna liczba cebul nieodpowiadających wymaganiom nie może przekraczać 10% wagowych,
10) w opakowaniu nie może być więcej niż 0,5% wagowych kamieni i ziemi.
7. Podział dymki na wielkości handlowe:
W zależności od średnicy cebulek dymkę dzieli się na 4 wielkości:
I – 5 do 10 mm,
II –11 do 15 mm,
III –16 do 20 mm,
IV – 21 do 25 mm.
8. Badania szczegółowe partii.
Jeżeli jakość partii budzi wątpliwości, wykonywane są badania szczegółowe.
Do badań szczegółowych, w zależności od wielkości partii, należy pobrać losowo według tabeli odpowiednią liczbę opakowań jednostkowych.
Z każdego opakowania pobranego z partii należy pobrać dymkę z różnych miejsc, aby łączna masa próbki wynosiła:
0,5 kg – w przypadku pobrania l opakowania,
1,0 kg – w przypadku pobrania 3 do 5 opakowań,
3,0 kg – w przypadku pobrania więcej niż 5 opakowań.
| Liczba opakowań jednostkowych | 1–3 | 4–6 | 7–15 | 16–25 | 25–50 | 51–150 | 150 i więcej |
| Liczba opakowań jednostkowych | 1 | 3 | 5 | 7 | 8 | 9 | 10 |
1) sprawdzenie średnicy dymki należy wykonać przez pomiar wszystkich cebul z próby przy pomocy kalibrownicy lub suwmiarką z dokładnością do 1 mm w miejscu największego zgrubienia (najczęściej w połowie wysokości cebuli mierzonej od piętki do szyjki),
2) partię dymki należy uznać za zgodną z wymaganiami, jeśli przeprowadzone badania dały wyniki zgodne z wymienionymi w tabeli.
9. Cechy dyskwalifikujące:
1) całą partię lub opakowanie: zgnicie, zmarznięcie, uszkodzenie przez choroby i szkodniki, zaparzenie, przekroczenie dopuszczalnych tolerancji,
2) poszczególne cebule: nadmarznięcie, uszkodzenie przez choroby i szkodniki, całkowite zaschnięcie łusek mięsistych, brak suchej łuski.
Uwagi:
– Cebula dymka oraz materiał rozmnożeniowy i nasadzeniowy innych warzyw odmian będących w Rejestrze wytwarza się z nasion zakwalifikowanych przez Inspekcję Nasienną lub nasion kat. Standard zakwalifikowanych przez hodowcę odmiany.
– Materiał rozmnożeniowy i nasadzeniowy roślin warzywnych nieobjętych Rejestrem wytwarza się z nasion handlowych.
– Materiał rozmnożeniowy należy wytwarzać i sprzedawać w partiach lub zestawach partii.
– Materiał rozmnożeniowy podlega etykietowaniu etykietą dostawcy na zasadach obowiązujących dla materiału szkółkarskiego.
– Za tożsamość odmianową materiału rozmnożeniowego roślin warzywnych odpowiada producent lub wprowadzający do obrotu.
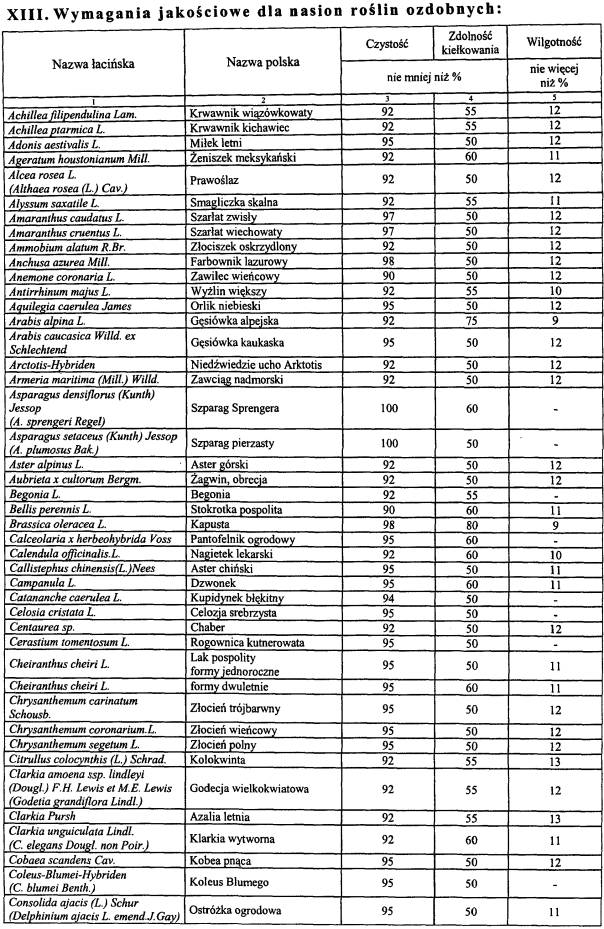
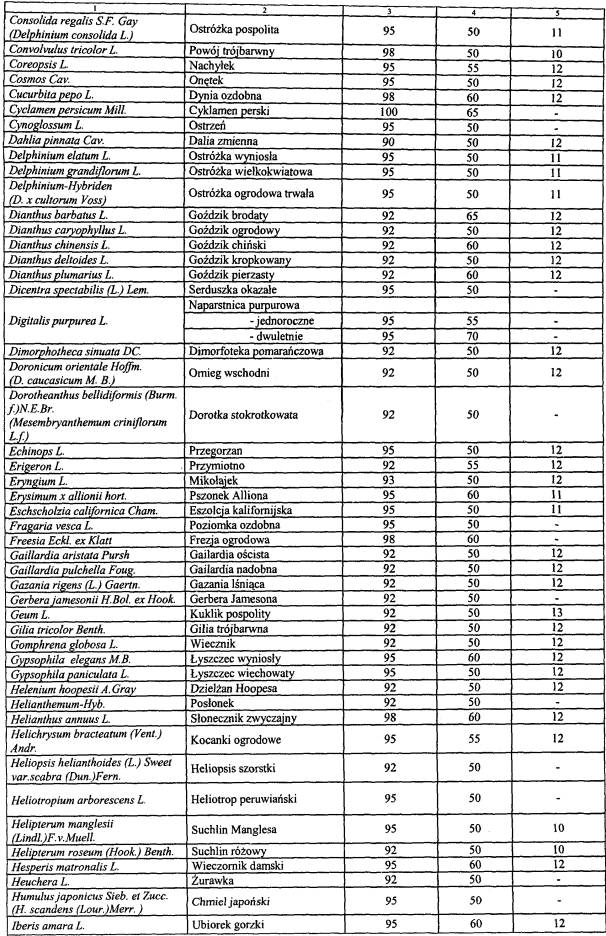
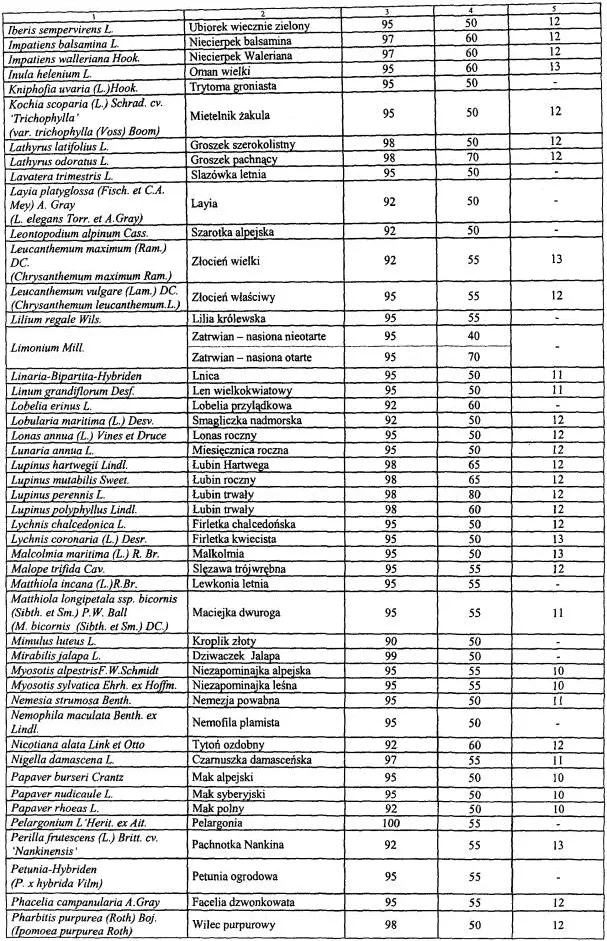
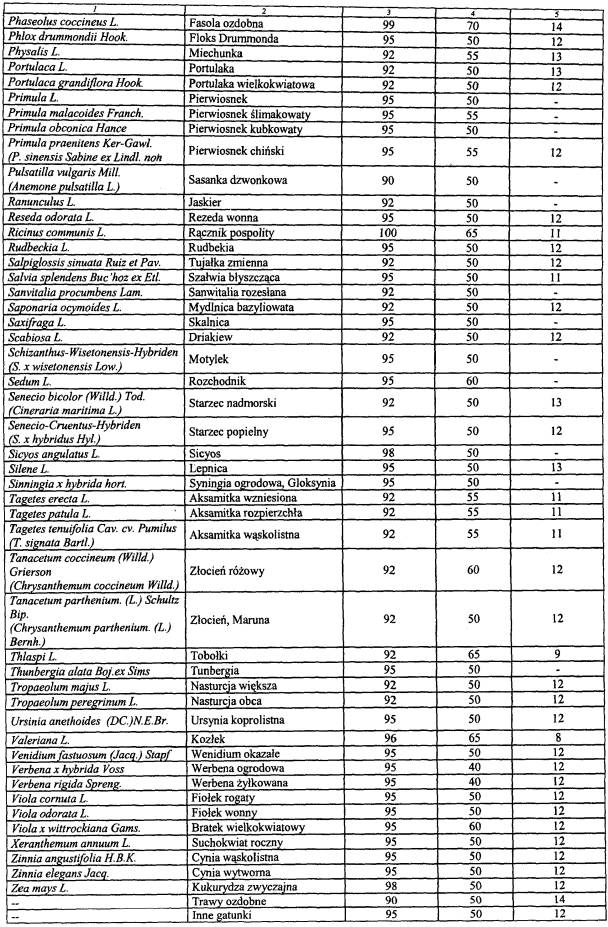
Uwagi:
– Zdolność kiełkowania nasion otoczkowanych nie powinna być mniejsza niż 80%, a nasion w opakowaniach hermetycznych – nie mniejsza niż 70 %.
– W opakowaniach hermetycznych wilgotność nasion z rodzaju Cucurbita, Lathyrus i Lupinus powinna wynosić 6 – 10 %, pozostałych gatunków 6 – 8 %.
– Wykazane w tabeli procenty wilgotności nie dotyczą nasion przeznaczonych na materiał wyjściowy do reprodukcji.
– Nasiona na reprodukcję oraz te, dla których nie podano wilgotności, powinny być suche .
– Na małych opakowaniach do sprzedaży detalicznej, poza wymaganym oznakowaniem, umieszcza się termin przydatności do siewu liczony od daty wykonanej analizy:
– na opakowaniach hermetycznych termin ten wynosi 36 miesięcy,
– na opakowaniach zwykłych – 24 miesiące.
– Nasiona znajdujące się w obrocie przez cały okres sprzedaży mają utrzymywać parametry zgodne z obowiązującymi przepisami.
– Materiał rozmnożeniowy i nasadzeniowy roślin ozdobnych ma być wyprodukowany z nasion i roślin matecznych znanego pochodzenia i odmiany.
– Materiał rozmnożeniowy należy sprzedawać w partiach lub zestawach partii. Materiał rozmnożeniowy podlega etykietowaniu etykietą dostawcy na zasadach obowiązujących dla materiału szkółkarskiego.
– Za tożsamość odmianową materiału siewnego roślin ozdobnych odpowiada producent lub wprowadzający do obrotu.
Załącznik nr 7
WYMAGANIA DOTYCZĄCE WYTWARZANIA KWALIFIKOWANEGO MATERIAŁU SZKÓŁKARSKIEGO ORAZ JEGO JAKOŚCI
A. Wytwarzanie kwalifikowanego materiału szkółkarskiego.
I. Materiał przedelitarny1 drzew owocowych i ich podkładek.
1. Utrzymywanie roślin wolnych od wirusów:
Rośliny rosną pojedynczo w pojemnikach w odkażonym podłożu, bez kontaktu korzeni roślin z glebą, w owadoszczelnych karkasach. Rośliny należy przetestować indywidualnie w celu stwierdzenia, że są wolne od organizmów wymienionych w pkt VII.1. Podstawowe testy należy wykonać na drzewiastych roślinach wskaźnikowych. Testy uzupełniające to: testy na zielnych roślinach wskaźnikowych, serologiczne, PCR, RT–PCR i DAPI.
2. Ocenę tożsamości odmianowej należy wykonać indywidualnie dla każdej rośliny.
II. Plantacje podkładek wegetatywnych drzew owocowych.
1. Izolacja przestrzenna:
1) mateczniki podkładek jabłoni, gruszy, pigwy, czereśni i wiśni: są w odległości nie mniejszej niż 10 m od nie kwalifikowanych roślin tych rodzajów,
2) mateczniki podkładek śliwy, brzoskwini i lubaszki: są w odległości nie umiejszej niż 500 m od niekwalifikowanych roślin tych rodzajów,
3) mateczniki elitarne2 są w odległości nie mniejszej niż 5 m od mateczników kwalifikowanych3,
4) mateczniki różniące się statusem zdrowotności są w odległości nie mniejszej niż 3 m.
Podkładki różnych odmian wysadza się w oddzielnych rzędach; dotyczy to także podkładek tych samych odmian wysadzonych w różnych latach.
2. Czystość odmianowa.
Na plantacjach matecznych wymagana jest całkowita czystość odmianowa. Wszystkie odmiany podkładek, w których stwierdzone zostaną obce rośliny, podlegają dyskwalifikacji.
3. Wiek4:
1) mateczniki elitarne drzew ziarnkowych utrzymuje się do 7 lat, a drzew pestkowych do 6 lat,
2) mateczniki kwalifikowane drzew ziarnkowych utrzymuje się do 12 lat, a drzew pestkowych przez 10 lat.
Objaśnienia:
1 Materiał przedelitamy – kwalifikowany materiał szkółkarski wytworzony z materiału hodowlanego zgodnie z zasadami utrzymywania tożsamości odmiany, ochrony przed chorobami i szkodnikami, spełniający wymagania szczegółowe dla poszczególnych gatunków i przeznaczony do produkcji materiału elitarnego.
2 Materiał elitarny – kwalifikowany materiał szkółkarski wytworzony z materiału przedelitamego zgodnie z zasadami utrzymywania tożsamości odmiany, ochrony przed chorobami i szkodnikami, spełniający wymagania szczegółowe dla poszczególnych gatunków i przeznaczony do produkcji materiału kwalifikowanego.
3 Materiał kwalifikowany – materiał szkółkarski otrzymany z materiału elitarnego, spełniający wymagania szczegółowe dla poszczególnych gatunków i przeznaczonego do zakładania sadów i jagodników owocujących.
4 Wiek – liczba lat wyrażona liczbą okresów wegetacyjnych dla:
a) plantacji – liczona od czasu założenia (posadzenia) plantacji,
b) drzewek – liczona od czasu szczepienia (okulizacji) podkładki zrazem (tarczką) odmiany, wstawki, skarlającej, pośredniej lub przewodniej,
c) drzewek własnokorzeniowych liczony jest od czasu ukazania się u nasady pędu korzeni przybyszowych,
d) podkładek:
generatywnych – liczona od czasu skiełkowania nasion,
wegetatywnych – liczona od czasu ukazania się części nadziemnej podkładki i korzeni przybyszowych,
z kultur in vitro – liczona od czasu wysadzenia ukorzenionych roślin pod osłony lub pole,
e) roślin w formie krzaczastej – liczona od czasu posadzenia sadzonek pod osłonami lub w polu,
f) roślin w formie piennej – liczona od rozpoczęcia wzrostu pędów z przyjętych zrazów lub oczek odmiany.
4. Rozmnażanie.
Materiał do założenia elitarnych plantacji matecznych pozyskuje się z roślin przedelitamych otrzymanych z mikroroznmażania, sadzonkowania albo z odkładów. Podkładki przeznaczone do założenia matecznika podkładek drzew ziarnkowych są nie starsze niż dwuletnie. Do zakładania mateczników podkładek drzew pestkowych używa się podkładek jednorocznych.
Materiał do założenia plantacji podkładek kwalifikowanych pochodzi z plantacji matecznych albo podkładek zakwalifikowanych jako elitarne.
5. Zdrowotność:
1) materiał szkółkarski podkładek wegetatywnych jest:
a) wolny od organizmów podlegających obowiązkowi zwalczania,
b) na podstawie wizualnej oceny uznany za wolny od organizmów wymienionych w pkt B.III,
c) praktycznie wolny od innych organizmów, które mogą obniżyć jakość materiału szkółkarskiego,
2) choroby wirusowe i wirozopodobne:
a) podkładki wolne od organizmów wymienionych w pkt VII.1 uważa się za wolne od chorób wirusowych i wirozopodobnych,
b) podkładki wolne od organizmów wymienionych w pkt VII.2 uważa się za testowane na obecność chorób wirusowych i wirozopodobnych,
c) podkładki wolne od organizmów wymienionych w pkt B.III uważa się za materiał podstawowy.
6. Wymagania dodatkowe.
Plantację przedstawia się do jednej oceny rocznie, która wykonywana jest w końcu lata albo na początku jesieni, przed zakończeniem wegetacji roślin.
W przypadku stwierdzenia nieprawidłowości możliwych do usunięcia może być wyznaczony termin dodatkowej oceny.
Każdą odmianę podkładki oznacza się etykietami na początku rzędu lub bloku.
III. Plantacje podkładek generatywnych drzew owocowych.
1. Izolacja przestrzenna:
1) podkładki generatywne jabłoni, gruszy, czereśni ptasiej i antypki są w odległości nie mniej niż 10 m od niekwalifikowanych roślin tych rodzajów,
2) podkładki generatywne śliwy, ałyczy, moreli i brzoskwini są w odległości nie mniej niż 500 m od niekwalifikowanych roślin tych rodzajów,
3) podkładki różnych gatunków i odmian rosną w oddzielnych rzędach lub kwaterach.
4) podkładki o różnym statusie zdrowotności są w odległości nie mniej niż 2 m.
2. Czystość odmianowa.
Na plantacjach podkładek generatywnych wymagana jest całkowita czystość odmianowa. Jeśli na plantacji siewek występują zamieszane odmiany lub gatunki w ilości do 1% – odstępuje się od oceny, wyznaczając drugi termin po usunięciu zamieszanych roślin. Zamieszanie plantacji siewkami innej odmiany lub gatunku ponad 1% jest powodem dyskwalifikacji odmiany.
3. Rozmnażanie.
Nasiona do wytworzenia podkładek pobiera się z kwalifikowanych sadów nasiennych. Pobranie nasion z drzew niekwalifikowanych (gatunek bez określenia odmiany) jest możliwe tylko w przypadku braku nasion z sadów nasiennych.
4. Wiek.
Podkładki generatywne nie mogą być starsze niż dwuletnie.
5. Zdrowotność.
1) materiał szkółkarski podkładek generatywnych jest:
a) wolny od organizmów podlegających obowiązkowi zwalczania,
b) na podstawie wizualnej oceny uznany za wolny od organizmów wymienionych w pkt B.III,
c) praktycznie wolny od innych organizmów, które mogą obniżyć jakość materiału szkółkarskiego,
2) choroby wirusowe i wirozopodobne:
a) podkładki wolne od organizmów wymienionych w pkt VII.1 uważa się za wolne od chorób wirusowych i wirozopodobnych,
b) podkładki wolne od organizmów wymienionych w pkt VII.2 uważa się za testowane na obecność chorób wirusowych i wirozopodobnych,
c) podkładki wolne od organizmów wymienionych w pkt B.III uważa się za materiał podstawowy,
d) podkładki generatywne jabłoni i gruszy uznaje się za wolne od chorób wirusowych i wirozopodobnych.
6. Wymagania dodatkowe:
1) plantację przedstawia się do jednej oceny rocznie, którą wykonuje się w końcu lata albo na początku jesieni, przed zakończeniem wegetacji roślin.
2) w przypadku stwierdzenia nieprawidłowości możliwych do usunięcia może być wyznaczony termin dodatkowej oceny.
Każdy gatunek i odmianę podkładki oznacza się etykietami na początku rzędu lub bloku.
IV. Sady mateczne do pozyskania nasion – jabłoni, gruszy, czereśni ptasiej, antypki, ałyczy, śliwy, brzoskwini i moreli.
1. Izolacja przestrzenna:
1) sady drzew pestkowych są w odległości nie mniejszej niż 500 m od niekwalifikowanych roślin pestkowych,
2) sady drzew ziarnkowych są w odległości nie mniejszej niż 50 m od niekwalifikowanych roślin ziarnkowych,
3) materiał o różnym statusie zdrowotności należy lokalizować w oddzielnych kwaterach, a drzewa pestkowe o różnym statusie zdrowotności należy lokalizować w oddzielnych kwaterach z zachowaniem izolacji 500 m.
2. Czystość odmianowa:
1) wymagana jest całkowita czystość odmianowa,
2) drzewa odmian zapylających należy trwale oznaczyć.
3. Rozmnażanie – sady zakłada się z drzewek elitarnych przeznaczonych dla sadów nasiennych.
4. Wiek – nie określa się wymagań wieku plantacji. Długość okresu użytkowania uzależnia się od zdrowotności i produktywności drzew.
5. Zdrowotność:
1) drzewa nasienne i nasiona do produkcji podkładek generatywnych są:
a) wolne od organizmów podlegających obowiązkowi zwalczania,
b) na podstawie wizualnej oceny, uznane za wolne od organizmów wymienionych w pkt B.III,
c) praktycznie wolne od innych organizmów, które mogą obniżyć jakość materiału szkółkarskiego,
2) choroby wirusowe i wirozopodobne:
a) drzewa nasienne i nasiona wolne od organizmów wymienionych w pkt VII.1 uważa się za wolne od chorób wirusowych i wirozopodobnych,
b) drzewa nasienne i nasiona wolne od organizmów wymienionych w pkt VII.2 uważa się za testowane na obecność chorób wirusowych i wirozopodobnych,
c) drzewa nasienne i nasiona wolne od organizmów wymienionych w pkt B.III uważa się za materiał podstawowy.
Sady nasienne drzew pestkowych są co cztery lata testowane na choroby wirusowe przenoszone przez pyłek i wektory. Pierwsze testowanie należy wykonać na 2–letnich drzewkach.
6. Wymagania dodatkowe.
Plantację przedstawia się do jednej oceny rocznie: drzewa ziarnkowe w okresie dojrzewania owoców, a drzewa pestkowe przed zbiorem owoców.
W przypadku stwierdzenia nieprawidłowości możliwych do usunięcia może być wyznaczony termin dodatkowej oceny.
Każdy gatunek i odmiana są oznaczone etykietami na początku rzędu lub bloku.
V. Sady mateczne do pozyskiwania zrazów (oczek) – jabłoni, gruszy, śliwy, wiśni, czereśni, brzoskwini i moreli.
1. Izolacja przestrzenna:
1) sady drzew pestkowych są w odległości nie mniejszej niż 500 m od niekwalifikowanych roślin pestkowych,
2) sady drzew ziarnkowych są w odległości nie mniejszej niż 50 m od niekwalifikowanych roślin ziarnkowych.
W sadzie zraźnikowym stosuje się izolację 2 m pomiędzy różnymi odmianami tego samego gatunku. Materiał o różnym statusie zdrowotności lokalizuje się w oddzielnych kwaterach. Kwatery są w odległości nie mniejszej niż 3 m.
2. Czystość odmianowa – wymagana jest całkowita czystość odmianowa.
3. Rozmnażanie – sady do pozyskiwania zrazów (oczek) są zakładane z drzewek elitarnych przeznaczonych dla sadów zraźnikowych.
4. Wiek:
1) sady zraźnikowe drzew pestkowych utrzymuje są przez 6 lat, a drzew ziarnkowych przez 8 lat,
2) drzewa zraźnikowe, z wyjątkiem drzew pestkowych, mogą zostać dopuszczone do owocowania.
5. Zdrowotność:
1) drzewa zraźnikowe i zrazy (oczka) są:
a) wolne od organizmów podlegających obowiązkowi zwalczania,
b) na podstawie wizualnej oceny uznane za wolne od organizmów wymienionych w pkt B.III,
c) praktycznie wolne od innych organizmów, które mogą obniżyć jakość materiału szkółkarskiego,
2) choroby wirusowe i wirozopodobne:
a) drzewa zraźnikowe i zrazy (oczka) wolne od organizmów wymienionych w pkt VII.1 uważa się za wolne od chorób wirusowych i wirozopodobnych,
b) drzewa zraźnikowe i zrazy (oczka) wolne od organizmów wymienionych w pkt VII.2 uważa się za testowane na obecność chorób wirusowych i wirozopodobnych,
c) drzewa zraźnikowe i zrazy (oczka) wolne od organizmów wymienionych w pkt B.III uważa się za materiał podstawowy.
6. Wymagania dodatkowe.
Plantację przedstawia się do jednej oceny rocznie przeprowadzanej – w czerwcu–lipcu bezpośrednio przed pozyskiwaniem zrazów (oczek).
W przypadku stwierdzenia nieprawidłowości możliwych do usunięcia może być wyznaczony termin dodatkowej oceny.
Każdy gatunek i odmiana są oznaczone etykietą na początku rzędu lub bloku.
VI. Szkółki drzewek i plantacje uszlachetnionych podkładek – jabłoni, gruszy, śliwy, wiśni, czereśni, brzoskwini i moreli.
1. Izolacja przestrzenna:
1) szkółki elitarne:
a) jabłoni, gruszy, wiśni i czereśni są w odległości nie mniejszej niż 50 m od niekwalifikowanych roślin tych rodzajów,
b) śliwy, brzoskwini i moreli są w odległości nie mniejszej niż 500 m od niekwalifikowanych roślin tych rodzajów,
2) szkółki kwalifikowane:
a) jabłoni, gruszy, wiśni i czereśni są w odległości nie mniejszej niż 5 m od niekwalifikowanych roślin tych gatunków,
b) śliwy, brzoskwini i moreli są w odległości nie mniejszej niż 500 m od niekwalifikowanych roślin tych gatunków,
3) rośliny o różnym statusie zdrowotności są od siebie oddalone o co najmniej 2 m.
Dla plantacji uszlachetnionych podkładek stosuje się taką samą izolację jak dla szkółek odpowiednich grup i gatunków.
2. Czystość odmianowa.
W szkółkach wymagana jest całkowita czystość odmianowa.
Drzewka odmian obcych i nieoznaczonych podlegają dyskwalifikacji.
Zastosowanie dla drzewek niewłaściwych podkładek, wstawek, przewodnich i pośrednich powodujących objawy niezgodności powoduje dyskwalifikację odmian z objawami niezgodności (żółknięcie i opadanie liści oraz wyraźne przebarwienie kory).
3. Rozmnażanie.
Szkółki zakłada się z materiału przedelitarnego, elitarnego albo kwalifikowanego przeznaczonego dla szkółek.
Zrazy (oczka) wiśni ze szkółki do okulizacji pobiera się w ilości do 50%.
Szkółkę do pobierania zrazów (oczek) należy zakwalifikować i zrazy (oczka) przeznaczyć dla własnej szkółki.
Drzewka w szkółce do pobierania zrazów (oczek) pochodzą ze zrazów (oczek) pobranych z sadu zraźnikowego.
4. Wiek:
1) drzewka elitarne nie mogą być starsze niż 2-letnie, pod warunkiem niedopuszczenia drzewek do kwitnienia,
2) drzewka kwalifikowane nie mogą być starsze niż 4-letnie.
5. Zdrowotność:
1) drzewka albo uszlachetnione podkładki są:
a) wolne od organizmów podlegających obowiązkowi zwalczania,
b) wolne od organizmów wymienionych w pkt B.III – na podstawie wizualnej oceny,
c) praktycznie wolne od innych organizmów, które mogą obniżyć jakość materiału szkółkarskiego,
2) choroby wirusowe i wirozopodobne:
a) drzewka wolne od organizmów wymienionych w pkt VII.1 uważa się za wolne od chorób wirusowych i wirozopodobnych,
b) drzewka wolne od organizmów wymienionych w pkt VII.2 uważa się za testowane na obecność chorób wirusowych i wirozopodobnych,
c) drzewka wolne od organizmów wymienionych w pkt B.III uważa się za materiał podstawowy.
6. Wymagania dodatkowe.
Plantację przedstawia się do jednej oceny rocznie, którą wykonuje się w końcu lata albo na początku jesieni, przed zakończeniem wegetacji roślin.
W przypadku stwierdzenia nieprawidłowości możliwych do usunięcia może być wyznaczony termin dodatkowej oceny.
Każdy gatunek i odmiana są oznaczone etykietami na początku rzędu lub bloku.
VII. Statusy zdrowotności kwalifikowanego materiału szkółkarskiego.
1. Wykaz chorób wirusowych i wirozopodobnych dla materiału szkółkarskiego o statusie zdrowotności „wolne od wirusów"5.
Materiał ten oznacza się ww – wolne od wirusów albo vf – virus free.
Materiał ten powinien być wolny od wszystkich wirusów i patogenów wirozopodobnych. W szczególności konieczne jest stwierdzenie braku porażenia niżej wymienionymi chorobami (patogenami):
1) jabłoń:
a) chlorotyczna plamistość liści jabłoni (ACLSV),
b) mozaika j abłoni (ApMV),
c) żłobkowatość pnia jabłoni (ASGV),
d) proliferacja jabłoni (AP–MLO),
e) gumowatość drewna jabłoni (RW),
f) spłaszczenie konarów (FL),
g) zdrobnienie owoców (Chat fruit),
h) jamkowatość pnia jabłoni, epinastia i zamieranie Spy (ASPV, SPYED),
2) grusza:
a) pierścieniowa mozaika gruszy (PRM, ACLSV),
b) żółtaczka nerwów gruszy (PVY, ASPV),
c) zamieranie gruszy (PD-MLO),
d) kamienistość miąższu gruszek (PSP),
3) wiśnia i czereśnia:
a) nekrotyczna plamistość pierścieniowa drzew pestkowych (PNRSV),
b) karłowatość śliw = żółtaczka wiśni (PDV),
c) chlorotyczna plamistość liści jabłoni (ACLSV),
d) liściozwój czereśni (CLRV),
e) zdrobnienie owoców czereśni (LChV–l, LChV–2),
f) zielona plamistość pierścieniowa czereśni (GRMV),
g) pierścieniowa plamistość maliny (RRV),
4) śliwa, brzoskwinia i morela:
a) ospowatość śliwy (szarka) (PPV),
b) nekrotyczna plamistość pierścieniowa drzew pestkowych (PNRSV),
c) karłowatość śliwy (PDV),
d) mozaika wstęgowa śliwy (ApMV),
e) chlorotyczna plamistość liści jabłoni (ACLSV).
Objaśnienie:
5 Materiał wolny od wirusów (ww, vf): materiał szkółkarski, który został poddany testowaniu i uznany za wolny od wirusów dla poszczególnych gatunków w tym statusie. Jest to również materiał otrzymany bezpośrednio z materiału wolnego od wirusów, produkowany lub utrzymywany, w określonej liczbie pokoleń, w warunkach gwarantujących niewystąpienie infekcji.
2. Wykaz chorób wirusowych i wirozopodobych, od których jest wolny materiał szkółkarski o statusie zdrowotności „testowany na wirusy"6.
Materiał ten oznacza się tw – testowane na wirusy albo vt – virus tested.
Materiał testowany nie może wykazywać objawów chorobowych wskazujących na porażenie wirusami lub patogenami wirozopodobnymi.
Dodatkowo konieczne jest stwierdzenie braku porażenia materiału niżej wymienionymi chorobami (patogenami):
1) jabłoń:
a) chlorotyczna plamistość liści jabłoni (ACLSV),
b) mozaika jabłoni (ApMV),
c) żłobkowatość pnia jabłoni (ASGV),
d) proliferacjajabłoni (AP-MLO),
e) gumowatość drewna jabłoni (RW),
f) jamkowatość pnia jabłoni, epinastia i zamieranie Spy (ASPV, SPYED),
2) grusza:
a) pierścieniowa mozaika gruszy (PRM, ACLSV),
b) żółtaczka nerwów gruszy (PVY,ASPV),
c) zamieranie gruszy (PD- MLO),
3) wiśnia i czereśnia:
a) nekrotyczna plamistość pierścieniowa drzew pestkowych (PNRSV),
b) karłowatość śliwy – żółtaczka wiśni (PDV),
c) chlorotyczna plamistość liści jabłoni (ACLSV),
d) pierścieniowa plamistość maliny (RRV).
VIII. Plantacje mateczne i sadzonki truskawki.
1. Utrzymywanie roślin.
Rośliny mateczne truskawki są przetrzymywane w izolacji od obcych gatunków w owadoszczelnych karkasach i zabezpieczone przed porażeniem przez szkodniki i organizmy chorobotwórcze.
Rośliny rosną w odkażonym podłożu w oddzielnych pojemnikach. Rozłogi wyrastające z roślin matecznych są ukorzeniane w podłożach w sposób eliminujący możliwość porażenia przez choroby.
Rośliny mateczne są testowane metodami biologicznymi, serologicznymi lub z wykorzystaniem technik biologii molekularnej na obecność chorób i szkodników wymienionych w tabeli.
2. Rozmnażanie – dla sadzonek truskawki stosuje się następujące stopnie kwalifikacji:
1) superelita –materiał przedelitrny,
2) elita 1 i elita 2 – materiał elitarny,
3) oryginał – materiał kwalifikowany.
Objaśnienie:
6 Materiał testowany na obecność wirusów (tw, vt): materiał szkółkarski, który został poddany testowaniu i uznany za wolny od wirusów dla poszczególnych gatunków w tym statusie. Jest to również materiał otrzymany bezpośrednio z materiału testowanego na wirusy produkowany lub utrzymywany, w określonej liczbie pokoleń, w warunkach gwarantujących niewystąpienie infekcji.
3. Izolacja przestrzenna.
Plantacje sadzonek w stopniu superelity, elity 1, elity 2 są w odległości nie mniejszej niż 300 m od niekwalifikowanych plantacji truskawki, a w stopniu oryginału w odległości nie mniejszej niż 50 m od niekwalifikowanych plantacji truskawki. Odstępy między odmianami i stopniami kwalifikacji w mateczniku nie mogą być mniejsze niż 2 m.
4. Czystość odmianowa – dla sadzonek w stopniu superelity, elity 1 i 2 obowiązuje całkowita czystość odmianowa, a w stopniu oryginału może być do 1% roślin obcych odmian. Rośliny obce należy zdyskwalifikować.
5. Wiek.
Plantacje truskawki mogą być powadzone przez 1 rok.
Na polu przeznaczonym do założenia plantacji truskawki przez co najmniej 4 lata, przed posadzeniem plantacji, nie mogą być uprawiane truskawki, ziemniaki, ogórki, pomidory, len, porzeczki, agrest, maliny i jeżyny.
Materiałem wyjściowym do zakładania plantacji matecznych mogą być również sadzonki wyprodukowane metodą mikrorozmnażania (in vitro). Przy stosowaniu tej metody ogranicza się liczbę pasaży (kolejnych rozmnożeń pędów) do 10.
6. Zdrowotność – rośliny mateczne i sadzonki truskawek są:
1) wolne od organizmów podlegających obowiązkowi zwalczania,
2) wolne, w zakresie tolerancji, od organizmów wymienionych w tabeli poniżej:
| Choroby i szkodniki | Dopuszczalny % porażonych roślin | ||
| superelita | elita 1, 2 | oryginał | |
| 1 | 2 | 3 | 4 |
| I. Wirusy i organizmy wirusopodobne: |
|
|
|
| 1. wirus mozaiki gęsiówki (Arabis mosaic virus) | 0 | 0 | 2 |
| 2. wirus pierścieniowej plamistości maliny (Raspberry ringspot virus) | 0 | 0 | 0 |
| 3. wirus czarnej plamistości pierścieniowej pomidora (Tomato black ring virus) | 0 | 0 | 0 |
| 4. wirus marszczycy liści truskawki (Strawberry crinkle virus) | 0 | 0 | 2 |
| 5. wirus latentnej plamistości pierścieniowej truskawki (Strawberry latent ringspot virus) | 0 | 0 | 0 |
| 6. wirus źółtobrzeżności liści truskawki (Strawberry mild yellow edge virus) | 0 | 0 | 0 |
| 7. wirus cętkowanej plamistości liści truskawki (Strawberry mottle virus) | 0 | 0 | 2 |
| 8. wirus otaśmienia nerwów liści truskawki (Strawberry vein banding virus) | 0 | 0 | 2 |
| 9. fitoplazma zielenienia płatków truskawki (Strawberry green petal phytoplasma) | 0 | 0 | 1 |
| 10. fitoplazma żółtaczki astra (Aster yellows phytoplasma) | 0 | 0 | 1 |
| 11. żółtaczka czerwcowa (Strawberry june yellows) | 0 | 0 | 2 |
| 1 | 2 | 3 | 4 |
| II. Choroby grzybowe: |
|
|
|
| 1. zgnilizna korony truskawki (Phytophthora cactorum) | 0 | 0 | 0 |
| 2. werticilioza truskawki (Yerticillium dahliae) | 0 | 0 | 1 |
| 3. antraknoza (Colletotrichum spp.) | 0 | 0 | 1 |
| 4. biała plamistość liści truskawki (Mycosphaerella fragariae) | 0 | 0 | 0 |
| 5. mączniak prawdziwy truskawki (Sphaerotheca macularis ssp. fragariae) | 0 | 0 | 5 |
| 6. czerwona plamistość liści truskawek (Diplocarpon earliana) | 0 | 0 | 1 |
| III. Szkodniki: |
|
|
|
| 1. guzaki (Meloidogyne spp.) | 0 | 0 | 0 |
| 2. niszczyk zjadliwy (Ditylenchus dipsaci) | 0 | 0 | 0 |
| 3. węgorek chryzantemowiec (Aphelenchoides ritzemabosi) | 0 | 0 | 0 |
| 4. węgorek truskawkowiec (Aphelenchoides fragariae) | 0 | 0 | 0 |
| 5. długacz zwyczajny (Longidorus elongatus) | 0 | 0 | 5 nicieni w 100 g gleby |
| 6. sztylak (Xiphinema diversicaudatum) | 0 | 0 | 5 nicieni w 100 g gleby |
| 7. korzeniak szkodliwy (Pratylenchus penetrans) | 0 | 0 | 5 nicieni w 100 g gleby |
| 8. roztocz truskawkowy (Phytonemus pallidusssp. fragariae) | 0 | 0 | 1 |
| 9. mszyce (Aphididae) | 0 | 0 | 2 |
| 10. skoczkowate (Jassidae) | 0 | 0 | 2 |
| 11. wciornastkowate (Thripidae) | 0 | 0 | 2 |
| 12. przędziorek chmielowiec (Tetranychus urticae) | 0 | 0 | 5 |
3) praktycznie wolne od innych organizmów, które mogą obniżyć jakość materiału szkółkarskiego.
7. Wymagania dodatkowe:
1) plantacje przedstawia się do dwóch ocen rocznie:
a) pierwszą wykonuje się na początku kwitnienia, przed usuwaniem kwiatostanów, kiedy można obserwować ewentualne objawy porażenia fitoplazmami zielenienia płatków i żółtaczki astra,
b) drugą wykonuje się latem albo jesienią przed kopaniem sadzonek albo sprzedażą roślin doniczkowanych,
2) w przypadku stwierdzenia nieprawidłowości możliwych do usunięcia może być wyznaczony termin dodatkowej oceny,
3) każda odmiana jest oznaczona etykietami na początku rzędu lub kwatery.
IX. Plantacje mateczne, szkółki porzeczek (czarna, czerwona) oraz agrestu.
1. Utrzymywanie roślin.
Przedelitarne rośliny porzeczek, agrestu są umieszczone w owadoszczelnych karkasach. Rośliny rosną w odkażonym podłożu w pojemnikach, bez kontaktu korzeni z glebą.
W czasie wegetacji rośliny przedelitarne są co najmniej raz w roku przetestowane przy wykorzystaniu metod biologicznych, serologicznych lub biologii molekularnej (PCR, RT-PCR, DAPI) na obecność organizmów wymienionych w wymaganiach.
2. Rozmnażanie – dla plantacji matecznych, sadzonek porzeczek, agrestu stosuje się następujące stopnie kwalifikacji:
1) superelita – materiał przedelitarny,
2) elita 1 i elita 2 – materiał elitarny,
3) oryginał – materiał kwalifikowany.
3. Izolacja przestrzenna:
1) mateczniki i szkółki elitarne są w odległości nie mniejszej niż 200 m od niekwalifikowanych roślin tego samego rodzaju,
2) mateczniki i szkółki kwalifikowane są w odległości nie mniejszej niż 100 m od niekwalifikowanych roślin tego samego rodzaju,
3) mateczniki porzeczki złotej są w odległości nie mniejszej niż 100 m od niekwalifikowanych roślin tego samego rodzaju,
4) mateczniki i szkółki elitarne od kwalifikowanych są oddalone od siebie o co najmniej 3 m.
4. Czystość odmianowa.
W matecznikach nie może być roślin obcych odmian.
W szkółce elitarnej nie może być roślin obcych odmian.
W szkółce kwalifikowanej dopuszcza się do 1 % roślin obcych odmian.
Rośliny obce podlegają dyskwalifikacji. Obecność większej liczby zamieszanych roślin
jest powodem dyskwalifikacji odmiany.
Krzewów nie produkuje się metodami kultur tkankowych – in vitro.
5. Wiek:
1) elitarne mateczniki porzeczek i agrestu utrzymuje się przez 5 lat, a kwalifikowane przez 7 lat,
2) elitarne mateczniki porzeczki złotej utrzymuje się przez 8 lat, a kwalifikowane przez 15 lat,
3) w szkółkach ocenie podlegają rośliny nie starsze niż trzyletnie.
6. Zdrowotność – rośliny mateczne i sadzonki porzeczek i agrestu są:
1) wolne od organizmów podlegających obowiązkowi zwalczania,
2) na podstawie wizualnej oceny uznane za wolne od organizmów wymienionych w wymaganiach jakościowych w pkt B.III,
3) wolne od choroby wirusowej otaśmienia nerwów agrestu – Goosberry vein banding,
4) praktycznie wolne od innych organizmów, które mogą obniżyć jakość materiału szkółkarskiego.
7. Wymagania dodatkowe:
1) mateczniki porzeczki i agrestu przedstawia się do dwóch ocen rocznie:
a) pierwsza wykonywana jest wiosną – na obecność wielkopąkowca porzeczkowego albo rewersji dla porzeczek (koniec marca do końca kwitnienia porzeczek) oraz otaśmienia nerwów w matecznikach agrestu (maj do połowy czerwca),
b) druga ocena wykonywana jest w drugiej połowie czerwca – przy rozmnażaniu przez sadzonki zielne i półzdrewniałe albo do końca sierpnia – przy innych sposobach rozmnażania,
2) w matecznikach porzeczek należy corocznie pozostawić na każdym krzewie po jednym dobrze wyrośniętym pędzie owocującym w celu wykrycia ewentualnego porażenia przez wielkopąkowca i rewersję; po dokonaniu oceny pędy te mogą być wycięte,
3) plantacje mateczne porzeczki złotej przedstawia się do jednej oceny rocznie, którą wykonuje się na początku jesieni, nie później niż do końca września,
4) szkółki porzeczki i agrestu przedstawia się do jednej oceny rocznie, którą wykonuje się w okresie sierpień–wrzesień. Na wniosek producenta rośliny produkowane w pojemnikach mogą być oceniane wcześniej.
W przypadku stwierdzenia nieprawidłowości możliwych do usunięcia może być wyznaczony termin dodatkowej oceny. Każdy gatunek i odmiana są oznaczone etykietami na początku rzędu lub bloku.
X. Plantacje mateczne i szkółki malin.
1. Utrzymywanie roślin.
Rośliny mateczne malin do produkcji sadzonek superelitarnych są umieszczone w owadoszczelnych karkasach. Rośliny rosną w odkażonym podłożu w pojemnikach, bez kontaktu korzeni z glebą. W czasie wegetacji rośliny są co najmniej raz w roku przetestowane z wykorzystaniem metod biologicznych, serologicznych lub metodami miologii molekularnej (PCR, RT–PCR, DAPI) na obecność organizmów wymienionych w tabeli.
2. Rozmnażanie – dla sadzonek malin stosuje się następujące stopnie kwalifikacji:
1) superelita – materiał przedelitarny,
2) elita 1 i elita 2 – materiał elitarny,
3) oryginał – materiał kwalifikowany.
3. Izolacja przestrzenna:
1) materiał elitarny jest w odległości nie mniejszej niż 200 m od niekwalifikowanych roślin tego samego rodzaju,
2) materiał kwalifikowany jest w odległości nie mniejszej niż 50 m od niekwalifikowanych roślin tego samego rodzaju,
3) odstępy między odmianami i stopniami kwalifikacji nie mogą być mniejsze niż 3 m.
4. Czystość odmianowa.
Wśród roślin w stopniu superelity i elit nie może być żadnych roślin obcych odmian.
Wśród roślin w stopniu oryginału może być do 1% roślin obcych odmian.
Rośliny wykazujące cechy nietypowe dla danej odmiany należy zdyskwalifikować i usunąć. Obecność powyżej 1% roślin obcych odmian powoduje dyskwalifikację danej odmiany.
5. Wiek:
1) mateczniki utrzymuje się przez 5 lat,
2) odrosty korzeniowe w matecznikach nie mogą być starsze niż jednoroczne,
3) sadzonki w pojemnikach nie mogą być starsze niż dwuletnie.
6. Zdrowotność – rośliny mateczne i sadzonki malin są:
1) wolne od organizmów podlegających obowiązkowi zwalczania,
2) wolne, w zakresie tolerancji, od organizmów wymienionych w tabeli poniżej:
| Choroby i szkodniki | Dopuszczalny % porażonych roślin | ||
| superelita | elita 1 i 2 | oryginał | |
| 1 | 2 | 3 | 4 |
| I. Wirusy i organizmy wirusopodobne: |
|
|
|
| 1. wirus mozaiki gęsiówki (Arabis mosaic virus) | 0 | 0 | 2 |
| 2. wirus pierścieniowej plamistości maliny (Raspberry ringspot virus) | 0 | 0 | 0 |
| 3. wirus czarnej plamistości pierścieniowej pomidora (Tomato black ring virus) | 0 | 0 | 0 |
| 4. wirus latentny pierścieniowej plamistości truskawki (Strawberry latent ringspot virus) | 0 | 0 | 0 |
| 5. wirusy wywołujące mozaikę maliny (Raspberry mosaic virus) | 0 | 0 | 2 |
| 1 | 2 | 3 | 4 |
| 6. wirus liściozwoju czereśni (Cherry leaf roll virus) | 0 | 0 | 0 |
| 7. wirus karłowatości krzaczastej maliny (Raspberry bushy dwarf virus) | 0 | 0 | 1 |
| 8. fitoplazma karłowatości maliny (Rubus stunt phytoplasma) | 0 | 0 | 0 |
| II. Choroby grzybowe: |
|
|
|
| 1. zamieranie pędów maliny (Didymella aplanata) | 0 | 0 | 10 |
| 2. werticylioza (Verticillium spp.) | 0 | 0 | 0 |
| 3. mączniak prawdziwy (Sphareotheca macularis) | 0 | 0 | 2 |
| III. Choroby bakteryjne: |
|
|
|
| 1. włosowatość korzeni (Agrobacterium rhizogenes) | 0 | 0 | 0 |
| 2. guzowatość korzeni (Agrobacterium tumefaciens) | 0 | 0 | 0 |
| 3. staśmienie łodyg (Rhodococcus fascians) | 0 | 0 | 0 |
| IV. Szkodniki: |
|
|
|
| 1. długacz zwyczajny (Longidorus elongatus) | 0 | 0 | 5 nicieni w 100 g gleby |
| 2. sztylak (Xiphinema diversicaudatum) | 0 | 0 | 5 nicieni w 100 g gleby |
| 3. korzeniak szkodliwy (Pratylenchus penetrans) | 0 | 0 | 5 nicieni w 100 g gleby |
| 4. mszyce (Aphididae) | 0 | 0 | 1 |
| 5. przebarwiacz malinowy (Phyllocoptes gracilis) | 0 | 0 | 5 |
| 6. wciornastkowate (Thripidae) | 0 | 0 | 2 |
| 7. skoczkowate (Jassidae) | 0 | 0 | 2 |
| 8. przędziorek chmielowiec (Tetranychus urticae) | 0 | 0 | 5 |
3) praktycznie wolne od innych organizmów, które mogą obniżyć jakość materiału szkółkarskiego.
7. Wymagania dodatkowe:
1) przedstawia się mateczniki do jednej oceny w roku, którą wykonuje się:
a) dla pozyskiwania sadzonek zielnych – w czerwcu,
b) dla pozostałych mateczników – do połowy września,
2) plantacje mateczne należy prowadzić bez pędów owocujących. Owocowanie jednorocznych pędów maliny powtarzającej jest dopuszczalne,
3) szkółki w pojemnikach przedstawia się do jednej oceny w roku, którą wykonuje się w końcu lata.
Na wniosek producenta rośliny produkowane w pojemnikach mogą być oceniane wcześniej.
W przypadku stwierdzenia nieprawidłowości możliwych do usunięcia może być wyznaczony termin dodatkowej oceny.
Każdy gatunek i odmiana są oznaczone etykietami na początku rzędu lub kwatery.
XI. Plantacje mateczne i szkółki borówki wysokiej.
1. Czystość odmianowa:
1) dla plantacji matecznych wymagana jest całkowita czystość odmianowa,
2) dla szkółek może być do 1% roślin obcych odmian, które należy zdyskwalifikować,
3) obecność roślin obcych odmian powyżej 1% powoduje dyskwalifikację wszystkich roślin ocenianej odmiany.
2. Rozmnażanie.
Dla plantacji matecznych i sadzonek borówki wysokiej stosuje się trzy kategorie rozmnożenia: materiał przedelitarny, elitarny i kwalifikowany.
3. Wiek.
Mateczniki elitarne utrzymuje się przez 10 lat, a reprodukcyjny przez 15 lat. W szkółkach ocenie podlegają rośliny nie starsze niż trzyletnie.
4. Zdrowotność – materiał szkółkarski borówki jest:
1) wolny od organizmów podlegających obowiązkowi zwalczania,
2) na podstawie wizualnej oceny uznany za wolny od organizmów wymienionych w pkt B.IIl,
3) praktycznie wolny od innych organizmów, które mogą obniżyć jakość materiału szkółkarskiego.
5. Wymagania dodatkowe:
1) plantacje mateczne przedstawia się do jednej oceny rocznie, którą wykonuje się w okresie letnim – do połowy września,
2) przy rozmnażaniu przez sadzonki zielne i półzdrewniałe ocenę należy przeprowadzić w terminie wcześniejszym,
3) szkółki przedstawia się do jednej oceny rocznie, którą wykonuje się w końcu lata.
Na wniosek producenta rośliny produkowane w pojemnikach mogą być oceniane wcześniej.
W przypadku stwierdzenia nieprawidłowości możliwych do usunięcia może być wyznaczony termin dodatkowej oceny.
Każdy gatunek i odmiana są oznaczone etykietami na początku rzędu lub bloku.
XII. Rośliny sadownicze otrzymane metodą mikrorozmnażania.
1. Izolacja przestrzenna:
1) gatunki i odmiany mnożonych roślin znajdujące się w laboratorium i szklarni są wyraźnie od siebie oddzielone na półkach lub stołach,
2) dla roślin wysadzanych do gruntu izolacja jest taka sama jak dla roślin tych gatunków mnożonych innymi metodami.
2. Czystość odmianowa – wymagana całkowita czystość odmianowa.
3. Wiek – taki sam jak dla roślin tych samych gatunków mnożonych innymi metodami.
4. Rozmnażanie – merystemy lub stożki wzrostu pobiera się z roślin hodowlanych albo przedelitarnych.
5. Zdrowotność – rośliny muszą spełniać takie same wymagania szczegółowe, jakie zostały ustalone dla roślin tych samych gatunków mnożonych innymi metodami.
6. Wymagania dodatkowe.
Jedną ocenę rocznie dokonuje się dla roślin przygotowanych do sprzedaży oraz dla laboratorium celem sprawdzenia wyposażenia w sprzęt, urządzenia i stosowane procedury laboratoryjne.
W przypadku stwierdzenia nieprawidłowości możliwych do usunięcia może być wyznaczony termin dodatkowej oceny.
Rośliny są oznakowane w słoikach, kolbkach, pojemnikach.
7. Świadectwo oceny.
Rośliny są oznaczane dodatkowo literą „M".
Tożsamość odmianową roślin otrzymanych metodą mikrorozmnażania potwierdza laboratorium wykonujące mikrorozmnażanie.
B. Jakość kwalifikowanego i handlowego materiału szkółkarskiego.
I. Materiał szkółkarski spełnia wymagania jakościowe:
1) pełnej czystości gatunkowej i odmianowej,
2) właściwego wyglądu gatunku i odmiany,
3) nie posiada uszkodzeń fizycznych, mechanicznych ani chemicznych,
4) jest wolny od jakichkolwiek wad wynikających z rozmnażania, które mogłyby obniżyć jego przydatność i jakość,
5) jest przygotowany w postaci jednorodnych partii7,
6) jest wolny od organizmów podlegających obowiązkowi zwalczania,
7) na podstawie wizualnej oceny jest uznany za wolny od organizmów wymienionych w pkt B.III,
8) jest praktycznie wolny od innych organizmów, które mogą obniżyć jakość materiału szkółkarskiego.
II. Minimalne wymagania jakościowe materiału szkółkarskiego:
1. Dla drzewek owocowych:
1) wysokość jest nie mniejsza niż 80 cm, mierząc od szyjki korzeniowej,
2) średnica pnia jest nie mniejsza niż 8 mm, mierząc na wysokości 10 cm powyżej miejsca uszlachetniania,
3) korzeń główny i nie mniej niż 3 korzenie boczne albo wiązka korzeni drobnych albo korzenie przerastające całą objętość gleby w pojemniku.
2. Dla krzewów jagodowych:
1) minimum jeden pęd, o długości co najmniej 20 cm, mierząc od nasady do jego wierzchołka albo dobrze wykształcone pąki nasadowe,
2) średnica pędu jest nie mniejsza niż 4 mm, mierząc u nasady pędu,
3) nie mniej niż 3 korzenie szkieletowe albo wiązka korzeni drobnych, albo korzenie przerastające całą objętość gleby w pojemniku.
3. Dla sadzonek truskawek:
1) co najmniej dwa w pełni wykształcone liście albo średnica korony o grubości nie mniejszej niż 4 mm,
2) nie mniej niż 4 korzenie szkieletowe albo wiązka korzeni drobnych, albo korzenie przerastające całą objętość gleby w pojemniku.
4. Dla podkładek generatywnych i wegetatywnych:
1) wysokość dla podkładek wegetatywnych jest nie mniejsza niż 30 cm, mierząc od nasady pędu do jego wierzchołka,
2) wysokość dla podkładek generatywnych jest nie mniejsza niż 20 cm, mierząc od szyjki korzeniowej do wierzchołka pędu,
3) średnica jest nie mniejsza niż 3 mm, mierząc bezpośrednio nad szyjką korzeniową,
4) nie mniej niż 3 korzenie szkieletowe albo wiązka korzeni drobnych, albo korzenie przerastają całą objętość gleby w pojemniku.
Objaśnienie:
7) Partia materiału szkółkarskiego – liczba roślin możliwa do połączenia ze względu na jednorodność składników, takich jak: pochodzenie, gatunek, odmiana,
5. Dla zrazów:
1) długość jest nie mniejsza niż 30 cm,
2) średnica jest nie mniejsza niż 4 mm,
3) co najmniej 5 oczek,
6. Dla innych sadzonek:
1) długość jest nie mniejsza niż 12 cm,
2) średnica jest nie mniejsza niż 4 mm,
3) co najmniej 3 oczka.
7. Dla oczek – określenie liczby wykształconych oczek.
8. Przedsiębiorcy mogą, zgodnie z minimalnymi wymaganiami, o których mowa w pkt. B.II, ustalać własne klasy jakości dla materiału szkółkarskiego wprowadzanego do obrotu.
III. Wykaz chorób i szkodników dla poszczególnych gatunków odmian owocujących i podkładek, od których materiał szkółkarski jest wolny.
Wykaz ma zastosowanie dla handlowego materiału szkółkarskiego oraz kwalifikowanego materiału szkółkarskiego, jeżeli wymagania dotyczące wytwarzania nie są podwyższone.
1. Jabłoń:
1) szkodniki:
a) skośnik brzoskwiniaczek (Anarsia lineatella),
b) bawełnica korówka (Eriosoma lanigerum),
c) tarczniki (Quadraspidiotus perniciosus, Epidiaspis leperii, Pseudaulacaspis pentagona i inne),
2) choroby bakteryjne:
a) guzowatość korzeni (Agrobacterium tumefaciens),
b) rak bakteryjny (Pseudpmonas syringae pv. syringae).
3) choroby grzybowe:
a) opieńka miodowa (Armillariella mellea),
b) srebrzystość liści (Chondrostereum purpureum),
c) rak drzew owocowych (Nectria galligena),
d) zgnilizna pierścieniowa podstawy pnia (Phytophthora cactorum),
e) biała zgnilizna korzeni (Rosellinia necatrix),
f) parch jabłoni (Venturia inaequalis),
g) werticilioza (yerticillium spp.),
4) choroby wirusowe i wirozopodobne – wszystkie.
2. Grusza, pigwa:
1) szkodniki:
a) skośnik brzoskwiniaczek (Anarsia lineatella),
b) bawełnica korówka (Eriosoma lanigerum),
c) tarczniki (Quadraspidiotus perniciosus, Epidiaspis leperii, Pseudaulacaspis pentagona i inne),
2) choroby bakteryjne:
a) guzowatość korzeni (Ągrobacterium tumefaciens),
b) rak bakteryjny (Pseudomonas syringae pv. syringae),
3) choroby grzybowe:
a) opieńka miodowa (Armillariella mellea),
b) srebrzystość liści (Chondrostereum purpureum),
c) rak drzew owocowych (Nectria galligena, Phytopthora spp.),
d) biała zgnilizna korzeni (Rosellinia necatrix),
e) werticiliozy (Verticillium spp.),
4) choroby wirusowe i wirozopodobne – wszystkie.
Objaśnienie:
8) Klasa jakości – wygląd materiału szkółkarskiego zdefiniowany przez podanie cech i parametrów zewnętrznego wyglądu roślin
3. Śliwa, śliwa japońska:
1) szkodniki:
a) pordzewiacz śliwowy (Aculus fockeui),
b) Capnodis tenebrionis,
c) szpeciel śliwowy (Eriophyes similis),
d) guzaki (Meloidogyne spp.),
e) tarczniki (Quadraspidiotus perniciosus, Epidiaspis leperii, Pseudaulacaspis pentagona) i inne,
2) choroby bakteryjne:
a) guzowatość korzeni (Agrobacterium tumefaciens),
b) raki drzew pestkowych (Pseudomonas syringae pv. syringae, Pseudomonas syringae pv. mors prunorum),
3) choroby grzybowe:
a) opieńka miodowa (Armillariella mellea),
b) srebrzystość liści (Chondrostereum purpureum),
c) rak drzew owocowych (Nectria galligena),
d) biała zgnilizna korzeni (Rosellinia necatrix),
e) werticilioza (Verticillium spp.),
4) choroby wirusowe i wirozopodobne:
a) karłowatość śliwy (Prune dwarf virus – PDV),
b) nekrotyczna plamistość pierścieniowa drzew pestkowych (Prunus necrotic ringspot virus – PNRSV),
4. Brzoskwinia, morela:
1) szkodniki:
a) skośnik brzoskwiniaczek (Anarsia lineatella),
b) Capnodis tenebrionis,
c) guzaki (Meloidogyne spp.),
d) tarczniki (Quadraspidiotus perniciosus, Epidiaspis leperii, Pseudaulacaspis pentagona) i inne,
2) choroby bakteryjne:
a) guzowatość korzeni (Agrobacterium tumefaciens),
b) raki drzew pestkowych (Pseudomonas syringae pv.syringae, Pseudomonas syringae pv. mors prunorum),
3) choroby grzybowe:
a) opieńka miodowa (Armillariella mellea),
b) srebrzystość liści (Chondrostereum purpureum),
c) rak drzew owocowych (Nectria galligena),
d) biała plamistość korzeni (Rosellinia necatrix),
e) kędzierzawka liści brzoskwiń (Taphrina deformans),
f) werticilioza (Verticillium spp.),
4) choroby wirusowe i wirozopodobne:
a) karłowatość śliwy (Prune dwarf virus –PDV),
b) nekrotyczna plamistość pierścieniowa drzew pestkowych (Prunus necrotic ringspot virus – PNRSV).
5. Wiśnia, czereśnia:
1) szkodniki:
a) Capnodis tenebrionis,
b) guzaki (Meloidogyne spp.),
c) tarczniki (Quadraspidiotus perniciosus, Epidiaspis leperii, Pseudaulacaspis pentagona) i inne.
2) choroby bakteryjne:
a) guzowatość korzeni (Agrobacterium tumefaciens),
b) raki drzew pestkowych (Pseudomonas syringae pv.syringae, Pseudomonas syringae pv. mors prunorum),
3) choroby grzybowe:
a) opieńka miodowa (Armillariella mellea),
b) srebrzystość liści (Chondrostereum purpureum),
c) rak drzew owocowych (Nectria galligena),
d) biała plamistość korzeni (Rosellinia necatrix),
e) werticilioza (Verticillium spp.),
4) choroby wirusowe i wirozopodobne:
a) karłowatość śliwy (Prune dwarf virus – PDV),
b) nekrotyczna plamistość pierścieniowa drzew pestkowych (Prunus necrotic ringspot virus –PNRSY).
6. Orzech włoski:
1) szkodniki: tarczniki (Quadraspidiotus perniciosus, Epidiaspis leperii, Pseudaulacaspis pentagona) i inne,
2) choroby bakteryjne:
a) guzowatość korzeni (Agrobacterium tumefaciens),
b) bakteryjna zgorzel orzecha włoskiego (Xanthomonas campestris pv. juglandii),
3) choroby grzybowe:
a) opieńka miodowa (Armillariella mellea),
b) rak drzew owocowych (Nectria galligena),
c) srebrzystość liści (Chondrostereum purpureum),
d) zgnilizna podstawy pnia (Phytophthora spp.),
4) choroby wirusowe i wirozopodobne: liściozwój czereśni (Cherry leaf roll virus – CLRV).
7. Leszczyna:
1) szkodniki:
a) wielkopąkowiec leszczynowy (Phytoptus avellanae),
b) tarczniki (Quadraspidiotus perniciosus, Epidiaspis leperii, Pseudaulacaspis pentagona),
2) choroby bakteryjne:
a) guzowatość korzeni (Agrobacterium tumefaciens),
b) bakterioza leszczyny (Xanhomonas campestris pv.corylina),
3) choroby grzybowe:
a) opieńka miodowa (Armillariella mellea),
b) srebrzystość liści (Chondrostereum purpureum),
c) rak drzew owocowych (Nectria galligena),
d) Phyllactina guttata,
e) werticilioza (Verticillium spp.),
4) choroby wirusowe i wirozopodobne:
a) mozaika leszczyny (Apple mosaic virus – ApMV),
b) Hazel maculatura lineare – ML.
8. Truskawka, poziomka:
1) szkodniki:
a) węgorki (Apchelenchoides spp.),
b) niszczyk zjadliwy (Ditylenchus dipsaci),
c) Tarsonemidae,
2) choroby grzybowe:
a) zgnilizna korony truskawki (Phytophthora cactorum),
b) werticilioza (Verticillium spp.),
3) choroby wirusowe i wirozopodobne: zielenienie płatków truskawki (Strawberry green petal phytoplasma – SGP–MLO).
9. Porzeczki, agrest:
1) szkodniki:
a) węgorki (Apchelenchoides spp.),
b) wielkopąkowiec porzeczkowy (Cecidophyopsis ribis),
2) choroby bakteryjne: guzowatość korzeni (Agrobacterium tumefaciens),
3) choroby grzybowe:
a) opieńka miodowa (Armillariella mellea),
b) gruzłek cynobrowy (Nectria cinnabarina),
c) biała zgnilizna korzeni (Rosellinia necatrix),
d) werticilioza (Verticillium spp.),
4) choroby wirusowe i wirozopodobne: rewersja porzeczki czarnej (Black, currant reversion – BRV, Black currant infectious varigation agent).
10. Malina, jeżyna:
1) szkodniki: szpeciel jeżynowiec (Aceria essigi),
2) choroby bakteryjne:
a) włosowatość korzeni (Agrobacterium rhizogenes),
b) guzowatość korzeni (Agrobacterium tumefaciens),
c) staśmienie łodyg (Rhodococcus fascians),
3) choroby grzybowe:
a) opieńka miodowa (Armillariella mellea),
b) zamieranie pędów malin (Didymella applanata),
c) Peronospora rubi,
d) zgnilizna korzeni malin (Phytophthora fragariae var. rubi),
e) werticilioza (Verticillium spp.),
4) choroby wirusowe i wirozopodobne:
a) krzaczasta karłowatość maliny (Raspberry bushy dwarf virus – RBDV),
b) kędzierzawka maliny (Raspberry leaf curl virus – RLCV).
11. Winorośl:
1) szkodniki:
a) zwójka kwasigroneczka (Clysia ambiguella),
b) zwójka krzyżóweczka (Polichrosis botrana),
c) pilśniowiec winoroślowy (Eriophyes vitis),
d) opuchlaki (Othiorrynchus spp.),
e) guzaki (Meloidogyne spp.),
2) choroby grzybowe:
a) mączniak rzekomy winorośli (Plasmopara yiticola),
b) mączniak prawdziwy winorośli (Uncinula necator),
c) czarna zgnilizna winorośli (Guignardia bidwelli),
3) choroby wirusowe i wirozopodobne:
a) wachlarzowatość liści winorośli (Grapevine fan leaf degeneration),
b) liściozwój winorośli (Grapevine leaf roll virus – GLRV).
12. Borówka wysoka:
1) szkodniki:
a) szpeciel pączkowy borówki (Aceria vaccinii),
b) pryszczarek borówkowy (Dasyneura vaccinii),
c) opuchlaki (Othiorrynchus spp.),
2) choroby grzybowe:
a) zamieranie pędów borówki wysokiej (Godronia cassandrae),
b) zgorzel pędów borówki wysokiej (Phomopsis vaccinii),
3) choroby wirusowe i wirozopodobne:
a) wąskolistność borówki (Blueberry shoestring virus),
b) nekrotyczna plamistość pierścieniowa borówki (Necrotic ringspot wywoływany przez Tobacco ringspot virus TobRSV),
c) miotlastość borówki (Blueberry witches broom).
13. Żurawina:
1) szkodniki:
a) miseczniki i tarczniki (Ąspidiotus ancylus, Lecanium nigrofasciatum, Lepidosaphes ulmi),
b) opuchlaki (Othiorrynchus spp.),
2) choroby bakteryjne: guzowatość korzeni (Agrobacterium tumefaciens var. rubi).
3) choroby grzybowe:
a) zamieranie wierzchołków pędów (Monilinia oxycocci),
b) różowienie kwiatów (Exobasidium oxycocci),
4) choroby wirusowe i wirozopodobne: plamistość pierścieniowa żurawiny (Ringspot of cranberry).
Załącznik nr 8
DOPUSZCZALNA WIELKOŚĆ PRODUKCJI W CIĄGU ROKU
MATERIAŁU SIEWNEGO, WARUNKOWO KWALIFIKOWANEGO
DLA POSZCZEGÓLNYCH ROŚLIN (GRUP ROŚLIN)
| Grupa gatunków | Wielkość produkcji |
| I. Rośliny rolnicze: | w decytonach (dt) |
| 1. Zbożowe | 250,00 |
| w tym kukurydza | 30,00 |
| 2. Strączkowe | 60,00 |
| 3. Motylkowe drobnonasienne | 5,00 |
| 4. Trawy pastewne i gazonowe | 6,00 |
| 5. Ziemniak | 800,00 |
| 6. Burak cukrowy i pastewny | 10,00 |
| 7. Pozostałe korzeniowe | 1,50 |
| 8. Oleiste | 6,00 |
| 9. Włókniste | 5,00 |
| 10.Przemysłowe specjalne | 1,00 |
| 11.Pozostałe rolnicze oraz lekarskie i przyprawowe | 1,00 |
| II. Rośliny warzywne: | w kilogramach (kg) |
| 1. Strączkowe i kukurydza | 4000,0 |
| 2. Korzeniowe, ogórek, cebula, szpinak, koper | 400,0 |
| 3. Warzywa pod osłonami (ogórek, pomidor, papryka) | 10,0 |
| 4. Pozostałe gatunki | 100,0 |
| III. Rośliny sadownicze (materiał szkółkarski): | w tys. sztuk |
| 1. Drzewa owocowe | 200,0 |
| 2. Krzewy jagodowe | 200,0 |
| 3. Truskawki | 1000,0 |
| 4. Podkładki drzew owocowych i krzewów jagodowych | 200,0 |
Załącznik nr 9
GATUNKI ROŚLIN UPRAWNYCH, KTÓRE OBEJMUJE ZAKRES INFORMACJI O OBROCIE MATERIAŁEM SIEWNYM
| Lp. | Rośliny uprawne |
| A. Rośliny rolnicze | |
| I. Rośliny zbożowe | |
| 1 | Jęczmień ozimy |
| 2 | Jęczmień jary |
| 3 | Kukurydza |
| 4 | Owies |
| 5 | Pszenica ozima |
| 6 | Pszenica jara |
| 7 | Pszenżyto ozime |
| 8 | Pszenżyto jare |
| 9 | Żyto |
| 10 | Gryka |
| 11 | Proso |
| II. Rośliny strączkowe | |
| 12 | Bobik |
| 13 | Groch siewny – pastewny |
| 14 | Groch siewny – jadalny i ogólnoużytkowe |
| 15 | Łubin żółty |
| 16 | Łubiny – pozostałe gatunki łącznie |
| 17 | Wyki |
| III. Rośliny motylkowate drobnonasienne | |
| 18 | Koniczyna biała |
| 19 | Koniczyna czerwona (łąkowa) |
| 20 | Koniczyna perska |
| 21 | Lucerna (wszystkie gatunki łącznie) |
| 22 | Seradela |
| IV. Trawy gazonowe | |
| 23 | Życica trwała |
| 24 | Wiechlina łąkowa |
| 25 | Kostrzewa czerwona |
| V. Trawy pastewne | |
| 26 | Życica trwała |
| 27 | Wiechlina łąkowa |
| 28 | Kostrzewa czerwona |
| 29 | Kostrzewa łąkowa |
| 30 | Tymotka łąkowa |
| 31 | Życica wielokwiatowa |
| 32 | Kupkówka pospolita |
| 33 | Pozostałe gatunki łącznie |
| VI. Rośliny okopowe | |
| 34 | Burak cukrowy |
| 35 | Burak pastewny |
| 36 | Ziemniak |
| VII. Rośliny oleiste | |
| 37 | Rzepak ozimy |
| 38 | Rzepak jary |
| 39 | Rzepik ozimy |
| 40 | Gorczyca |
| B. Rośliny warzywne | |
| 41 | Cebula |
| 42 | Ogórek gruntowy |
| 43 | Ogórek pod osłony |
| 44 | Kalafior |
| 45 | Kapusta głowiasta biała |
| 46 | Burak ćwikłowy |
| 47 | Marchew jadalna |
| 48 | Pietruszka korzeniowa |
| 49 | Seler korzeniowy |
| 50 | Pomidor gruntowy |
| 51 | Pomidor pod osłony |
| 52 | Fasola na suche nasiona |
| 53 | Fasola szparagowa zielonostrąkowa |
| 54 | Fasola szparagowa żółtostrąkowa |
| 55 | Groch łuskowy– odmiany wczesne i średniowczesne |
| 56 | Groch łuskowy – odmiany średniopóźne i późne |
Załącznik nr 10
WYKAZ POPULACJI MIEJSCOWYCH MAJĄCYCH SZCZEGÓLNE ZNACZENIE DLA OCHRONY RÓŻNORODNOŚCI BIOLOGICZNEJ
| | Odmiana |
| 1. Phaseolus coccineus L. Fasola wielokwiatowa – biczykowa | z Kraśnika |
| 2. Phaseolus coccineus L. Fasola wielokwiatowa – biczykowa | z Kasilanu |
| 3. Phaseolus coccineus L. Fasola wielokwiatowa – biczykowa | z Tyszowca |
| 4. Phaseolus coccineus L. Fasola wielokwiatowa – tyczna | Piękny Jaś |
| 5. Allium sepa L. Cebula | Lubartowska |
| 6. Lycopersicon esculentum Mill. Pomidor | Malinowy – Bawole Serce |
| 7. Malus sp. Jabłoń | Szara Reneta |
| 8. Malus sp. Jabłoń | Złota Reneta |
| (Parmena, Królowa Renet) | |
| 9. Malus sp. Jabłoń | Glogierówka |
| 10. Malus sp. Jabłoń | Ananas Berżeniecki |
| 11. Malus sp. Jabłoń | Antonówka Półtorafuntowa |
| 12. Malus sp. Jabłoń | Kronselska |
| 13. Malus sp. Jabłoń | Malinowa Oberlandzka |
| 14. Malus sp. Jabłoń | Kosztela |
| 15. Malus sp. Jabłoń | Grafsztynek |
| 16. Malus sp. Jabłoń | Różanka |
| 17. Malus sp. Jabłoń | Złota Kwidzyńska |
| (Złota Nebrowska) | |
| 18. Malus sp. Jabłoń | Grochówka |
| 19. Pirus sp. Grusza | Cytrynówka |
| 20. Prunus sp. Wiśnia | Sokówka |
| 21. Prunus sp. Czereśnia | Nieszawska |
| 22. Prunus sp. Śliwa | Węgierka Łowicka |
Załącznik nr 11
STAWKI OPŁATY HODOWLANEJ
| Roślina uprawna lub grupa roślin | Wysokość opłaty wyrażona w procentach wartości sprzedanego materiału siewnego1 | Wysokość opłaty wyrażonej w złotych |
| 1 | 2 | 3 |
| I. Rośliny rolnicze: |
|
|
| 1. Pszenica ozima i jara | - | 4,80 zł/q |
| 2. Jęczmień ozimy i jary, pszenżyto ozime i jare, żyto, owies | - | 4,00 zł/q |
| 3. Proso, gryka | - | 5,00 zł/q |
| 4. Wyka jara i ozima | - | 10,00 zł/q |
| 5. Łubin wąskolistny | - | 8,00 zł/q |
| 6. Łubin żółty | - | 10,00 zł/q |
| 7. Pozostałe strączkowe (motylkowate grubonasienne) | - | 5,00 zł/q |
| 8. Motylkowate drobnonasienne: |
|
|
| a) koniczyna czerwona, koniczyna biała, koniczyna szwedzka, koniczyna perska, lucerna siewna, lucerna chmielowa, lucerna mieszańcowa, komonica zwyczajna |
| 50,00 zł/q |
| b) seradela, esparceta, inkarnatka, nostrzyk |
| 25,00 zł/q |
| 9. Trawy pastewne: |
|
|
| a) życica trwała, życica wielokwiatowa, życica mieszańcowa, życica westerwoldzka, kupkówka pospolita |
| 14,00 zł/q |
| b) kostrzewa łąkowa, kostrzewa czerwona, kostrzewa różnolistna, tymotka łąkowa, wiechlina łąkowa, mozga trzcinowata, rajgras wyniosły, stokłosa bezostna, stokłosa uniolowata |
| 20,00 zł/q |
| c) pozostałe trawy pastewne |
| 26,00 zł/q |
| 10. Trawy gazonowe: |
|
|
| a) życica trwała | - | 21,00 zł/q |
| b) kostrzewa czerwona, kostrzewa różnolistna, wiechlina łąkowa | - | 30,00 zł/q |
| c) pozostałe trawy gazonowe | - | 39,00 zł/q |
| 11. Burak cukrowy | 10 | - |
| 12. Burak pastewny | 5 | - |
| 13. Inne korzeniowe pastewne | 5 | - |
| 14. Ziemniak | 4 | - |
| 1 | 2 | 3 |
| 15. Len | - | 16,00zł/q |
| 16. Konopie | - | 30,00 zł/q |
| 17. Rzepak ozimy i jary, rzepik ozimy, rzodkiew oleista | - | 20,00 zł/q |
| 18. Gorczyca biała i sarepska | - | 9,00 zł/q |
| 19. Facelia | - | 20,00 zł/q |
| 20. Kukurydza sprzedawana wg wagi | - | 30,00 zł/q |
| 21. Kukurydza sprzedawana w jednostkach siewnych | - | 5,00 zł/50 tys. nasion |
| 22. Tytoń i machorka | 8 | - |
| 23. Inne rośliny pastewne | 5 | - |
| 24. Lekarskie | 8 | - |
| II. Rośliny ogrodnicze: | ||
| 1. Cebula, ogórek gruntowy, bób, fasola, ogórek szklarniowy, kapustne, sałata, szpinak, por, dynia, melon, kawon, cukinia | 8 | - |
| 2. Burak ćwikłowy, marchew, groch, rzodkiewka, rzodkiew | 7 | - |
| 3. Kukurydza cukrowa i pękająca, pomidor gruntowy, papryka szklarniowa i gruntowa | 10 | - |
| 4. Pomidor szklarniowy | 5 | - |
| 5. Czosnek, pietruszka, seler, koper | 6 | - |
| 6. Inne warzywa | 5 | - |
| 7. Rośliny przyprawowe | 8 | - |
| 8. Grzyby jadalne | 8 | - |
| 9. Drzewa, krzewy, truskawka | 4 | - |
| 10. Rośliny ozdobne rozmnażane z nasion: begonia stale kwitnąca, lewkonia letnia, petunia ogrodowa, szałwia błyszcząca, werbena ogrodowa, stokrotka pospolita, cyklamen perski, pantofelnik ogrodowy, starzec popielny | 8 | - |
| 11 Inne rośliny ozdobne rozmnażane z nasion | 6 | - |
| 12. Rośliny ozdobne rozmnażane wegetatywnie | 3 | - |
Objaśnienie:
1 Opłatę hodowlaną ustala się od ceny sprzedaży kwalifikowanego materiału siewnego przed pomniejszeniem jej o udzieloną bonifikatę.
[1] Rozporządzenie wchodzi w życie 18 października 2001 r.
- Data ogłoszenia: 2001-10-03
- Data wejścia w życie: 2001-10-18
- Data obowiązywania: 2002-03-01
- Dokument traci ważność: 2004-05-01
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA

