REKLAMA
Dziennik Ustaw - rok 1998 nr 154 poz. 1011
ROZPORZĄDZENIE MINISTRA ROLNICTWA I GOSPODARKI ŻYWNOŚCIOWEJ
z dnia 11 grudnia 1998 r.
w sprawie sposobu badania zwierząt rzeźnych, badania, oceny i znakowania mięsa, wykorzystania mięsa o ograniczonej przydatności do spożycia, mięsa niezdatnego do spożycia oraz prowadzenia dokumentacji z tym związanej.
Na podstawie art. 32 pkt 1 ustawy z dnia 24 kwietnia 1997 r. o zwalczaniu chorób zakaźnych zwierząt, badaniu zwierząt rzeźnych i mięsa oraz o Państwowej Inspekcji Weterynaryjnej (Dz. U. Nr 60, poz. 369 i z 1998 r. Nr 106, poz. 668) zarządza się, co następuje:
2. Badanie przedubojowe partii drobiu może ograniczyć się do zbadania skutków urazów mechanicznych powstałych w czasie transportu do rzeźni, jeżeli od jego badania w celu wystawienia świadectwa zdrowia upłynęły nie więcej niż 24 godziny.
1) nie wykazują objawów chorób zakaźnych lub podejrzenia o zakażenie,
2) wykazują inne objawy chorobowe lub zaburzenia ogólne albo inne objawy szczególnie wskazujące, że są pod wpływem działania środków farmakologicznych lub innych substancji mających wpływ na ocenę mięsa,
3) są zmęczone lub nadmiernie pobudzone w przypadku bydła, świń, owiec, kóz i zwierząt jednokopytnych.
2. Lekarz weterynarii przeprowadzający badanie przedubojowe powinien również sprawdzić, czy zwierzęta były przewożone do rzeźni zgodnie z wymogami określonymi w odrębnych przepisach.
3. Zmęczone lub nadmiernie pobudzone zwierzęta, o których mowa w ust. 1 pkt 3, powinny odpoczywać przez 24 godziny, chyba że lekarz weterynarii dokonujący badania przedubojowego zadecyduje inaczej.
2. Badanie, o którym mowa w ust. 1, w razie potrzeby może być uzupełnione o badania laboratoryjne, w tym na obecność pozostałości substancji farmakologicznych.
2. Badanie poubojowe bydła, świń, owiec, kóz i zwierząt jednokopytnych obejmuje:
1) oględziny ubitego zwierzęcia oraz jego narządów wewnętrznych,
2) omacywanie narządów wewnętrznych,
3) nacinanie niektórych narządów wewnętrznych i węzłów chłonnych,
4) badanie konsystencji, zabarwienia i zapachu tuszy zwierzęcia,
5) badanie na wągrzycę u świń i bydła, które powinno obejmować oględziny powierzchni mięśni, a przede wszystkim mięśni: uda, filarów przepony, mięśni międzykostnych, serca, języka i krtani,
6) badanie na nosaciznę zwierząt jednokopytnych, które powinno obejmować oględziny błon śluzowych tchawicy, krtani, jam nosowych, zatok i ich rozgałęzień, po uprzednim przepołowieniu głowy w kierunku podłużnym oraz po wycięciu przegrody nosowej,
7) badanie na włośnie mięsa świń i zwierząt jednokopytnych,
8) w razie konieczności badania laboratoryjne.
3. Narządy wewnętrzne, w których w czasie oględzin lub omacywania stwierdzono zmiany anatomopatologiczne, powinny być nacinane w taki sposób, aby niemożliwe było zanieczyszczenie tusz, wyposażenia, personelu lub pomieszczeń.
4. Szczegółowy sposób badania poubojowego zwierząt, o których mowa w ust. 2, określa załącznik nr 1 do rozporządzenia.
1) tusze – po wewnętrznej stronie ud,
2) głowy
– przez ich ostemplowanie lub wypalenie znaku.
2. Znakowania, o którym mowa w ust. 1, można również dokonać za pomocą okrągłego znaku umieszczonego na etykiecie wykonanej z trwałego materiału, przymocowanej do każdej tuszy lub jej każdej części, w sposób uniemożliwiający powtórne użycie etykiety.
3. Znak, o którym mowa w ust. 2, powinien zawierać czytelnie umieszczoną w kierunku środka literę „T", pod którą znajdują się litery „IW", o wymiarach określonych w ust. 1.
1) oględziny zwierzęcia poddanego ubojowi,
2) w razie konieczności, omacywanie i nacinanie tuszki i narządów wewnętrznych zwierzęcia poddanego ubojowi,
3) badanie konsystencji, zabarwienia, zapachu tuszki i narządów wewnętrznych zwierzęcia poddanego ubojowi,
4) w razie potrzeby badania laboratoryjne.
1) oględziny zwierzęcia poddanego ubojowi,
2) omacywanie lub w razie konieczności nacinanie płuc, wątroby, śledziony, nerek oraz tych części tuszki zwierzęcia, w których występują zmiany,
3) badanie konsystencji, zabarwienia, zapachu tuszki i narządów wewnętrznych zwierzęcia poddanego ubojowi,
4) w razie potrzeby badania laboratoryjne.
2. Badanie po odstrzeleniu obejmuje:
1) oględziny dziczyzny i jej narządów wewnętrznych po otworzeniu jamy ciała, przy czym, jeżeli wyniki oględzin nie pozwalają na dokonanie oceny, należy przeprowadzić badania laboratoryjne, które, z wyjątkiem badania na włośnie, mogą ograniczać się do zbadania ilości próbek wystarczającej do oceny ogółu dziczyzny odstrzelonej podczas polowania,
2) badanie konsystencji, zabarwienia i zapachu tuszy i narządów wewnętrznych zwierzęcia,
3) omacywanie narządów wewnętrznych, jeżeli lekarz weterynarii uzna to za konieczne,
4) wzdłużne rozpołowienie kręgosłupa i głowy dziczyzny, jeżeli lekarz weterynarii uzna to za konieczne.
3. W przypadku wątpliwości, lekarz weterynarii może dokonać nacięć i innych badań odpowiednich części tuszy dziczyzny, koniecznych do dokonania oceny mięsa.
2. Znak weterynaryjny jest umieszczany za pomocą stempla lub poprzez wypalenie albo w formie nalepek lub wykonanych z trwałego materiału zawieszek, lub plomb, w kształcie i rozmiarach tego znaku.
3. Do stemplowania mięsa zwierząt jednokopytnych należy używać tuszu koloru brązowego, a do mięsa pozostałych zwierząt – koloru niebieskiego.
4. Narzędzia i przyrządy do znakowania mięsa wydane przez lekarza weterynarii, o którym mowa w art. 26 ust. 2 ustawy z dnia 24 kwietnia 1997 r. o zwalczaniu chorób zakaźnych zwierząt, badaniu zwierząt rzeźnych i mięsa oraz o Państwowej Inspekcji Weterynaryjnej (Dz. U. Nr 60, poz. 369 i z 1998 r. Nr 106, poz. 668), zwanego dalej „urzędowym lekarzem weterynarii", przechowuje uprawniony do badania lekarz weterynarii.
1) w górnej części litery „PL" o wysokości 0,8 cm,
2) w środku numer weterynaryjny rzeźni o wysokości cyfr 1 cm,
3) w dolnej części litery „IW" o wysokości 0,8 cm
2. Mięso bydła, świń, owiec, kóz i zwierząt jednokopytnych o ograniczonej przydatności do spożycia stempluje się prostokątnym znakiem weterynaryjnym o wymiarach 3,5 cm na 4 cm, a niezdatne do spożycia – znakiem weterynaryjnym w kształcie trójkąta równobocznego o długości boku 5 cm, zawierającymi litery i numer, wymienione w ust. 1.
3. Rozmiary znaków weterynaryjnych, w tym liter i cyfr, mogą być zmniejszone dla znakowania tusz jagniąt, koźląt i prosiąt; oznakowanie tych tusz może być również dokonane poprzez zamieszczenie znaku weterynaryjnego na nalepce jednorazowego użycia lub zawieszce dołączonej do tuszy.
4. Znak weterynaryjny na tuszy powinien być naniesiony przy użyciu stempla lub wypalony, przy czym:
1) tusze ważące powyżej 65 kg powinny być oznakowane na każdej półtuszy przynajmniej na zewnętrznych powierzchniach ud, lędźwi, pleców, piersi i barku,
2) tusze jagniąt, koźląt i prosiąt powinny być oznakowane po każdej stronie tuszy na barku lub zewnętrznej powierzchni ud,
3) tusze nie wymienione w pkt 1 i 2 powinny być oznakowane co najmniej w czterech miejscach – na barku lub zewnętrznej powierzchni ud.
5. Nie opakowane podroby powinny być ostemplowane, a na wątrobach bydła, świń i zwierząt jednokopytnych przeznaczonych na eksport znak weterynaryjny należy wypalić.
1) w górnej części litery „PL" o wysokości 0,2 cm,
2) w środku numer weterynaryjny rzeźni o wysokości cyfr 0,2 cm,
3) w dolnej części litery „IW" o wysokości 0,2 cm.
2. Mięso drobiu, królików i nutrii niezdatne do spożycia znakuje się znakiem weterynaryjnym w kształcie trójkąta równobocznego o długości boku 2 cm, zawierającym litery i numer, wymienione w ust. 1.
3. Znakowanie mięsa drobiu, królików i nutrii zdatnego do spożycia polega na:
1) umieszczeniu zawieszki w części grzbietowej każdej tuszki, w przypadku gdy tuszki nie są opakowane,
2) umieszczeniu znaku weterynaryjnego na opakowaniu bezpośrednim i umieszczeniu znaku weterynaryjnego na etykiecie opakowania pośredniego, z tym że znak weterynaryjny na etykiecie powinien być szerokości 6,5 cm i długości 4,5 cm; wysokość liter powinna wynosić 0,8 cm, a cyfr – 1,0 cm.
1) podstawa długości 6,5 cm,
2) wysokość boku 2,5 cm,
3) wysokość pięciokąta od podstawy 4,5 cm,
zawierającym w górnej części litery „PL", w środku numer weterynaryjny zakładu przetwórstwa lub rozbioru mięsa dziczyzny albo w przypadku mięsa dzików – numer lekarza weterynarii z krajowej listy lekarsko-weterynaryjnej, który przeprowadził badanie, a w dolnej części litery „IW".
2. Wysokość liter znaku powinna wynosić 0,8 cm, a cyfr 1 cm – dla oznakowania mięsa zwierząt łownych kopytnych, a dla oznakowania mięsa dzikiego ptactwa i innych zwierząt łownych – 0,2 cm.
3. Znakowanie dziczyzny, o którym mowa w ust. 1, polega na:
1) umieszczeniu znaku weterynaryjnego na tuszach,
2) umieszczeniu znaku weterynaryjnego bezpośrednio na opakowanych tuszach lub ich częściach.
4. Mięso dziczyzny niezdatne do spożycia oznacza się znakiem weterynaryjnym w kształcie trójkąta równobocznego o długości boku 2 cm z zamieszczonymi literami i numerami określonymi w ust. 1 i 2.
1) w górnej części nazwę województwa,
2) w środku numer lekarza weterynarii z krajowej listy lekarsko-weterynaryjnej, który przeprowadził badanie,
3) w dolnej części litery „IW"
2. Mięso pozyskane ze zwierząt poddanych ubojowi poza rzeźnią znakuje się stemplem prostokątnym o wymiarach 3 cm i 5 cm, zawierającym wykonany drukowanymi literami napis „MIĘSO DO WŁASNEGO UŻYTKU".
1) dziennik badania przedubojowego zwierząt,
2) dziennik badania poubojowego zwierząt rzeźnych i dziczyzny.
2. Dzienniki, o których mowa w ust. 1, wydawane są lekarzom weterynarii przez urzędowego lekarza weterynarii.
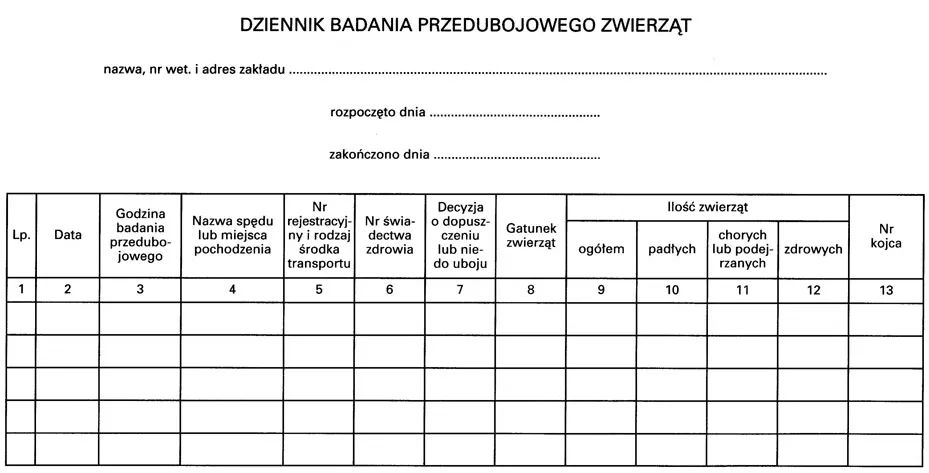
3. Dziennik, o którym mowa w ust. 1 pkt 1, powinien w szczególności zawierać:
1) liczbę, rodzaj lub gatunek zwierząt dopuszczonych w danym dniu do uboju oraz imię, nazwisko i adres zamieszkania albo nazwę i siedzibę posiadaczy tych zwierząt,
2) wydane zakazy uboju i przyczyny ich wydania;
wzór dziennika badania przedubojowego zwierząt określa załącznik nr 4 do rozporządzenia.
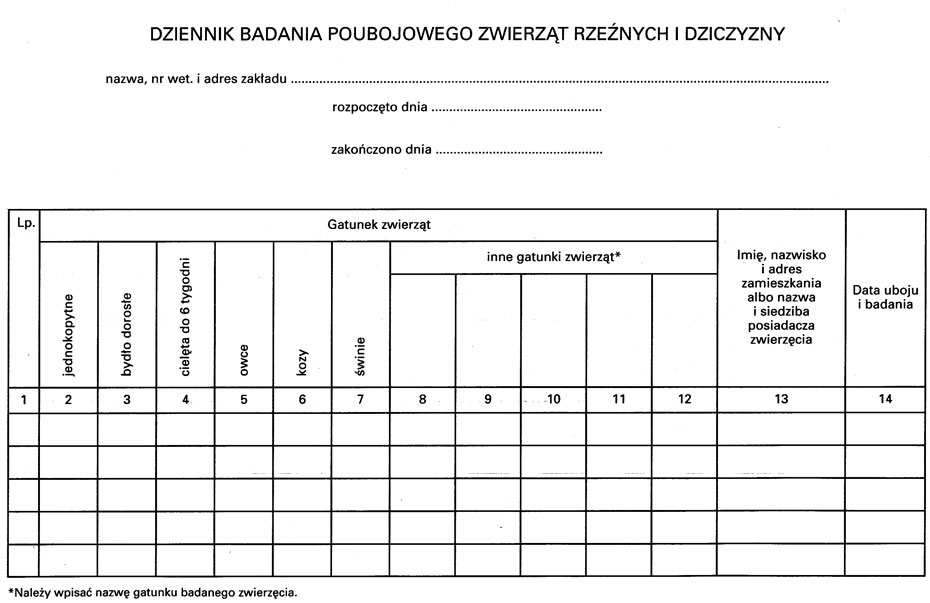
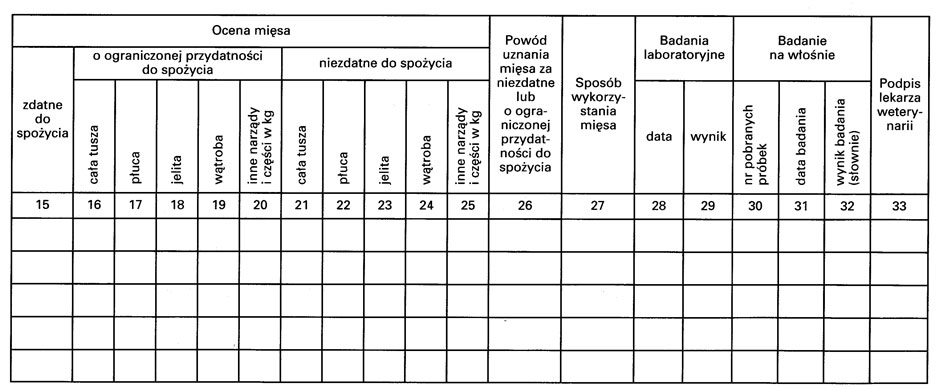
4. Dziennik, o którym mowa w ust. 1 pkt 2, powinien w szczególności zawierać:
1) sposób przeprowadzenia badania i jego wyniki,
2) ustalone sposoby wykorzystania mięsa o ograniczonej przydatności do spożycia lub mięsa niezdatnego do spożycia;
wzór dziennika badania poubojowego zwierząt rzeźnych i dziczyzny określa załącznik nr 5 do rozporządzenia.
Minister Rolnictwa i Gospodarki Żywnościowej: w. z. R. Brzezik
Załączniki do rozporządzenia Ministra Rolnictwa i Gospodarki Żywnościowej
z dnia 11 grudnia 1998 r. (poz. 1011)
Załącznik nr 1
BADANIE POUBOJOWE BYDŁA, ŚWIŃ, OWIEC, KÓZ I ZWIERZĄT JEDNOKOPYTNYCH
1. Badanie bydła powyżej sześciu tygodni życia obejmuje:
1) oględziny głowy oraz jamy gardłowej; węzły chłonne pozagardłowe, podszczękowe i przyusznicze powinny być nacięte i zbadane; zbadanie mięśni żwaczowych, w których należy wykonać dwa równolegle do skrzydła żuchwy nacięcia, oraz mięśni żuchwy (wewnętrznych mięśni skrzydełkowych), które powinny być nacięte wzdłuż ich płaszczyzny; język, po wcześniejszym jego uwolnieniu, pozwalającym na szczegółowe oględziny jamy ustnej i gardła, powinien zostać poddany oględzinom i omacywaniu; migdałki powinny zostać usunięte,
2) badanie tchawicy; oględziny i omacywanie płuc i przełyku; węzły chłonne tchawiczno-oskrzelowe i śródpiersiowe powinny być nacięte i zbadane; tchawica i główne pnie oskrzelowe powinny być przecięte wzdłuż ich przebiegu, a płuca powinny być nacięte poprzecznie do ich osi, przy czym nacięcia te nie są konieczne, jeżeli płuca nie są przeznaczone do spożycia przez ludzi,
3) oględziny worka osierdziowego i serca; serce powinno zostać przecięte podłużnym cięciem, w celu otworzenia komór oraz przecięcia podłużnego przegrody międzykomorowej,
4) oględziny przepony,
5) oględziny i omacywanie wątroby oraz węzłów chłonnych wątrobowych i trzustkowych; nacięcie powierzchni żołądkowej wątroby oraz podstawy jej płata doogonowego w celu zbadania przewodów żółciowych; badanie i omacywanie węzłów chłonnych trzustki,
6) oględziny przewodu pokarmowego, krezki, węzłów chłonnych żołądkowych i krezkowych; omacywanie węzłów chłonnych żołądkowych i krezkowych, a w razie potrzeby ich nacięcie,
7) oględziny, a w razie potrzeby, omacywanie śledziony,
8) oględziny nerek, a w razie potrzeby nacięcie nerek i węzłów chłonnych nerkowych,
9) oględziny opłucnej i otrzewnej,
10) oględziny organów płciowych,
11) oględziny, a w razie potrzeby omacywanie i nacięcie wymienia i przynależnych węzłów chłonnych; u krów obie połowy wymienia powinny być przecięte długim cięciem poprowadzonym w taki sposób, aby zatoki mleczne oraz węzły chłonne wymienia zostały nacięte, przy czym nie jest to konieczne, jeśli wymię nie jest przeznaczone do spożycia przez ludzi.
2. Badanie bydła poniżej sześciu tygodni życia obejmuje:
1) oględziny głowy i jamy gardłowej; węzły chłonne zagardłowe powinny być nacięte i zbadane; jama ustna i gardłowa powinna być sprawdzona, a język poddany omacywaniu; migdałki powinny być usunięte,
2) oględziny płuc, tchawicy i przełyku; omacywanie płuc; węzły chłonne tchawiczno-oskrzelowe i śródpiersiowe powinny być nacięte i zbadane,
3) oględziny worka osierdziowego i serca; serce powinno zostać przecięte podłużnym cięciem, w celu otwarcia komór oraz przecięcia podłużnego przegrody międzykomorowej,
4) oględziny przepony,
5) oględziny wątroby oraz węzłów chłonnych wątrobowych i trzustkowych; omacywanie, a w razie potrzeby nacięcie wątroby oraz jej węzłów chłonnych,
6) oględziny przewodu pokarmowego, krezki, węzłów chłonnych żołądkowych i krezkowych, a w razie potrzeby ich nacięcie,
7) oględziny, a w razie potrzeby omacywanie śledziony,
8) oględziny nerek, a w razie potrzeby nacięcie nerek i węzłów chłonnych nerkowych,
9) oględziny opłucnej i otrzewnej,
10) oględziny i omacywanie okolic pępowiny oraz stawów; w przypadku wątpliwości okolice pępowiny powinny zostać nacięte, a stawy otwarte; płyn maziowy powinien zostać zbadany.
3. Badanie świń obejmuje:
1) oględziny głowy i jamy gardłowej; węzły chłonne podszczękowe powinny być nacięte i zbadane; jama ustna i gardłowa oraz język powinny być poddane oględzinom, omacywaniu i ewentualnym nacięciom; migdałki powinny zostać usunięte,
2) oględziny płuc, tchawicy i przełyku; omacywanie płuc oraz węzłów chłonnych tchawiczno-oskrzelowych i śródpiersiowych; tchawica i główne pnie oskrzelowe powinny być przecięte wzdłuż ich przebiegu, a płuca powinny być nacięte poprzecznie do ich osi w dolnej jednej trzeciej, przy czym nacięcia te nie są konieczne, jeżeli płuca nie są przeznaczone do spożycia przez ludzi,
3) oględziny worka osierdziowego i serca; serce powinno zostać przecięte podłużnym cięciem, w celu otworzenia komór oraz przecięcia podłużnego przegrody międzykomorowej,
4) oględziny przepony,
5) oględziny wątroby oraz węzłów chłonnych wątrobowych i trzustkowych; omacywanie wątroby oraz jej węzłów chłonnych,
6) oględziny przewodu pokarmowego, krezki, węzłów chłonnych żołądkowych i krezkowych; omacywanie węzłów chłonnych żołądkowych i krezkowych, a w razie potrzeby ich nacięcie,
7) oględziny, a w razie potrzeby omacywanie śledziony,
8) oględziny nerek i, jeśli to konieczne, nacięcie nerek i węzłów chłonnych nerkowych,
9) oględziny opłucnej i otrzewnej,
10) oględziny organów płciowych,
11) oględziny i omacywanie wymienia i przynależnych węzłów chłonnych; nacięcie węzłów chłonnych nadwymieniowych u macior.
4. Badanie owiec i kóz obejmuje:
1) oględziny głowy po zdjęciu skóry oraz w przypadku wątpliwości badanie jamy ustnej, gardła, języka i węzłów chłonnych zagardłowych oraz przyuszniczych, przy czym badanie to nie jest konieczne, jeżeli głowa wraz z językiem i mózgiem nie będzie przeznaczona do spożycia przez ludzi,
2) oględziny płuc, tchawicy i przełyku; omacywanie płuc oraz węzłów chłonnych tchawiczno-oskrzelowych i śródpiersiowych; w razie wątpliwości organy te oraz przynależne do nich węzły chłonne należy naciąć i zbadać,
3) oględziny worka osierdziowego i serca, a w razie wątpliwości jego przecięcie i zbadanie,
4) oględziny przepony,
5) oględziny wątroby oraz węzłów chłonnych wątrobowych i trzustkowych; omacywanie wątroby oraz jej węzłów chłonnych; nacięcie żołądkowej części wątroby w celu zbadania przewodów wątrobowych,
6) oględziny przewodu pokarmowego, krezki, węzłów chłonnych żołądkowych i krezkowych,
7) oględziny, a w razie potrzeby omacywanie śledziony,
8) oględziny nerek, a w razie potrzeby nacięcie nerek i węzłów chłonnych nerkowych,
9) oględziny opłucnej i otrzewnej,
10) oględziny organów płciowych,
11) oględziny wymienia wraz z węzłami chłonnymi,
12) oględziny i omacywanie okolic pępowiny oraz stawów u młodych zwierząt; w razie wątpliwości okolice pępowiny należy naciąć, a stawy otworzyć.
5. Badanie zwierząt jednokopytnych obejmuje:
1) oględziny głowy oraz po uwolnieniu języka – jamy gardłowej; zbadanie, a w razie potrzeby nacięcie węzłów chłonnych pozagardłowych, podszczękowych i przyuszniczych; język po jego wcześniejszym uwolnieniu pozwalającym na szczegółowe oględziny jamy ustnej i gardła należy poddać oględzinom i omacywaniu; migdałki należy usunąć,
2) oględziny płuc, tchawicy i przełyku; omacywanie płuc; nacięcie i zbadanie węzłów tchawiczno-oskrzelowych i śródpiersiowych; tchawicę i główne pnie oskrzelowe należy przeciąć wzdłuż ich przebiegu, a płuca – poprzecznie do ich osi w dolnej jednej trzeciej, przy czym nacięcia te nie są konieczne, jeżeli płuca nie są przeznaczone do spożycia przez ludzi,
3) oględziny worka osierdziowego i serca; serce należy przeciąć podłużnie, w celu otwarcia komór oraz przecięcia podłużnego przegrody międzykomorowej,
4) oględziny przepony,
5) oględziny wątroby oraz węzłów chłonnych wątrobowych i trzustkowych; omacywanie wątroby oraz jej węzłów chłonnych, a w razie potrzeby nacięcie wątroby oraz węzłów chłonnych wątrobowych i trzustkowych,
6) oględziny przewodu pokarmowego, krezki, węzłów chłonnych żołądkowych i krezkowych, a w razie potrzeby nacięcie tych węzłów; w przypadkach wątpliwych można dokonać dalszych nacięć i badań odpowiednich części ciała zwierzęcia, jeśli są one niezbędne dla podjęcia ostatecznej oceny; jeżeli nacięcia węzłów chłonnych są obligatoryjne, to węzły powinny być najpierw plasterkowane, a następnie dokładnie oglądane.
7) oględziny, a w razie potrzeby omacywanie śledziony,
8) oględziny nerek, a w razie potrzeby ich nacięcie wraz z węzłami chłonnymi,
9) oględziny opłucnej i otrzewnej,
10) oględziny organów płciowych ogierów i klaczy,
11) oględziny i omacywanie wymienia i przynależnych węzłów chłonnych, a w razie potrzeby nacięcie węzłów chłonnych nadwymieniowych,
12) oględziny i omacywanie okolic pępowiny oraz stawów u młodych zwierząt; w razie wątpliwości okolice pępowiny należy naciąć, a stawy otworzyć,
13) wszystkie siwe konie należy zbadać na występowanie czerniako-mięsaków w mięśniach i węzłach chłonnych przez wykonanie głębokich cięć pod łopatkami poniżej chrząstki łopatkowej; nerki należy wyodrębnić i zbadać poprzez wykonanie nacięcia przez cały miąższ organu.
6. W przypadkach wątpliwych można dokonać dalszych nacięć i badań odpowiednich części ciała zwierzęcia, jeśli są one niezbędne do podjęcia ostatecznej oceny.
7. Jeżeli nacięcia węzłów chłonnych są obligatoryjne, to węzły te powinny być najpierw plasterkowane, a następnie dokładnie oglądane.
Załącznik nr 2
METODY BADANIA NA OBECNOŚĆ WŁOŚNI
I. Badanie trychinoskopowe
1. Sprzęt i odczynniki:
1) trychinoskop o powiększeniu 50 x i 80–100 x,
2) kompresor składający się z dwóch płytek szklanych, z których jedna jest podzielona na równe obszary,
3) małe zakrzywione nożyczki,
4) pinceta, nóż do wycinania próbek,
5) małe ponumerowane pojemniki do oddzielnego przechowywania próbek,
6) zakraplacz,
7) kwas octowy i roztwór wodorotlenku potasu do rozjaśniania zwapnień lub zmiękczania suszonego mięsa.
2. Pobieranie próbek:
1) w przypadku całych tusz, należy pobrać przynajmniej jedną próbkę wielkości orzecha laskowego z obu filarów przepony na przejściu w część ścięgnistą,
2) jeżeli jest tylko jeden filar przepony, należy pobrać jedną próbkę wielkości orzecha laskowego,
3) w przypadku braku obu filarów przepony, należy pobrać dwie próbki o przybliżonej wielkości orzecha laskowego z części żebrowej lub mostkowej przepony lub też z mięśni okołojęzykowych, żuchwowych lub brzusznych,
4) w przypadku części tuszy, należy pobrać z każdej części trzy próbki mięśni szkieletowych, zawierające małą ilość tłuszczu, jeżeli to możliwe – wielkości orzecha laskowego z różnych miejsc, w miarę możliwości położonych blisko kości i ścięgien.
3. Metoda:
1) jeżeli są oba filary przepony, trychinoskopista powinien wyciąć z każdej z próbek pobranych z całej tuszy siedem skrawków o rozmiarze ziarna owsa – łącznie 14 skrawków, a jeżeli tylko jeden filar przepony – 14 skrawków z różnych miejsc, jeżeli to możliwe, z przejścia w część ścięgnistą,
2) w przypadku całych tusz, próbki trzeba pobrać z części żebrowej lub mostkowej przepony, mięśni okołojęzykowych, żuchwowych lub mięśni brzusznych; należy wyciąć 14 skrawków wielkości ziarna owsa z każdej próbki, łącznie 28,
3) trychinoskopista powinien ścisnąć skrawki między płytkami szklanymi w taki sposób, aby można było przez przygotowany diapozytyw odczytać normalny druk,
4) jeżeli mięso próbek do badania jest suche i stare, preparaty powinny być zmiękczane w mieszance jednej części roztworu wodorotlenku potasu na dwie części wody przez 10 do 20 minut przed rozpoczęciem badania,
5) z każdej próbki pobranej z części tuszy trychinoskopista powinien wyciąć cztery skrawki rozmiaru ziarna owsa, łącznie 12 skrawków,
6) badanie trychinoskopowe należy przeprowadzać w taki sposób, aby każdy preparat byt przejrzany powoli i uważnie,
7) jeżeli badanie trychinoskopowe nasuwa podejrzenie, którego charakteru nie można określić z całą pewnością, nawet przy największym powiększeniu trychinoskopu, należy je sprawdzić mikroskopem,
8) badanie trychinoskopowe należy przeprowadzać w taki sposób, aby każdy preparat był przejrzany powoli i uważnie, w powiększeniu 30 – 40 x,
9) w przypadku niepewnego wyniku, badanie należy kontynuować na większej liczbie próbek i preparatów diapozytywowych, w razie konieczności – z pomocą większych powiększeń, aż do otrzymania wymaganych informacji,
10) badanie trychinoskopowe należy przeprowadzać przez przynajmniej trzy minuty, z tym że w przypadku próbek zastępczych, pobranych z części żebrowej lub mostkowej przepony, mięśni okołojęzykowych, żuchwowych lub mięśni brzusznych, należy je przeprowadzać przez przynajmniej sześć minut; minimalny czas ustalony dla badania nie zawiera czasu koniecznego do pobierania próbek i przygotowania preparatów,
11) trychinoskopista nie powinien sprawdzić więcej niż 840 skrawków dziennie; w wyjątkowych przypadkach dopuszcza się zbadanie do 1050 skrawków dziennie.
II. Metoda wytrawiania
1. Sprzęt i materiał:
1) nóż do pobierania próbek,
2) małe ponumerowane pojemniki z zamknięciem, do przechowywania próbek, w razie konieczności do powtórzenia badania,
3) cieplarka,
4) 2–3-litrowy rozdzielacz szklany ze statywem, gumowy przewód łączący, klamry do mocowania przewodu łączącego,
5) sito plastikowe (o średnicy ok. 18 cm i o średnicy otworów ok. 1 mm),
6) gaza,
7) mała, stożkowa kolba ze szczelnym zamknięciem,
8) zlewka szklana,
9) rozdrabniacz mięsa,
10) stereomikroskop (powiększenie 15–40 x) z odpowiednim źródłem światła,
11) płyn wytrawiający sporządzony w następujący sposób: 10 g pepsyny (1200 u/g; 80 u/g FIP), 5 ml HCI (przynajmniej 37%), dopełnione do objętości 1 litra wodą.
2. Pobieranie próbek:
1) w przypadku całych tusz, należy pobrać próbkę o wadze przynajmniej 20 g z filaru przepony przy przejściu do części ścięgnistej,
2) w przypadku braku filarów przepony, należy pobrać próbki o wadze przynajmniej 20 g z części żebrowej lub mostkowej przepony, lub z mięśni okołojęzykowych czy mięśni żuchwowych, lub też z mięśni brzusznych,
3) w przypadku części tuszy, należy pobrać próbkę o wadze przynajmniej 20 g z mięśni szkieletowych, jeśli to możliwe bez tłuszczu, z miejsc położonych blisko kości lub ścięgien.
3. Metoda:
1) dla badania łącznej próbki mięsa z 10 świń należy przygotować po 10 g z każdej pojedynczej próbki 20-gramowej, a pozostałe 10 g zatrzymać na wypadek, gdyby dodatkowe badanie pojedynczej próbki okazało się konieczne,
2) 10 próbek, każda o wadze 10 g, należy połączyć w jedną próbkę; należy ją rozdrobnić w rozdrabniaczu mięsa (z otworami średnicy 2 mm) i rozmieścić luźno na sicie wyścielonym warstwą gazy, które należy następnie umieścić na lejku nałożonym na rozdzielacz połączony przewodem gumowym z małą stożkową kolbą; rozdzielacz należy napełniać do krawędzi płynem wytrawiającym do momentu, w którym materiał badany nie zostanie przykryty. Proporcje materiału poddanego badaniu do płynu wytrawiającego powinny wynosić w przybliżeniu 1 : 20 do 1 : 30,
3) po 18–20 godzinach inkubacji w temperaturze 37–39°C należy odłączyć stożkową kolbę, po czym, po ostrożnym odciągnięciu cieczy sklarowanej nad osadem, osad znajdujący się w końcówce kolby ostrożnie przenieść na płytkę, a następnie przebadać na obecność włośni za pomocą stereomikroskopu o powiększeniu 20–40-krotnym,
4) w przypadku pozytywnego lub niepewnego wyniku próbki łącznej, należy przebadać pozostałe pojedyncze próbki, każdą z osobna po dodaniu do nich dalszych 20 g próbek z mięsa każdej świni, lub w wypadku części tusz, po dodaniu 20 g próbki z mięsa każdej części, zgodnie z ust. 2.
III. Metoda wytrawiania prób zbiorczych
1. Sprzęt i odczynniki:
1) nóż i pinceta do pobierania próbek,
2) rozdrabniacz mięsa z otworami 2 do 3 mm,
3) kolba Erlenmeyera o pojemności 3 ml z korkiem gumowym lub bawełnianowełnianym,
4) rozdzielacz stożkowy oddzielający o pojemności 2000 ml,
5) statyw długości ok. 28 cm z 80-centymetrowym korpusem,
6) pierścień średnicy 10 lub 11 cm przymocowany do statywu,
7) uchwyt z płaskimi zaciskami (23 x 40 mm), który może być przymocowany do statywu z podwójną złączką,
8) sito (o oczkach 177 mikronów) o zewnętrznej średnicy 11 cm z siatką mosiężną lub ze stali nierdzewnej,
9) plastikowy lejek z wewnętrzną średnicą nie mniejszą niż 12 cm,
10) stereomikroskop (powiększenie 15–40 x) z odpowiednim źródłem światła lub trychinoskop ze stołem poziomym,
11) w przypadku stosowania trychinoskopu: rynienka do liczenia larw o pojemności ok. 60–65 cm3, która wykonana jest z akrylowych płytek o grubości 3 mm w ten sposób, że dno rynienki, podzielone na pola, ma wymiary 180 x 40 mm, boki mają wymiary 230 x 20 mm, a szczyty – 40 x 20 mm. Dno i szczyty rynienki powinny być umieszczone pomiędzy jej bokami, co utworzy w ten sposób dwa uchwyty na końcach. Dno rynienki powinno być wyniesione 7–9 mm od podstawy ramy utworzonej przez boki i szczyty. Części rynienki powinny być zespojone klejem odpowiednim dla tworzywa,
12) płytki Petriego o średnicy 9 cm, w przypadku używania stereomikroskopu, podzielone od spodu na pola 10 x 10 mm,
13) kalibrowane 100 ml szklane cylindry,
14) stężony (37%) kwas solny,
15) pepsyna o mocy 1 : 10 000 NF (Narodowy Receptariusz USA) odpowiadającej 1 : 12 500 BP (Farmakopea Brytyjska) lub 2000 FIP (Międzynarodowa Federacja Farmacji),
16) tace odpowiednie do zgromadzenia 50 dwugramowych prób,
17) waga z dokładnością do 0,1 g.
2. Pobieranie prób:
1) w przypadku całych tusz należy pobrać próbę o wadze ok. 2 g z filaru przepony w przejściu do części ścięgnistej,
2) w przypadku braku filarów przepony należy pobrać próbkę o wadze ok. 2 g z części żebrowej lub mostkowej przepony, z mięśni okołojęzykowych lub żuchwowych lub z mięśni brzusznych,
3) w przypadku kawałków mięsa należy pobrać próbkę o wadze ok. 2 g z mięśni szkieletowych, o małej zawartości tłuszczu, w miarę możliwości z miejsca w pobliżu kości lub ścięgien.
3. Metoda:
1) tworzenie próby zbiorczej ze 100 próbek:
a) należy pobrać próbkę o wadze ok. 1 g z każdej z pojedynczych próbek pobranych z mięsa 100 świń, a następnie umieścić je w rozdrabniaczu mięsa,
b) rozdrobnione mięso należy umieścić w trzylitrowej kolbie Erlenmeyera razem z 7 g pepsyny, 2 litrami wody podgrzanej do temperatury 40–41°C i 25 ml stężonego kwasu solnego, a następnie wstrząsnąć mieszanką w celu rozpuszczenia pepsyny; zasadowość roztworu powinna wynosić 1,5–2,0 pH,
c) dla ułatwienia wytrawiania kolba Erlenmeyera powinna być umieszczona w cieplarce o temperaturze 40–41°C na ok. 4 godziny; w tym czasie kolbę należy regularnie wstrząsać, co najmniej 2 razy na godzinę,
d) roztwór po wytrawieniu należy przefiltrować przez sito do rozdzielacza o pojemności 2 litrów i pozostawić na stojaku przez przynajmniej 1 godzinę,
e) uzyskany płyn o objętości ok. 45 ml należy przelać do kalibrowanego cylindra, a następnie rozdzielić na trzy płytki Petriego, po 15 ml na każdą płytkę, której dno jest podzielone na kwadraciki 10 x 10 mm,
f) każda płytka Petriego powinna być badana przez 1 minutę na obecność larw pod stereomikroskopem,
g) przy stosowaniu rynienek do liczenia larw uzyskany płyn należy równo rozdzielić na dwie rynienki i badać pod trychinoskopem; płyn powinien być badany niezwłocznie,
h) jeżeli płyn jest mętny lub nie został zbadany w czasie 30 minut od jego pozyskania, należy oczyścić go w następujący sposób:
– 45 ml pozyskanego płynu przelewa się do kalibrowanego cylindra i pozostawia na 10 minut,
– po upływie tego czasu poprzez zassanie odejmuje się 30 ml supernatantu, a pozostałe 15 ml uzupełnia się do 45 ml wodą,
– po upływie kolejnych 10 minut ponownie 30 ml supernatantu usuwa się, a pozostałe 15 ml przelewa się na płytkę Petriego lub na rynienkę do liczenia larw,
i) kalibrowany cylinder należy opłukać 10 ml wody, a następnie przelać ją na płytkę Petriego lub na rynienkę do liczenia larw,
2) tworzenie próby zbiorczej z mniej niż 100 prób:
a) jeżeli jest mniej niż 15 pojedynczych prób, mogą być one dodane do próby zbiorczej i badane razem,
b) jeżeli jest badane więcej niż 15, a mniej niż 100 prób, objętość płynu wytrawiającego powinna być proporcjonalnie zmniejszona,
3) w przypadku pozytywnego lub wątpliwego wyniku badania próby zbiorczej, należy:
a) dalsze 20 g próby pobrać od każdej świni, zgodnie z ust. 2,
b) 20 g próby od każdej świni połączyć i badać metodą określoną w pkt 1 i 2,
c) w sposób określony w lit. a) i b) badać próby z 20 świń po 5 świń każda,
d) jeżeli włośnie są wykryte w próbie zbiorczej od 5 świń, dalsze 20 g próby powinno być pobierane oddzielnie, zgodnie z ust. 2.
IV. Metoda mechanicznie wspomaganego wytrawiania próby zbiorczej (technika sedymentacji)
1. Sprzęt i odczynniki:
1) nóż i nożyczki,
2) tace z ponumerowanymi polami na 50 prób mięsa, po 2 g każda,
3) stomacher 3 500 thermomodel,
4) plastikowe torebki do stomachera,
5) stożkowe rozdzielacze o pojemności 2 I zaopatrzone w teflonowe zatyczki,
6) statywy, pierścienie, zaciski,
7) sito o otworach 177 mikronów, średnicy zewnętrznej 11 cm i siatka ze stali nierdzewnej,
8) lejki o wewnętrznej średnicy nie mniejszej niż 12 cm do stabilizacji sit,
9) 100 ml szklane, kalibrowane cylindry,
10) 25 ml rozdzielacz,
11) zlewki o pojemności 3 I,
12) łyżka lub szklany pręt do mieszania roztworu w zlewce,
13) plastikowe: strzykawka i wężyk do odsysania,
14) miarka o pojemności 6 g,
15) termometr o dokładności +/-0,5°C i o zakresie od 1 do 100°C,
16) elektryczny potrząsacz z odejmowaną głowicą (wibrator),
17) minutnik pracujący w przedziałach 1 minuty,
18) trichinoskop z poziomym pulpitem lub stereomikroskop z odpowiednim źródłem światła,
19) rynienka do liczenia larw wykonana w sposób określony w części III ust. 1 pkt 11, jeżeli stosowany jest trichinoskop,
20) płytki Petriego o średnicy 9 cm podzielone od spodu na pola badań o wymiarach 10 x 10 mm,
21) 17,5% roztwór kwasu solnego,
22) pepsyna odpowiadająca wymaganiom określonym w części III ust. 1 pkt 15,
23) 10 I pojemniki do dekontaminacji formaliną sprzętu i pozostałego płynu wytrawiającego,
24) waga z dokładnością do 0,1 g.
2. Próbki pobiera się zgodnie z ust. 2 części III.
3. Metoda:
1) sposób wytrawiania:
a) próba zbiorcza 100 próbek:
– stomacher powinien być zaopatrzony w podwójną plastikową torebkę i urządzenie do utrzymania temperatury 40–41°C,
– 1,5 I wody podgrzanej do temperatury 32–35°C należy przelać do wewnętrznej torebki plastikowej i następnie wodę podgrzać do temperatury 40–41°C,
– 25 ml 17,5% kwasu solnego dodaje się do wody w stomacherze,
– następnie należy dodać 100 próbek o wadze 1 g każda (o temperaturze 25–30°C), pobranych z każdej indywidualnej próby zgodnie z ust. 2,
– na końcu należy dodać 6 g pepsyny,
– zawartość stomachera należy odstawić na 25 minut,
– następnie torebkę wyjmuje się ze stomachera, a płyn wytrawiający filtruje się przez sito do 3 l zlewki,
– plastikową torebkę przepłukuje się 100 ml wody, a następnie przez sito przelewa się ją do filtratu w zlewce,
b) próba zbiorcza złożona z mniej niż 100 próbek:
– stomacher powinien być zaopatrzony w podwójną plastikową torebkę i urządzenie do utrzymania temperatury 40–41°C,
– płyn wytrawiający sporządza się przez wymieszanie ok. 1,5 I wody, 25 ml 17,5% kwasu solnego i 6 g pepsyny przy zachowaniu temperatury 40–41°C,
– z płynu wytrawiającego należy odmierzyć 15 ml na 1 g próbki i tę ilość płynu z próbkami 1 g o temperaturze 25–30°C przenieść do wewnętrznej torebki,
– wodę o temperaturze 41°C przelewa się do zewnętrznej torebki, tak aby całkowita objętość w obu torebkach wynosiła 1,5 I,
– zawartość stomachera należy odstawić na 25 minut,
– następnie torebkę wyjmuje się ze stomachera, a płyn wytrawiający filtruje się przez sito do 3 I zlewki,
– plastikową torebkę przepłukuje się w 100 ml wody, którą następnie przelewa się przez sito do filtratu w zlewce,
2) oddzielanie larw metodą sedymentacji:
a) lód o wadze 300–400 g w płatkach, łuskach lub pokruszony dodaje się do płynu wytrawiającego, doprowadzając jego objętość do 2 I, a następnie płyn ten miesza się do rozpuszczenia lodu, przy czym w przypadku mniejszej próby zbiorczej, określonej w pkt 1 lit. b), ilość lodu powinna być odpowiednio zmniejszona,
b) wychłodzony płyn wytrawiający przenosi się do 2 I rozdzielacza, wyposażonego w wibrator,
c) sedymentacja powinna trwać 30 minut, przy czym wirowanie odbywa się w sposób przerywany, tj. 1 minuta wirowania i 1 minuta przerwy,
d) po 30 minutach wirowania, 60 ml sedymentu przenoszone jest bezzwłocznie do 100 ml kalibrowanego cylindra,
e) 60 ml sedyment odstawia się co najmniej na 10 minut, a następnie supernatant odsysa się, pozostawiając 15 ml do badania na obecność larw,
f) do odsysania stosuje się plastikową strzykawkę połączoną z plastikowym przewodem,
g) pozostałe 15 ml przelewa się do rynienki do liczenia larw lub dwu płytek Petriego i bada się pod trichinoskopem lub stereomikroskopem,
h) płyn wytrawiający powinien być badany niezwłocznie,
i) jeżeli płyn wytrawiający jest mętny lub nie został zbadany w czasie 30 minut, po jego sporządzeniu należy:
– 60 ml próbkę końcową przelać do kalibrowanego cylindra i pozostawić na 10 minut,
– po upływie 10 minut odessać 45 ml supernatantu, a pozostałe 15 ml uzupełnić wodą do objętości 45 ml,
– po upływie następnych 10 minut odessać 30 ml supernatantu, a pozostałe 15 ml przelać na płytkę Petriego lub rynienkę do przeprowadzania badania,
j) kalibrowany cylinder przepłukuje się 10 ml wody, którą następnie należy dodać do rynienki lub płytki Petriego,
3) w przypadkach pozytywnych lub wątpliwych wyników, należy postępować w sposób określony w części III ust. 3 pkt 3.
V. Metoda mechanicznie wspomaganego wytrawiania próby zbiorczej (technika izolacji filtrowej)
1. Sprzęt i odczynniki:
1) wymienione w ust. 1 części IV,
2) litrowy rozdzielacz (Gelmana) wyposażony w uchwyt filtru (średnica 45 mm),
3) płytki filtrów składające się z okrągłej siatki ze stali nierdzewnej z oczkami o średnicy 35 mikronów (średnica płytki 45 mm),
4) dwa gumowe pierścienie grubości 1 mm , średnicy zewnętrznej 45 mm i wewnętrznej 38 mm, z umieszczoną pomiędzy nimi okrągłą siatką, umocowaną do nich dwuskładnikowym klejem odpowiednim dla tych materiałów,
5) zlewka Erlenmeyera o pojemności 3 I zaopatrzona w boczny wężyk do odsysania,
6) pompa filtrująca,
7) plastikowe torebki o pojemności co najmniej 80 ml,
8) sprzęt do zgrzewania torebek,
9) rennina o mocy 1:1 500 000 jednostek Soxleta na 1 g.
2. Próbki pobiera się zgodnie z ust. 2 części III.
3. Metoda:
1) do sposobu wytrawiania stosuje się odpowiednio do wielkości próby część IV ust. 3 pkt 1,
2) oddzielanie larw przez filtrowanie:
a) lód o wadze 300–400 g w płatkach, łuskach lub pokruszony dodaje się do płynu wytrawiającego, doprowadzając jego objętość do 2 I, przy czym w przypadku mniejszej próby zbiorczej, ilość lodu powinna być odpowiednio zmniejszona,
b) płyn wytrawiający miesza się do czasu rozpuszczenia lodu,
c) następnie płyn ten pozostawia się co najmniej na 3 minuty,
d) rozdzielacz (Gelmana) zaopatrzony w uchwyt i płytkę filtrującą umieszcza się w zlewce Erlenmeyera połączonej z pompą filtrującą,
e) płyn wytrawiający przelewa się do rozdzielacza (Gelmana), a następnie filtruje; pod koniec filtrowania przechodzenie płynu wytrawiającego przez filtr może być wspomagane zasysaniem z pompy filtrującej, przy czym zasysanie powinno być przerwane, zanim filtr stanie się suchy, tj. kiedy 2 do 5 ml płynu pozostanie w rozdzielaczu,
f) po zakończeniu filtrowania płynu wytrawiającego dysk filtru należy wyjąć i umieścić w torebce o pojemności 80 ml razem z 15–20 ml roztworu renniny, który sporządza się przez dodanie 2 g renniny do 100 ml wody; filtry nie mogą być używane, jeśli nie są zupełnie czyste; filtrów nie oczyszczonych nie należy suszyć; filtry te powinny być oczyszczone przez pozostawienie ich w roztworze renniny na noc; przed użyciem powinny być umyte w świeżym roztworze renniny z użyciem stomachera,
g) torebkę plastikową zgrzewa się dwukrotnie i umieszcza w stomacherze pomiędzy wewnętrzną i zewnętrzną torebką,
h) stomacher pozostawia się na 3 minuty niezależnie od tego, czy pracuje na pełnej, czy niepełnej próbie zbiorczej,
i) po 3 minutach torebkę plastikową z dyskiem filtru i roztworem renniny wyjmuje się ze stomachera i otwiera nożyczkami, płyn przelewa się do rynienki do liczenia larw lub płytki Petriego, a torebkę przepłukuje się 5–10 ml wody, którą przelewa się do rynienki do badania pod trichinoskopem lub płytki Petriego do badania pod stereomikroskopem,
j) płyn powinien być badany bezzwłocznie,
3) w przypadku pozytywnych lub wątpliwych wyników należy postępować w sposób określony w ust. 3 pkt 3 części III.
VI. Metoda wytrawiania próby zbiorczej z zastosowaniem metody magnetycznego mieszania
1. Sprzęt i odczynniki:
1) nóż i nożyczki do sporządzania próbek,
2) tace z oznaczonymi 50 polami do przetrzymywania próbek o wadze 2 g każda,
3) rozdrabniacz mięśni (Moulinette),
4) mieszadła magnetyczne, z płytką o temperaturze regulowanej termostatem i pokrytymi teflonem prętami mieszającymi, o długości ok. 5 cm,
5) rozdzielacze stożkowe o pojemności 2 I,
6) statywy, pierścienie, uchwyty,
7) sito o siatce ze stali nierdzewnej z oczkami 177 mikronów o średnicy zewnętrznej 11 cm,
8) lejki o średnicy wewnętrznej nie mniejszej niż 12 cm, do umieszczenia sit,
9) zlewka o pojemności 3 I,
10) kalibrowane cylindry o pojemności ok. 50 ml lub cylindry wirówkowe,
11) trichinoskop z poziomym pulpitem lub stereomikroskop z odpowiednim źródłem światła,
12) rynienka do liczenia larw, wykonana w sposób określony w części III ust. 1 pkt 11, jeżeli stosowany jest trichinoskop,
13) płytki Petriego średnicy 9 cm, podzielone od spodu na pola 10 x 10 mm, jeżeli stosowany jest stereomikroskop,
14) folia aluminiowa,
15) 25% kwas solny,
16) pepsyna odpowiadająca wymaganiom określonym w części III ust. 1 pkt 15,
17) woda podgrzana do 46–48°C,
18) 10 I pojemniki do dekontaminacji formaliną sprzętu i pozostałego płynu wytrawiającego,
19) waga z dokładnością do 0,1 g.
2. Próbki pobiera się zgodnie z ust. 2 części III.
3. Metoda:
1) tworzenie próby zbiorczej ze 100 próbek:
a) 100 próbek, każda ważąca 1g, pobrane z pojedynczych próbek rozdrabniane są w rozdrabniaczu (Moulinette),
b) rozdrobnione mięso przenoszone jest do 3-litrowej zlewki i traktowane 10 g pepsyny, a 2 litry wody podgrzanej do 46–48°C przelewa się do zlewki razem z 16 ml kwasu solnego,
c) wkładkę mieszającą rozdrabniacza natychmiast wkłada się do płynu do wytrawiania w zlewce, żeby oddzielić przyczepione skrawki mięśni,
d) pręcik mieszający umieszcza się w zlewce, którą przykrywa się folią aluminiową,
e) zlewkę umieszcza się na podgrzanej płytce grzewczej mieszadła magnetycznego i wtedy zaczyna się proces mieszania; przed rozpoczęciem mieszania należy upewnić się, że mieszadło utrzymywać będzie stałą temperaturę 44–46°C w całym procesie mieszania, podczas którego należy uzyskać maksymalne wirowanie płynu,
f) płyn wytrawiający mieszany jest 30 minut, po czym wyłącza się mieszadło, a płyn przelewa się przez sito do rozdzielacza sedymentacyjnego,
g) płyn w rozdzielaczu odstawia się na 30 minut,
h) po 30 minutach płyn z osadem w ilości 40 ml gwałtownie spuszcza się do kalibrowanego cylindra lub cylindra wirówki,
i) próbę 40 ml pozostawia się na 10 minut, a następnie odsysa się 30 ml supernatantu, pozostawiając 10 ml,
j) pozostałe 10 ml osadu przelewa się do rynienki lub płytki Petriego,
k) następnie cylinder przepłukuje się 10 ml wody, którą dodaje się do rynienki lub płytki Petriego i bada się pod trichinoskopem lub stereomikroskopem,
l) badanie należy wykonywać bezzwłocznie,
ł) jeżeli badanie nie zostało przeprowadzone w czasie 30 minut supernatant powinien być oczyszczony w sposób następujący:
– końcową próbę 40 ml przelewa się do kalibrowanego cylindra i pozostawia na 10 minut,
– 30 ml supernatantu usuwa się pozostawiając 10 ml, które uzupełnia się wodą do 40 ml,
– po upływie dalszych 10 minut 30 ml supernatantu odsysa się pozostawiając 10 ml do badania na płytce Petriego lub rynience,
– cylinder przepłukuje się 10 ml wody, którą dodaje się do płytki Petriego lub rynienki i poddaje badaniu,
m) jeżeli osad w czasie badania jest mętny, próba powinna być przelana do kalibrowanego cylindra, uzupełniona do 40 ml wodą; następnie należy postępować w sposób określony w lit. ł),
2) próba zbiorcza składająca się z mniej niż 100 próbek:
a) w razie potrzeby nie więcej niż 15 próbek 1-gramowych może być dodane do próby zbiorczej złożonej ze 100 próbek i badane razem, zgodnie z pkt 1,
b) więcej niż 15 próbek należy badać jako oddzielną próbę zbiorczą,
c) dla prób złożonych z nie więcej niż 50 próbek objętość płynu wytrawiającego powinna być zredukowana do 1 litra,
3) w przypadku pozytywnych lub wątpliwych wyników, należy postępować w sposób określony w części III ust. 3 pkt 3.
VII. Metoda automatycznego wytrawiania dla prób zbiorczych o wadze do 35 g
1. Sprzęt i odczynniki:
1) nóż i nożyczki do sporządzania próbek,
2) tace z oznaczonymi 50 polami do przetrzymywania próbek o wadze 2 g każda,
3) Trichomat 35 z wkładem filtrującym,
4) roztwór kwasu solnego 8,5% = 0,5 wagi,
5) przezroczyste, membranowe filtry z wielowęglanów o średnicy 50 mm i porami 14 mikronów,
6) pepsyna odpowiadająca wymaganiom określonym w części III ust. 1 pkt 15,
7) waga z dokładnością do 0,1 g,
8) pincetka płaska,
9) szkiełka podstawowe o boku co najmniej 5 cm lub płytki Petriego z oznaczonymi od spodu polami 10 x 10 mm,
10) stereomikroskop ze zmienną siłą światła i powiększaniu 15–60 x lub trychinoskop z poziomym pulpitem,
11) pojemnik do gromadzenia zużytych płynów,
12) 10 I pojemniki do dekontaminacji formaliną sprzętu i pozostałego płynu wytrawiającego.
2. Próbki pobiera się zgodnie z ust. 2 części III.
3. Metoda:
1) proces wytrawiania:
a) mieszadło z wkładem filtrującym należy połączyć przewodem z pojemnikiem do gromadzenia zużytych płynów,
b) po włączeniu mieszadła należy włączyć podgrzewanie, przedtem jednak zawór umieszczony poniżej komory należy najpierw otworzyć, a następnie zamknąć,
c) następnie dodaje się 35 prób o wadze ok. 1g każda i o temperaturze 25–30°C, pobranych z każdej z indywidualnych prób, przy czym większe kawałki ścięgien powinny być usunięte,
d) ok. 400 ml wody należy przelać do stożkowej części komory na płyny, połączonej z mieszadłem,
e) należy dodać ok. 30 ml kwasu solnego (8,5%) do części stożkowej mniejszej, podłączonej do komory na płyny,
f) należy umieścić filtr membranowy pod filtrem normalnym znajdującym się w uchwycie wkładu filtrującego,
g) na końcu należy dodać 7 g pepsyny,
h) zamknąć komorę roboczą i na płyny,
i) dostosować czas wytrawiania (5–8 minut), właściwy do wieku ubojowego zwierząt,
j) automatyczne dawkowanie rozpoczyna się po wciśnięciu przycisku na mieszadle i wtedy wytrawianie połączone z filtrowaniem przebiega automatycznie; po 10–13 minutach procedura jest zakończona i zatrzymuje się automatycznie,
k) po zdjęciu przykrywki komory właściwej (roboczej) należy sprawdzić, czy jest ona opróżniona; jeśli nadal pozostają: piana lub resztki płynu wytrawiającego, należy powtórzyć procedurę podaną w pkt 5,
2) oddzielanie larw:
a) wymontować uchwyt filtru i przenieść filtr membranowy na szkiełko podstawowe lub płytkę Petriego,
b) filtr ten należy następnie badać pod trichinoskopem lub stereomikroskopem,
3) czyszczenie sprzętu:
a) w przypadku wyniku pozytywnego, komorę właściwą (roboczą) do 2/3 należy wypełnić wrzącą wodą,
b) do komory na płyny należy dodać wodę do momentu, gdy przykryty jest czujnik poziomu minimalnego,
c) po wykonaniu czynności wymienionych pod lit. a) i b) należy włączyć automatyczny proces czyszczenia,
d) uchwyt filtru razem z pozostałym sprzętem należy oczyścić,
e) po dniu pracy należy napełnić wodą komorę na płyny i wykonać program czyszczenia, zgodnie z lit. a)–d),
4) stosowanie filtrów membranowych:
a) każdy filtr może być używany nie więcej niż 5 razy,
b) po każdym użyciu filtr powinien być odwracany i sprawdzany, czy nie uległ uszkodzeniu, co czyniłoby go nieodpowiednim do dalszego użycia,
5) metoda stosowana w przypadkach, gdy wytrawianie nie jest całkowite, a w związku z tym nie doszło do filtrowania:
Jeżeli automatyczny proces przebiegał zgodnie z pkt 1, należy zdjąć przykrywkę komory właściwej (roboczej) i sprawdzić, czy nie pozostała w niej piana lub resztki płynu. Jeśli tak, to należy:
a) zamknąć zawór dolny komory właściwej (roboczej),
b) wymontować uchwyt filtru, a filtr membranowy przenieść na szkiełko podstawowe lub płytkę Petriego,
c) w uchwycie zamontować nowy filtr membranowy i zamontować ten uchwyt,
d) do komory na płyny dolać wodę aż do przykrycia czujnika poziomu minimalnego,
e) włączyć automatyczny program czyszczenia,
f) po zakończeniu tego programu sprawdzić komorę właściwą (roboczą) na pozostałość płynu,
g) po opróżnieniu komory wymontować uchwyt filtru, a filtr membranowy przenieść pincetką na szkiełko podstawowe lub płytkę Petriego,
h) zgodnie z pkt 2 zbadać dwa filtry membranowe, a jeśli badanie nie jest możliwe, powtórzyć proces wytrawiania z zastosowaniem wydłużonego czasu, zgodnie z pkt 1,
6) w przypadku pozytywnego lub wątpliwego wyniku badania próby zbiorczej, dalsze 20 g należy pobrać od każdej świni, zgodnie z ust. 2, i próbki te zbadać indywidualnie.
Załącznik nr 3
OCENA MIĘSA
I. Mięso bydła, świń, owiec, kóz i zwierząt jednokopytnych
1. Za niezdatne do spożycia należy uznać:
1) mięso, jeżeli badanie potwierdzi, że zwierzę, z którego mięso pochodzi, było dotknięte jedną z następujących chorób:
a) pryszczyca,
b) pęcherzykowe zapalenie jamy ustnej,
c) choroba pęcherzykowa świń,
d) pomór bydła,
e) pomór małych przeżuwaczy,
f) zaraza płucna bydła,
g) guzowata choroba skóry bydła albo kliniczna postać białaczki bydła,
h) gorączka doliny Rift albo gorączka Q,
i) choroba niebieskiego języka,
j) ospa owiec i kóz,
k) afrykański pomór koni,
I) afrykański pomór świń,
ł) pomór świń,
m) wąglik,
n) gąbczasta encefalopatia bydła,
o) ogólna aktinobacyloza, promienica, gruźlica albo uogólnione zapalenie węzłów chłonnych,
p) szelestnica,
r) nosacizna,
s) wścieklizna,
t) tężec albo botulizm,
u) salmoneloza albo bruceloza,
w) różyca świń,
x) kliniczna postać leptospirozy świń, bydła, owiec i kóz,
y) posocznica, ropnica, toksemia albo wiremia,
z) włośnica, uogólniona sarkocystoza i uogólniona wągrzyca,
2) mięso ze zwierząt wykazujących ostre zmiany chorobowe przy zapaleniu oskrzeli i płuc, zapaleniu opłucnej, zapaleniu otrzewnej, zapaleniu macicy, zapaleniu wymienia, zapaleniu stawów, zapaleniu osierdzia, zapaleniu jelit oraz zapaleniu mózgu i opon mózgowych, potwierdzone szczegółowym badaniem, a jeżeli to możliwe – uzupełnione badaniem mikrobiologicznym i badaniem pozostałości substancji o działaniu farmakologicznym, przy czym, jeżeli wyniki tych badań specjalnych będą pozytywne, tusza może być uznana za zdatną do spożycia po wcześniejszym usunięciu części niezdatnych do spożycia,
3) mięso ze zwierząt:
a) nie narodzonych,
b) młodych, jeżeli jest zbyt wodniste,
c) wykazujących objawy wychudzenia lub zaawansowanej anemii,
d) wykazujących liczne guzy, ropnie lub poważne rany w różnych miejscach tuszy lub różnych miejscach narządów wewnętrznych,
e) które reagowały dodatnio lub wątpliwie w teście na brucelozę, jeżeli stwierdzone zostały zmiany chorobowe wskazujące na ostrą infekcję, nawet w przypadku gdy nie zostały stwierdzone zmiany w wymieniu, układzie rozrodczym oraz we krwi,
4) narządy wewnętrzne lub części tuszy ze zmianami gruźliczymi, pochodzące od zwierząt, które wykazywały wynik dodatni lub wątpliwy w przeprowadzonej przed ubojem śródskórnej próbie tuberkulinowej, z tym że jeżeli zmiany gruźlicze są stwierdzone wyłącznie w węzłach chłonnych, za niezdatne do spożycia należy również uznać organ lub część tuszy, do których przynależą te węzły chłonne,
5) części tuszy z poważnymi wylewami krwotocznymi, ograniczonymi ropniami lub zlokalizowanymi zanieczyszczeniami,
6) narządy wewnętrzne ze zmianami patologicznymi o pochodzeniu zakaźnym, pasożytniczym lub urazowym,
7) mięso ze zwierząt, które wykazywały podwyższoną ciepłotę ciała,
8) mięso, które wykazywało nieprawidłowości dotyczące zabarwienia, zapachu i konsystencji,
9) poszczególne narządy wewnętrzne z przynależnymi do nich węzłami chłonnymi, jeżeli tusza lub narządy wewnętrzne zawierają ogniska zapalenia serowaciejącego lub stany ropne, przy czym zmiany te nie są uogólnione albo związane z wychudzeniem i znajdują się na powierzchni lub w samej tkance narządu lub węzła chłonnego,
10) mięso pochodzące z wycięcia okolicy rany kłucia powstałej podczas wykrwawiania,
11) tusze, których narządy wewnętrzne nie podlegały badaniu poubojowemu,
12) krew zwierzęcia, którego mięso uznane zostało za niezdatne do spożycia, oraz krew zanieczyszczoną zawartością żołądka lub inną substancją,
13) mięso ze zwierząt, którym podawano:
a) substancje niedozwolone,
b) produkty, które mogą spowodować, że mięso będzie niebezpieczne lub szkodliwe dla zdrowia ludzi,
c) substancje wpływające na kruchość mięsa,
14) mięso zawierające pozostałości substancji dodatkowych dozwolonych, pozostałości środków farmaceutycznych, w tym antybiotyków, pestycydów lub innych substancji szkodliwych dla zdrowia ludzi, w przypadku gdy przekraczają one dozwolony poziom określony odrębnymi przepisami,
15) wątrobę i nerki zwierząt starszych niż dwa lata, pochodzących z obszarów, w których w wyniku badań kontrolnych stwierdzono ogólną obecność metali ciężkich w środowisku,
16) płuca świń zanieczyszczone treścią pokarmową lub zalane wodą do oparzania,
17) mięso, które było poddane radiacji jonizującej lub ultrafioletowej,
18) mięso, które wydziela silny zapach płciowy.
2. Za mięso o ograniczonej przydatności do spożycia należy uznać:
1) mięso pochodzące:
a) z knurów używanych do rozrodu,
b) ze świń wnętrów lub obojnaków,
c) od niewykastrowanych męskich osobników świń o wadze tuszy powyżej 80 kg, które nie posiadają wyraźnego odoru knura,
2) mięso oddzielone mechanicznie (MOM),
3) mięso i narządy wewnętrzne zwierząt, które nie wykazywały tasiemczycy lub wągrzycy, po usunięciu części niezdatnych do spożycia,
4) mięso zwierząt poddanych ubojowi z konieczności.
II. Mięso drobiu
Za mięso niezdatne do spożycia należy uznać:
1) mięso, jeżeli badanie potwierdzi, że zwierzę, od którego mięso pochodzi, było dotknięte jedną z następujących chorób:
a) influenza drobiu (pomór drobiu),
b) rzekomy pomór drobiu,
c) salmoneloza,
d) cholera,
e) ornitoza,
f) charłactwo,
g) wodobrzusze,
h) żółtaczka,
i) aspergiloza,
j) toksoplazmoza,
k) nowotwory złośliwe,
2) mięso pochodzące od zwierząt, których śmierć nastąpiła z innych przyczyn niż ubój,
3) mięso ogólnie zanieczyszczone,
4) mięso wykazujące:
a) rozległe uszkodzenia mechaniczne i krwawe wybroczyny,
b) nieprawidłowości dotyczące zapachu; barwy, smaku lub konsystencji,
c) zmiany gnilne,
d) pasożyty podskórne lub mięśniowe,
e) objawy zatrucia,
f) białaczkę,
g) inne niż wymienione w pkt 1 choroby przenoszone na ludzi,
5) części ubitego zwierzęcia, które wykazują miejscowe uszkodzenia mechaniczne, nie mające ujemnego wpływu na jakość zdrowotną reszty tuszy,
6) tchawicę, płuca, przełyk, wole, jelito i pęcherzyk żółciowy,
7) mięso zawierające pozostałości substancji biologicznych, chemicznych i leków weterynaryjnych, w przypadku gdy przekraczają dozwolony poziom określony innymi przepisami.
III. Króliki i nutrie
Za mięso niezdatne do spożycia należy uznać:
1) mięso, jeżeli badanie potwierdzi, że zwierzę, od którego mięso pochodzi, było dotknięte chorobą zakaźną przenoszącą się na ludzi i zwierzęta,
2) mięso wykazujące:
a) ogniska zapalne lub liczne ropnie,
b) pasożyty podskórne lub mięśniowe,
c) zmiany wskazujące na zatrucie,
d) rozległe uszkodzenia mechaniczne lub krwawe wybroczyny,
e) nieprawidłowości dotyczące zapachu, barwy, smaku lub konsystencji,
f) zmiany gnilne,
3) mięso zawierające pozostałości substancji biologicznych, chemicznych i leków weterynaryjnych, w przypadku gdy przekraczają dozwolony poziom określony innymi przepisami,
4) mięso części ubitego zwierzęcia, które wykazują miejscowe uszkodzenia mechaniczne, nie mające ujemnego wpływu na jakość zdrowotną reszty tuszy.
IV. Mięso dziczyzny
Za niezdatne do spożycia należy uznać mięso:
1) pochodzące od zwierząt łownych zachowujących się według oświadczenia myśliwego nienormalnie lub pochodzących z terenów, na których stwierdzono zaburzenia w populacji tych zwierząt,
2) jeżeli badanie po odstrzeleniu zwierzęcia wykazało:
a) obecność włośni,
b) że zwierzę, od którego mięso pochodzi, było dotknięte zapaleniem stawów, jąder lub jelit,
c) występowanie licznych guzów lub ropni,
d) zmiany w wątrobie lub śledzionie,
e) obecność ciał obcych w jamach ciała, zwłaszcza w żołądku i jelitach lub w pęcherzu moczowym,
f) powstanie znacznych ilości gazu w żołądku i jelitach, wraz z odbarwieniem narządów wewnętrznych,
g) zmiany dotyczące barwy, zapachu, smaku lub konsystencji,
h) zmiany gnilne,
i) złamania otwarte, jeśli nie są bezpośrednio związane z polowaniem,
j) wychudzenie,
k) ogólny lub umiejscowiony obrzęk,
I) inne zmiany chorobowe,
3) jeżeli badanie wykazało, że mięso pozyskano niezgodnie z prawem łowieckim.
Załącznik nr 4
Wzór – DZIENNIK BADANIA PRZEDUBOJOWEGO ZWIERZĄT
Załącznik nr 5
Wzór – DZIENNIK BADANIA POUBOJOWEGO ZWIERZĄT RZEŹNYCH I DZICZYZNY
- Data ogłoszenia: 1998-12-18
- Data wejścia w życie: 1998-12-18
- Data obowiązywania: 1998-12-18
- Z mocą od: 1998-12-18
- Dokument traci ważność: 2002-10-08
- ROZPORZĄDZENIE MINISTRA ROLNICTWA I ROZWOJU WSI z dnia 19 marca 2001 r. zmieniające rozporządzenie w sprawie sposobu badania zwierząt rzeźnych, badania, oceny i znakowania mięsa, wykorzystania mięsa o ograniczonej przydatności do spożycia, mięsa niezdatnego do spożycia oraz prowadzenia dokumentacji z tym związanej
- ROZPORZĄDZENIE MINISTRA ROLNICTWA I ROZWOJU WSI z dnia 18 października 2001 r. zmieniające rozporządzenie w sprawie sposobu badania zwierząt rzeźnych, badania, oceny i znakowania mięsa, wykorzystania mięsa o ograniczonej przydatności do spożycia, mięsa niezdatnego do spożycia oraz prowadzenia dokumentacji z tym związanej
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
